凡纳滨对虾内源蛋白酶对肌原纤维蛋白的降解作用
陈诗妍,吉宏武,2,3,*,李承勇,3,苏伟明,3,郝记明,黄杰恒
(1.广东海洋大学食品科技学院,广东湛江 524088;2.水产品深加工广东省普通高校重点实验室,广东湛江 524088;3.广东省水产品加工与安全重点实验室,广东湛江 524088)
凡纳滨对虾内源蛋白酶对肌原纤维蛋白的降解作用
陈诗妍1,吉宏武1,2,3,*,李承勇1,3,苏伟明1,3,郝记明1,黄杰恒1
(1.广东海洋大学食品科技学院,广东湛江 524088;2.水产品深加工广东省普通高校重点实验室,广东湛江 524088;3.广东省水产品加工与安全重点实验室,广东湛江 524088)
为确定引起凡纳滨对虾自溶的主要酶类及分布部位,本文测定了凡纳滨对虾各内源蛋白酶的活性,分析主要内源蛋白酶贮藏期间的变化,并比较主要内源蛋白酶对虾肌原纤维蛋白的降解作用。结果显示,虾头蛋白酶活达90.17U/mg,是虾肉的300倍。虾头中的胰蛋白酶活性最高,达13.59U/mg。全虾贮藏4d后虾肉总酶活和胰蛋白酶活增加,于第8d虾肉第一腹节总酶活增至1.66U/mg,胰蛋白酰胺酶和酯酶活分别达到0.97U/mg和1.84U/mg。SDS-PAGE结果显示,随贮藏温度和时间的增大,内源酶对肌原纤维蛋白的肌球蛋白重链(MHC)和肌动蛋白(Actin)降解程度越大,其中虾头中胰蛋白酶对肌原纤维蛋白的降解作用最强。因此凡纳滨对虾胰蛋白酶很可能是肌肉软化的主要作用酶。
凡纳滨对虾,内源蛋白酶,肌原纤维蛋白,肌肉软化,胰蛋白酶
水产品死后由于内源蛋白酶的自溶作用,肌肉极易软化,严重影响到水产品的质量和商业价值。如何防止肌肉自溶,抑制组织软化,是目前水产品保鲜技术上亟待解决的问题。目前研究发现,水产品的内源蛋白酶主要有肌钙蛋白酶、溶酶体组织蛋白酶、基质金属蛋白酶、蛋白酶体、耐热型碱性蛋白酶和消化道蛋白酶等[1]。内源蛋白酶的作用是个复杂的过程,不同蛋白酶作用不同[2-3]。鱼类的自溶现象主要由肌肉中的蛋白酶引起,其中组织蛋白酶和肌钙蛋白酶是主要作用酶[4-6]。对于无脊椎动物的虾类,自溶还可能与头部的消化酶有关。如在罗氏沼虾等淡水虾中,自溶现象最先出现在接近虾头的第一腹节[7]。来源于虾头的蛋白酶对肌肉组织有显著的降解效果,并与虾肉的质构变化存有一定相关性[[8-10]。贮藏期间虾头的胰蛋白酶出现在肌肉中[11]。胰蛋白酶属丝氨酸蛋白酶家族,是虾头中最主要的碱性蛋白酶,具有较强的蛋白水解性[12]。
凡纳滨对虾是我国主要对虾品种,头部富含各种消化酶,具有很强的自溶能力[13],其中胃蛋白酶和胰蛋白酶是虾头最主要的消化酶[14]。在凡纳滨对虾的贮藏期间,消化酶也出现在虾肉中[15],但这方面缺乏进一步的研究证实。为确定引起凡纳滨对虾自溶的主要蛋白酶,探索凡纳滨对虾头部的蛋白酶能否向肌肉迁移,是否对肌肉产生降解,本研究对凡纳滨对虾头部与肌肉中内源蛋白酶的活性进行检测,分析主要内源蛋白酶贮藏期间的变化,并比较主要内源蛋白酶对肌原纤维蛋白的降解作用,为开发新型保鲜技术奠定理论基础。
1 材料与方法
1.1 材料与仪器
凡纳滨对虾(Litopenaeusvannamei) 2013年7月于湛江恒兴南方海洋科技有限公司养殖基地(国家(863)海水养殖种子工程南方基地)采样,活运至水产品深加工广东省普通高校重点实验室,清洗后选取完整个体冰藏待用;BApNA,TAME,Suc-Leu-Tyr-AMC,Z-Arg-Arg-AMC,Z-Phe-Arg-AMC,L-Arg-AMC 购于Sigma公司;DMSO 购于Amresco公司;牛血清白蛋白 购于Genview公司;酪蛋白 购于国药集团化学试剂有限公司;SDS-PAGE预制胶 购于上海迪申生物技术有限公司;蛋白质Markers 购于宝生物工程(大连)有限公司;其他试剂均为分析纯。
KK22F57TI型电冰箱 西门子有限公司;T25型匀浆机 德国IKA公司;CR22GⅡ型高速冷冻离心机 日本日立公司;DYCZ-24DN型迷你双垂直电泳槽 北京六一仪器厂;Gel Doc XR+凝胶成像仪 美国Bio-Rad公司;UV-210PC分光光度计 上海森超贸易有限公司;全波长多功能酶标仪 美国热电公司。
1.2 实验方法
1.2.1 内源蛋白酶活性测定
1.2.1.1 虾头和虾肉蛋白酶活性 取新鲜虾头与虾肉分别加入3倍体积pH8.0、20mmol/L的磷酸缓冲液(Phosphate Buffer Solution,PBS)和pH7.0、20mmol/L的PBS,匀浆,4℃ 10000r/min离心30min,得虾头和虾肉粗酶液,并测定该酶活。
1.2.1.2 虾头胃蛋白酶和胰蛋白酶活性 取新鲜虾头分别加入3倍体积pH3.0、20mmol/L甘氨酸-盐酸缓冲液和pH8.0、20mmol/L PBS,匀浆,4℃ 10000r/min离心30min,收集上清液。经硫酸铵分级沉淀后透析,得虾头胃蛋白酶和胰蛋白酶粗酶液,并测定该酶活。
1.2.1.3 虾肉肌钙蛋白酶和组织蛋白酶活性 取虾肉粗酶液,分别以Suc-Leu-Tyr-AMC、Z-Arg-Arg-AMC、Z-Phe-Arg-AMC、L-Arg-AMC为特异性底物测定肌肉中肌钙蛋白酶、组织蛋白酶B、L、H的活性。
1.2.1.4 可溶性蛋白的测定方法 采用Lowry法,以牛血清白蛋白为标准样品。
1.2.2 内源蛋白酶贮藏过程的变化
1.2.2.1 预处理 取鲜活凡纳滨对虾用冰猝死,一组用刀切去虾头及肠线,另一组为全虾。将两组虾浸泡到1∶5(m∶v)0.1%NaN3抑菌溶液10min,低温晾干3min,0℃贮藏0~8d,取虾头及虾肌肉第一、二腹节进行酶活检测。
1.2.2.2 总蛋白酶活测定 参照1.2.1.1的方法测定。
1.2.2.3 胰蛋白酶特异性酶活测定 酰胺酶活测定:以BApNA为底物,反应体系为200μL样品+1mL缓冲液(50mmol/L Tris-HCl,10mmol/L CaCl2,pH为8)+200μL 4mg/mL BApNA,于25℃反应15min,以400μL 30%的乙酸终止反应。生成的ρ-硝基苯胺含量在分光光度计上(410nm)测定各吸光值。在波长410nm的吸光度下每分钟生成1μmol ρ-硝基苯胺相当的酶量为1个酶活力单位。
酶活力(U/mL)=(A-A0)×反应体积(mL)×106/8800×15(min)×0.2
其中:A和A0分别为样品和空白的A410;8800cm-1M-1为ρ-硝基苯胺消光系数;106为单位转换倍数1mol=106μmol;15min为反应时间。
酯酶活测定:以TAME为底物,反应体系为20μL样品+3mL 1mmol/L TAME的pH8.0 10mmol/L Tris-HCl缓冲液,于25℃反应15min。生成的ρ-甲苯磺酰基精氨酸含量在分光光度计上(247nm)测定各吸光值。在波长247nm下每分钟增加的吸光值相当的酶量为1个酶活力单位。
其中:A和A0分别为样品和空白的A247。
1.2.3 内源蛋白酶对肌原纤维蛋白的降解作用
1.2.3.1 内源蛋白酶制备 虾头和虾肉蛋白酶提取同1.2.1.1;虾头胃蛋白酶和胰蛋白酶提取同1.2.1.2。
1.2.3.2 肌原纤维蛋白的提取 取虾肉加入10倍体积的预冷缓冲液(15.6mmol/L Na2HPO4,3.5mmol/L KH2PO4,pH7.5)均质,4℃ 5000r/min离心20min,取沉淀中加入10倍体积预冷缓冲液(0.45mol/L KCl,15.6mmol/L Na2HPO4,3.5mmol/L KH2PO4,pH7.5),均质,4℃ 5000r/min离心20min,得肌原纤维蛋白液。

表1 凡纳滨对虾内源蛋白酶活性测定Table 1 Different endogenous proteases activities from Litopenaeus vannamei shrimp
注:数据用平均值±标准差表示(n=3),下同。
1.2.3.3 内源蛋白酶与肌原纤维蛋白反应 粗酶液与肌原纤维蛋白液混合,0、10、25℃下分别反应8、4d和8h,并分别每2、1d和2h取样。反应体系为反应液100μL+50μL终止液(2% SDS,8mol/L尿素,2%β-巯基乙醇,85℃),85℃反应60min,待用。
1.2.3.4 SDS-PAGE分析 取20μL蛋白液加上样缓冲液后,不同蛋白酶与肌原纤维蛋白的反应结果加热3~5min,进行SDS-PAGE分析。电泳条件:分离胶浓度10%,浓缩胶浓度5%,恒压200V。以考马斯亮蓝R-250染色,于凝胶成像系统分析肌球蛋白重链(MHC)和肌动蛋白(Actin)的带强变化。
1.3 数据处理
所有数据分别应用JMP软件和Origin软件进行数据分析和绘图,数据分析中,组间比较采用t-检验,显著性界值为p=0.05,p<0.05为差异显著,p≥0.05说明没有显著性差异。
2 结果与讨论
2.1 内源蛋白酶活性测定
无脊椎动物是一类缺乏完整消化系统的低等生物,消化器官无明显分界。凡纳滨对虾属无脊椎水生生物,主要消化器官为集中在头部的肝胰脏消化腺,仅由一层被膜包裹,内含多种消化酶[16]。从表1可见,凡纳滨对虾头部的蛋白酶活高达90.17U/mg,是虾肉的300倍;在虾头中,胰蛋白酶活性最高,达13.59U/mg;在虾肉中,组织蛋白酶L最高,达0.072U/mg。对比6种主要内源蛋白酶,头部胰蛋白酶活性最高,是肌肉组织蛋白酶的100余倍。吴燕燕[17]和Hernandez[18]等都证实了凡纳滨对虾头部蛋白酶聚集的部位,具有较高的蛋白酶活。据文献[19-20]报道,虾头中胰蛋白酶是最主要的蛋白酶。Sriket[10]在罗氏沼虾肌肉中也检测到肌钙蛋白酶和组织蛋白酶L的活性,证实组织蛋白酶L活性较高。Chen[21]和Wang[22]分别在克氏螯虾和斑节对虾肌肉中也发现了肌钙蛋白酶类。组织蛋白酶在鱼类肌肉中报道得比较多,主要有组织蛋白酶B、D、L、H等[1,23]。
2.2 内源蛋白酶贮藏过程的变化
2.2.1 总蛋白酶活变化 从图1-a可见,贮藏期间凡纳滨对虾头部的总蛋白酶活基本没有变化,而虾肌肉的总蛋白酶活随贮藏时间延长不断增大(p<0.05)。虾头总蛋白酶在贮藏8d内仍保持较高的活性,酶活仅下降19.42%。虾肉中,贮藏4d的全虾第一腹节总蛋白酶活从0.23U/mg增至0.92U/mg,并在8d升至1.66U/mg;全虾第二腹节总蛋白酶活也在第8d有出现上升趋势,达0.37U/mg;去头虾各腹节总蛋白酶活无明显变化。Sriket等[11]在罗氏沼虾的贮藏期间也观察到这种现象。由于虾经NaN3处理,可排除微生物的影响,所以这种现象的出现很可能是因为贮藏期间虾头部的内源蛋白酶向虾肌肉扩散并产生迁移引起的。

图1 虾不同部位总蛋白酶(a) 与胰蛋白酶酰胺酶(b)和酯酶(c)的活性Fig.1 Total proteolytic activity(a)and trypsin activity assayed as amidase activity(b)and esterase activity(c) of different segments of shrimp
注:标注不同字母表示有显著差异(p<0.05)。
2.2.2 胰蛋白酶活变化 凡纳滨对虾胰蛋白酶在贮藏期间的变化情况由胰蛋白酶的酰胺酶活(图1-b)和酯酶活(图1-c)表示。图中显示,虾头的胰蛋白酶保持较高的活性,变化不大。虾肉中,贮藏4d的全虾第一腹节开始出现胰蛋白酶酰胺酶,酶活达0.82U/mg,8d后该酶在全虾第二腹节出现,达到0.34U/mg(图1-b);胰蛋白酶的酯酶也在贮藏4d的全虾第一腹节出现,酶活达0.053U/mg,8d增至1.84U/mg,但未在第二腹节检测酯酶活(图1-c);去头虾各腹节未检测到酯酶活性。这种现象的出现很可能是因为虾头中部分胰蛋白酶在贮藏期间逐渐向虾肉迁移。相似的情况也出现在罗氏沼虾的研究中[11]。Ezquerra[15]在贮藏期间也检测到有消化酶出现在凡纳滨对虾肌肉中。
2.3 内源蛋白酶对肌原纤维蛋白的降解作用
2.3.1 虾头与虾肉蛋白酶作用 来源于凡纳滨对虾不同部位的内源蛋白酶对肌原纤维蛋白的降解作用如图2所示,对肌原纤维蛋白中的肌球蛋白重链(MHC)和肌动蛋白(Actin)的降解程度如图3所示。虾头中的内源蛋白酶对肌原纤维蛋白的降解作用最强(图2a、图2c、图2e),虾肉中的内源蛋白酶对肌原纤维蛋白几乎无降解作用(图2b、图2d、图2f)。这是因为凡纳滨对虾头部是消化器官集中的部位,富含多种消化酶,而肌肉的蛋白酶种类和含量较少[16]。Oh[24]也阐明了虾的头部具有很高的蛋白水解能力。

图2 不同温度下虾头和虾肉粗酶对肌原纤维蛋白降解的SDS-PAGE图Fig.2 SDS-PAGE of myofibrillar protein incubated with crude extract from head and muscle of shrimp at different temperature
注:a,b分别为25℃虾头和虾肉粗酶液;c,d分别为10℃虾头和虾肉粗酶液;e,f分别为0℃虾头 和虾肉粗酶液;图中M为分子量Marker;C0、C4、C8为反应不同时间的空白组。
在三个贮藏温度下,虾头的蛋白酶对分子量约200ku的MHC降解很明显,在200ku条带不断减弱的同时66.4~116ku区间的强度先是不断增加,至200ku条带消失后该区间强度开始减弱;分子量约40ku的Actin也出现明显的降解,在40ku条带不断减弱的同时30~40ku区间的强度先是不断增加,至40ku条带消失后该区间强度开始减弱。这结果说明虾头的蛋白酶可能将MHC和Actin降解为小分子蛋白或肽,小分子蛋白或肽再进一步分解分子量更小的物质。Sriket[10]在罗氏沼虾的研究中也说明了虾头的蛋白酶对肌原纤维蛋白和胶原蛋白有很强的降解作用。
虾头的蛋白酶对肌纤维蛋白的降解速度与贮藏的温度密切相关。如图3所示,25℃,8h虾头蛋白酶作用下的MHC和Actin分别下降了96.36%和77.52%;10℃,4d MHC和Actin分别下降96.80%和97.59%;0℃,8d MHC和Actin分别下降97.97%和94.82%。贮藏温度越高,虾头蛋白酶对肌原纤维蛋白降解速度越快。蛋白酶活受温度影响较大,在一定温度范围内,贮藏温度越高,酶活性越高,因此虾头蛋白酶对肌原纤维蛋白的降解越快[25]。

图3 不同温度下虾头和虾肉酶对肌球蛋白和肌动蛋白降解情况Fig.3 MHC and actin incubated with crude extract from head and muscle of shrimp at different temperature
注:a,b:25℃;c,d:10℃;e,f:0℃。
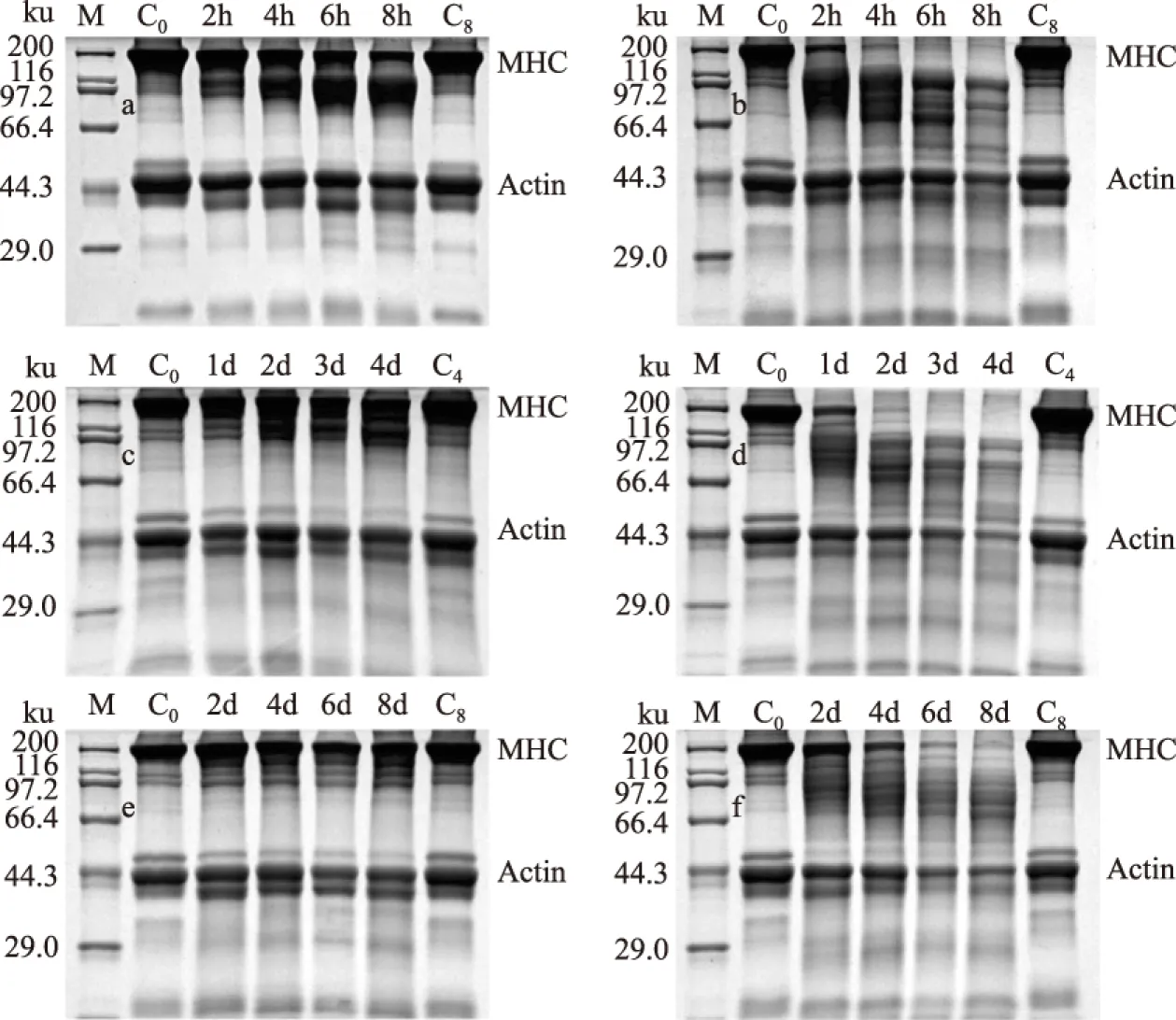
图4 不同温度下虾头胃蛋白酶和胰蛋白酶对肌原纤维蛋白降解的SDS-PAGE图Fig.4 SDS-PAGE of myofibrillar protein incubated with acid and alkaline proteinase from head of shrimp at different temperature
注:a,b分别为25℃胃蛋白酶和胰蛋白酶;c,d分别为10℃胃蛋白酶和胰蛋白酶;e,f分别为0℃胃蛋白酶 和胰蛋白酶;图中M为分子量Marker;C0、C4、C8为反应不同时间的空白组。

图5 不同温度下虾头胃蛋白酶和胰蛋白酶对肌原纤维蛋白的肌球蛋白和肌动蛋白降解情况Fig.5 MHC and Actin of myofibrillar protein incubated with acid and alkaline proteinase from head of shrimp at different temperature
注:a,b:25℃;c,d:10℃;e,f:0℃。
2.3.2 虾头胃蛋白酶和胰蛋白酶的作用 凡纳滨对虾头部的胃蛋白酶和胰蛋白酶对肌原纤维蛋白的作用如图4所示,对肌原纤维蛋白中的肌球蛋白重链(MHC)和肌动蛋白(Actin)的降解程度如图5所示。虾头胰蛋白酶对肌原纤维蛋白的降解作用最强(图4b、图4d、图4f),胃蛋白酶对肌原纤维蛋白降解作用较弱(图4a、图4c、图4e)。胃蛋白酶属酸性蛋白酶,胰蛋白酶属碱性蛋白酶[14],在pH接近7的虾肉中,胰蛋白酶具有较高活性而胃蛋白酶受到抑制,所以胰蛋白酶对肌原纤维蛋白有较强的降解作用。
在三个贮藏温度下,胰蛋白酶对分子量约200ku的MHC降解作用明显,在200ku条带不断减弱的同时66.4~116ku区间的强度先是不断增加,至200ku条带消失后该区间强度开始减弱;分子量约40ku的Actin降解较缓慢,在40ku条带不断减弱的同时30~40ku区间的强度不断增强。这是MHC和Actin被胰蛋白酶降解成小分子蛋白或肽的结果。根据文献[26-27]报道,胰蛋白酶对虾肌肉蛋白尤其是肌纤维蛋白和胶原蛋白具有很强的水解性。
不同温度下,胰蛋白酶对肌纤维蛋白的降解速度不同。如图5所示,25℃,8h胰蛋白酶作用下MHC和Actin分别下降了96.84%和56.22%;10℃,4d MHC和Actin分别下降97.70%和75.68%;0℃,8d MHC和Actin分别下降93.16%和66.75%。这说明贮藏温度越高,胰蛋白酶对肌原纤维蛋白降解速度越快。胰蛋白酶的活性对贮藏温度敏感,在适宜的贮藏温度下,酶活随温度的升高而增大[14]。
因此,可推断在凡纳滨对虾的内源蛋白酶中,胰蛋白酶是肌原纤维蛋白的主要降解酶。
3 结论
凡纳滨对虾内源蛋白酶种类丰富。头部的蛋白酶,尤其是胰蛋白酶活性最高,对肌原纤维蛋白降解作用最强。虾头胰蛋白酶在贮藏期间能向肌肉扩散和迁移,并参与肌原纤维蛋白的降解,导致组织软化。因此推测虾头胰蛋白酶是凡纳滨对虾肌肉软化的主要原因,但胰蛋白酶的对肌原纤维蛋白的降解机制及肌肉中的迁移规律等方面还有待进一步研究。
[1]Delbarre-Ladrat C,Cheret R,Tsylor R,et al.Trends in postmortem aging in fish:Understanding of proteolysis and disorganisation of the myofibrillar structure[J].Critical Reviews in Food Science and Nutrition,2006,46(5):409-421.
[2]叶丽芳,励建荣.海洋鱼虾中内源蛋白酶的研究状况[C].浙江:食品安全监督与法制建设国际研讨会暨第二届中国食品研究生论坛,2005-11-12.
[3]Pacheco-Aguilar R,Lugo-Sanchez M E,Robles-Burgueno M R.Postmortem biochemical and functional characteristic of monterey sardine muscle stored at 0℃[J].Journal of Food Science,2000,65(1):40-47.
[4]Gaarder M,Bahuaud D,Veiseth-Kent E,et al.Relevance of calpain and calpastatin activity for texture in super-chilled and ice-stored Atlantic salmon(Salmo salar L.)fillets[J].Food Chemistry,2012,132(1):9-17.
[5]Cheret R,Delbarre-Ladrat C,Lamballerie-Anton M,et al.Calpain and cathepsin activities in post mortem fish and meat muscles[J].Food Chemistry,2007,101(4):1474-1479.
[6]Godiksen H,Morzel M,Hyldig G,et al.Contribution of cathepsins B,L and D to muscle protein profiles correlated with texture in rainbow trout(Oncorhynchus mykiss)[J].Food Chemistry,2009,113(4):889-896.
[7]Nip W K,Moy J H. Microstructural changes of ice-chilled and cooked freshwater prawn,Macrobrachium rosenbergii[J].Journal of Food Science,1988,53(2):319-322.
[8]Lindner P,Angel S,Zvi G,et al. Study of the Proteolytic Activity of the Hepatopancreas of the Freshwater Prawn,Macrobrachium rosenbergii,and its Role in Inducing Mushiness in Muscle Tissue During Post-Mortem Storage[J].Food Chemistry,1989,32(1):19-29.
[9]Brauer J M E,Leyva J A S,Alvardo L B,et al. Effect of dietary protein on muscle collagen,collagenase and shear force of farmed white shrimp(Litopenaeus vannamei)[J].European Food Research and Technology,2003,217(4):277-280.
[10]Sriket C,Benjakul S,Visessanguan W,et al. Characterisation of proteolytic enzymes from muscle and hepatopancreas of fresh water prawn(Macrobrachium rosenbergii)[J].Society of Chemical Industry,2010,91(1):52-59.
[11]Sriket C,Benjakul S,Visessanguan W,et al. Collagenolytic serine protease in fresh water prawn(Macrobrachium rosenbergii):Characteristics and its impact on muscle during iced storage[J].Food Chemistry,2011,124(1):29-35.
[12]王萍,吴燕燕,李好来,等.虾类胰蛋白酶的研究进展[J].生物技术通报,2011(2):42-97.
[13]曹文红,章超桦,洪鹏志,等.响应面法优化南美白对虾虾头自溶工艺的研究[J].中国食品学报,2009,9(1):158-164.
[14]庄志凯.凡纳滨对虾虾头内源性蛋白酶的分离纯化与酶学特性研究[D].湛江:广东海洋大学,2011.
[15]Ezquerra J M,Garcia-Carreno F L,Haard N F,et al. Effects of feed diets on digestive proteases from the hepatopancreas of white shrimp(Penaeus vannamei)[J].Journal of Food Biochemistry,1997,21(5):401-419.
[16]王克行.虾类健康养殖原理与技术[M].北京:科学出版社,2008,8:56-58.
[17]吴燕燕,王萍,李好来,等.3种不同虾类虾头中酶的筛选[J].广东农业科学,2011(14):116-119.
[18]Hernandez A B,Farias S I.Invitrostudies of the effects of aflatoxin B1and fumonisin B1on trypsin-like and collagenase-like activity from the hepatopancreas of white shrimp(Litopenaeus vannamei)[J].Agriculture,2005,250(1):399-410.
[19]银凤,周爱梅,张祥刚,等.南美白对虾虾头主要自溶酶的分离纯化及鉴定[J].食品与发酵工业,2011,37(3):23-26.
[20]翁凌,李腾,阴利华,等.南美白对虾丝氨酸蛋白酶的分离纯化及性质研究[J].2009,15(4):32-38.
[21]Chen G,Guttmann R P,Xiong Y L,et al.Protease activity in post-mortem red swamp crayfish(Procambarus clarkii)muscle stored in modified atmosphere packaging[J].Journal of Agricultural Food Chemistry,2008,56(18):8658-8663.
[22]Wang J H,Ma W C,Su J C,et al.Comparison of the properties of m-calpain from tilapia and grass shrimp muscles[J].Journal of Agricultural Food Chemistry,1993,41(1):1379-1384.
[23]陈琳,唐玮,徐幸连,等.溶酶体中的组织蛋白酶及其在肌肉成熟中的作用[J].江西农业学报,2008,20(2):72-75.
[24]Oh E S,Kim D S,Kim J H,et al. Enzymatic properties of a protease from the hepatopancreas of shrimp,Penaeus orientalis[J].Journal of Food Biochemistry,2000,24(3):251-264.
[25]朱国萍,曹文红,章超桦,等.凡纳滨对虾虾头自溶动力学[J].水产学报,2010,34(3):395-403.
[26]Wang P A,Vang B,Pedersen A M,et al. Post-mortem degradation of myosin heavy chain in intact fish muscle:Effects of pH and enzyme inhibitors[J].Food Chemistry,2011,124(3):1090-1095.
[27]Aoki H,Ahsan M N,Matsuo K,et al. Purification and characterization of collagenolytic proteases from the hepatopancreas of northern shrimp(Pandalus eous)[J].Journal of Agricultural Food Chemistry,2003,51(3):777-783.
Degradation of myofibrillar protein by endogenous proteasesfromLitopenaeusvannamei
CHEN Shi-yan1,JI Hong-wu1,2,3,*,LI Cheng-yong1,3,SU Wei-ming1,3,HAO Ji-ming1,HUANG Jie-heng1
(1. College of Food Science and Technology,Zhanjiang 524088,China;2.Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China;3. Guangdong Provincial Key Laboratory of Aquatic Product Processingand Safety,Guangdong Ocean University,Zhanjiang 524088,China)
In order to determine the endogenous protease that results in muscle softening and its distribution inLitopenaeusvannamei,different endogenous proteases activities from the shrimp were examined,as well as the changes of main proteases during ice storage and the proteolytic degradation of myofibrillar protein by endogenous proteases were monitored in this study. Results showed that proteolytic activity in the shrimp head was up to 90.17U/mg,300 times higher than that in muscle. In shrimp head,the trypsin was the most important proteinase,with 13.59U/mg activities. In addition,the increase of total proteolytic and trypsin activities in shrimp muscle were detected after 4 days of storage,and the total proteolytic activity in first segments increased to 1.66U/mg after 8 days of storage,while trypsin activities were 0.97U/mg and 1.84U/mg when BApNA and TAME were used as substrate,respectively. In the results of SDS-PAGE,the degradation of MHC and Actin in myofibrillar protein by endogenous proteases was enhanced with increasing storage temperature and time. Among them,the trypsin had the most remarkable effect on the degradation of myofibrillar protein. Therefore,these results indicated that the release of trypsin fromLitopenaeusvannameishrimp head was most likely responsible for the undesirable softening of the shrimp muscle during post-mortem storage.
Litopenaeusvannamei;endogenous proteases;myofibrillar protein;muscle softening;trypsin
2014-05-19
陈诗妍(1990-),女,硕士研究生,研究方向:水产品高值化加工与利用。
*通讯作者:吉宏武(1962-),男,博士,教授,研究方向:水产品高值化加工与利用。
国家虾产业技术体系建设专项资金(CARS-47);广东省海洋渔业科技攻关重大项目(A201008102);广东省科技团队项目(2011A020102005);广东海洋渔业科技推广专项科技攻关与研发项目(A201209C02)。
TS251.1
A
1002-0306(2015)05-0149-07
10.13386/j.issn1002-0306.2015.05.023

