三种贮藏低温对厚皮甜瓜果实活性氧产生和清除的比较
李海杰,葛永红,董柏余,龚 迪,刘文妮,毕 阳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
三种贮藏低温对厚皮甜瓜果实活性氧产生和清除的比较
李海杰,葛永红,董柏余,龚 迪,刘文妮,毕 阳*
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
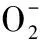
厚皮甜瓜,活性氧,低温,冷害
厚皮甜瓜(CucumismeloL.)是我国西北地区的特色经济作物,其果香味甜,风味独特,深受广大消费者的喜爱。然而,由于大多数厚皮甜瓜果实产期相对集中,且正值高温夏季,加之缺乏有效的包装和必要的冷链,采后寿命不长且烂损严重[1]。虽然低温能够有效延长甜瓜的采后寿命,但甜瓜果实对冷害敏感[2]。据报道,‘白兰瓜’的适宜冷藏温度为9~10℃,4~5℃则会引起不同程度的冷害[3]。早熟、中熟和晚熟哈密瓜分别在7、5和3℃下均会不同程度发生冷害[4]。

1 材料与方法
1.1 材料与仪器
供试果实厚皮甜瓜品种为‘金红宝’,于2013年7月10日至30日采自甘肃省民勤县收成乡露天栽培大田,单果套发泡网袋后入包装箱(12个/每箱),第2d运抵实验室。
实验仪器有恒温培养箱 上海新苗医疗器械制造有限公司;紫外分光光度计 日本岛津UV-2450;YXJ-2离心机 湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 样品处理 挑选大小均一、无机械伤和病害的健康果实,分别贮藏在3、7和9℃的恒温培养箱中贮藏待用。每个处理12个果实,重复3次。
1.2.2 取样 分别于第0、4、8、12d时从恒温培养箱中取出果实,在室温下放置24h后取样。用水果刀取果实赤道附近皮下5~10mm处果肉组织,用锡箔纸包好,每包3g,液氮速冻后,在-80℃超低温冰箱中保存待测。
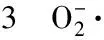
H2O2含量参照李永才等方法[11]。取3g冷冻的组织样品,加入5mL冷丙酮,冰浴磨成匀浆后于4℃下12000×g离心20min。取1mL上清液,加入100μL 20%的四氯化钛溶液(溶于浓盐酸,V/V)和200μL浓氨水,混匀反应5min后离心15min。沉淀部分用冷丙酮洗涤4次以减少色素的干扰,最后将沉淀溶于3mL 2mol/L H2SO4溶液中,于410nm测定溶液的吸光度值。按同法作H2O2标准曲线。H2O2含量以μmol/g表示。重复测定3次。
1.2.4 抗氧化酶活性的测定
1.2.4.1 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性测定 参照王云飞等方法[12]:取3g冷冻的组织样品,加入3mL 100mmol/L磷酸缓冲液(pH7.5,含5mmol/L二硫苏糖醇(DTT)和2% PVPP(W/V)),冰浴条件下研磨成匀浆后于4℃、12000×g离心30min,上清液立即用于酶活性测定。
SOD活性测定:取5mL离心管4支,2支为测定管,另2支为对照管,依次加入1.5mL 50mmol/L磷酸缓冲液、0.3mL 130mmol/L甲硫氨酸(MET)溶液、0.3mL 750μmol/L氮蓝四唑(NBT)溶液、0.3mL 100μmol/L EDTA-Na2溶液、0.3mL粗酶液,最后加入0.3mL 20μmol/L核黄素。其中对照2支管以缓冲液代替酶液,混匀后将1支对照管置于暗处,其它各管于4000LUX日光灯下反应15min。至反应结束后,以不照光管做空白参比,于560nm处分别测定其它各管的吸光度值。SOD活性以每毫克蛋白抑制氮蓝四唑(NBT)光化还原的50%为一个酶活性单位(U)表示。重复测定3次。
SOD比活力(U)=(A0照光对照管-As样品管)/(0.5×A0照光对照管×P测定用酶液蛋白含量)
CAT活性测定:反应体系包括2mL 10mmol/L H2O2(用50mmol/L、pH7.5的磷酸缓冲液配制)和200μL粗酶液。在240nm处测定2min内样品的吸光值。CAT活性以0.01 ΔOD240/min·g表示。重复测定3次。
1.2.4.2 谷胱甘肽还原酶(GR)活性测定 参考Ren等方法[13]。称取3g冷冻的组织样品,加入5mL经4℃预冷的100mmol/L、pH 7.5的磷酸缓冲液(含1mmol/L EDTA),在冰浴条件下研磨成匀浆,于4℃、12000×g离心30min,上清液用于GR活性测定。酶促反应体系由3mL 100mmol/L pH7.5的磷酸缓冲液(含1mmol/L EDTA),0.1mL 5mmol/L GSSG(氧化型谷胱甘肽),0.2mL酶液和30μL 3mmol/L NADPH组成(最后加入NADPH启动酶促反应)。从启动后15s开始记录反应体系在340nm的吸光度值,连续测定2min。酶活性表示为0.01ΔOD340/(min·g)。样品重复测定3次。
1.2.4.3 抗坏血酸过氧化物酶(APX)活性的测定 参照Ren等方法[13]。称取3g冷冻的组织样品,加入5mL经4℃预冷的100mmol/L磷酸缓冲液(pH7.5,含1mmol/L EDTA),在冰浴条件下研磨成匀浆,于4℃、12000×g离心30min,收集上清液,用于APX活性的测定。酶促反应体系由2mL 100mmol/L磷酸缓冲液(pH 7.5,含1mmol/L EDTA),0.8mL 3mmol/L抗坏血酸,200μL粗酶液和0.5mL 0.5mmol/L H2O2组成,最后加入H2O2启动酶促反应。从启动后15s开始记录反应体系在290nm的吸光度值,连续测定2min。酶活性表示为0.01ΔOD290/(min·g)。样品重复测定3次。
1.3 数据处理
用Excel 2007软件进行数据处理,计算标准偏差并制图,用SPSS19.0统计分析软件进行显著性分析。
2 结果与分析

图1 三种贮藏低温处理对果实·产生速率 和H202含量的影响。Fig.1 Effect of three low temperatures on the production rate of ·(A)and H2O2 content(B)of fruits注:图中垂线代表标准误差(±SE)。
2.2 三种贮藏低温处理对果实SOD、CAT、GR和APX活性的影响
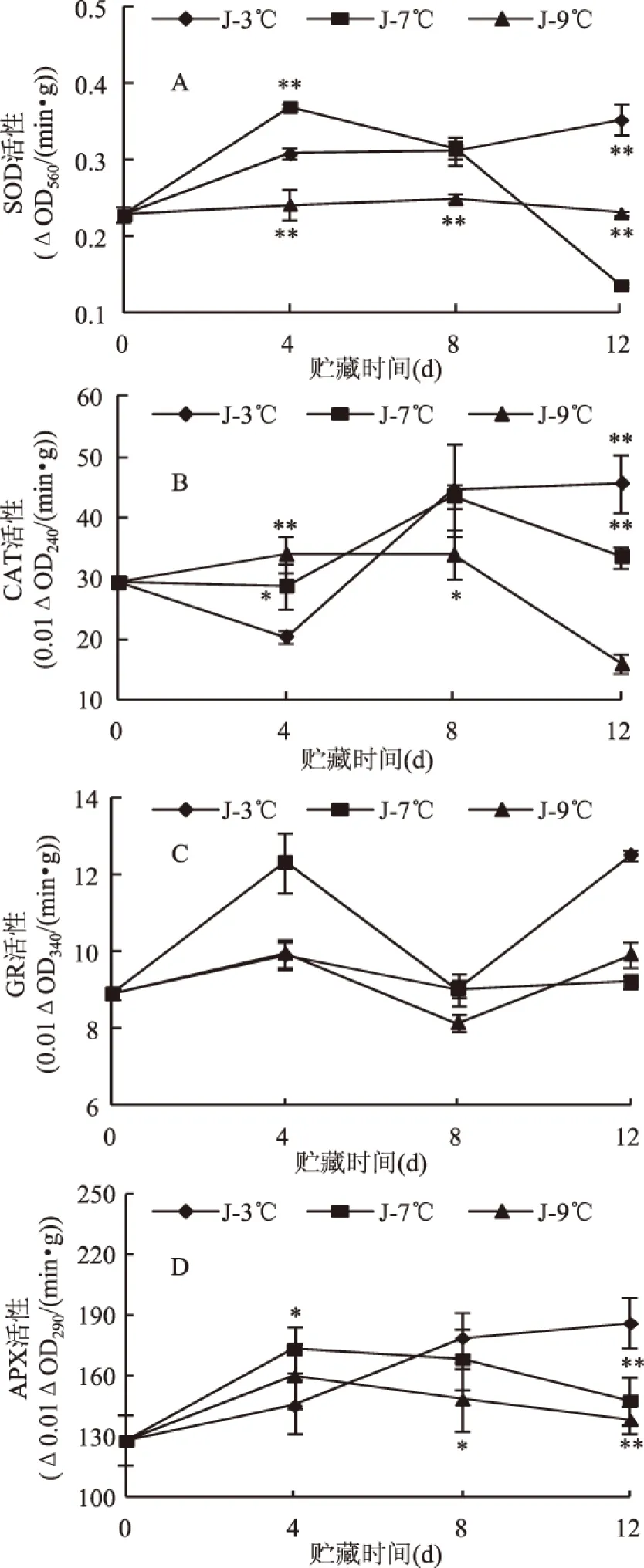
图2 三种贮藏低温处理对果实SOD、 CAT、GR和APX活性的影响。Fig.2 Effect of three low temperatures on the activities of SOD(A),CAT(B),GR(C)and APX(D)of fruits注:图中垂线代表标准误差(±SE),将7℃和9℃下果实的 活性分别与3℃进行比较,*表示差异显著 (0.01 果实在3℃贮藏期间GR活性是逐渐升高的,并在第12d达到最大值,分别高于7℃和9℃的35.58%和25.99%。在7℃贮藏的第4d GR活性出现了最高值,并且高于3℃的24.37%,9℃的23.65%,之后GR活性随着贮藏时间的延长而逐渐降低。在9℃贮藏期间GR的活性变化不大(图2C)。3℃贮藏期间APX活性逐渐增加,在第12d时活性达到最大,比7℃和9℃分别升高了25.73%和34.51%。在7℃和9℃贮藏过程中都是在第4d出现最大值,并随着贮藏时间的增加逐渐降低。但是7℃贮藏的果实APX活性在第4d,第8d和第12d分别高于9℃的8.26%,13.50%和6.99%(图2D)。本实验观察到的7℃下果实的APX和GR活性也呈现先增高后降低的趋势,表明抗坏血酸-谷胱甘肽循环参与了果实的活性氧清除过程,显著提高了果实的耐冷性。然而,在3℃下贮藏前期果实APX和GR活性受到抑制,表明冷害抑制了谷胱甘肽循环,至于该循环如何在果实冷害中发挥作用仍需探求。 本实验研究表明,3℃下大量的H2O2积累以及较低的抗氧化酶活性是导致甜瓜果实冷害发生的重要原因,7℃下果实维持了良好的活性氧产生和清除平衡,为厚皮甜瓜果实贮藏的适宜温度。但关于这三种温度下果实细胞膜完整率、MDA含量和LOX酶活性的变化及其与冷害之间关系仍有待于进一步研究。 [1]Bi Y,Ge Y H,Wang C L,et al. Melon production in China[J].Acta Horticulturae,2005,731(1):493-500. [2]李学文,杨军,廖新福,等.贮藏温度对早熟甜瓜采后生理及品质变化的影响[J].中国农学通报,2012,28(25):154-156. [3]刘芳,王春林,张玉鑫,等.温度对白兰瓜果实贮藏效果的影响[J].食品科学,2006,27(6):230-233. [4]Bi Y,Tian S P,Liu H X,et al. Effect of temperature on chilling injury,decay and quality of Hami melon during storage[J]. Postharvest Biology and Technology,2003,29(2):229-232. [5]Wang C Y. Approaches to reduce chilling injury of fruits and vegetables[J]. Horticultural Reviews,1993,15:63-95. [6]Zheng Y H,Fung R W M,Wang S Y,et al. Transcript levels of antioxidative genes and oxygen radical scavenging enzyme activities in chilled zucchini squash in response to superatmospheric oxygen[J]. Postharvest Biology and Technology,2008,47(2):151-158. [7]杨青珍,饶景萍,王玉萍. ‘徐香’猕猴桃采收后逐步降温处理对果实冷害、品质和活性氧代谢的影响[J]. 园艺学报,2013,40(4):651-662. [8]侯建设,席玙芳,李中华,等.青椒果实冷害及诱导抗冷性与氧化胁迫关系的研究[J].食品科学,2005,26(3):244-248. [9]Yang Z,Cao S,Zheng Y,et al. Combined salicyclic acid and ultrasound treatments for reducing the chilling injury on peach fruit[J]. Journal of Agricultural and Food Chemistry,2012,60(5):1209-1212. [10]Zhao R R,Sheng J P,Lv S N,et al. Nitric oxide participates in the regulation of LeCBF1 gene expression and improves cold tolerance in harvested tomato fruit[J]. Postharvest Biology and Technology,2011,62(2):121-126. [11]李永才,孙小娟,毕阳.壳聚糖处理对马铃薯块茎组织活性氧代谢的影响[J]. 食品工业科技,2010(8):313-315. [12]王云飞,毕阳,任亚琳,等.硅酸钠处理对厚皮甜瓜果实采后病害的控制及活性氧代谢的作用[J].中国农业科学,2012,45(11):2242-2248. [13]Ren Y L,Wang Y,Bi Y,et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon(Cucumis melo L.)fruit[J]. European Food Research and Technology,2012,234(6):963-971. [14]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007. [15]Xu M,Dong J,Zhang M,et al. Cold-induced endogenous nitric oxide generation plays a role in chilling tolerance of loquat fruit during postharvest storage[J]. Postharvest Biology and Technology,2012,65:5-12. [16]王海波,黄椿颖,庞学群,等.茉莉酸甲酯诱导的采后香蕉果实耐冷性与活性氧信号的关系[J].中国农业科学,2008,41(4):1165-1171. [17]侯建设,席琦芳,李中华,等.贮前热处理对2℃贮藏黄瓜抗冷性和自由基生物学的影响[J].食品与发酵工业,2004,30(5):138-142. [18]Yang H Q,Wu F H,Cheng J Y. Reduced chilling injury in cucumber by nitric oxide and the antioxidant response[J]. Food Chemistry,2011,127(3):1237-1242. [19]田世平,罗云波,王贵禧.园艺产品采后生物学基础[M].北京:科学出版社,2011. [20]Chongchatuporn U,Ketsa S,van Doorn W G. Chilling injury in mango(Mangifera indica)fruit peel:Relationship with ascorbic acid concentrations and antioxidant enzyme activities[J]. Postharvest Biology and Technology,2013,86:409-417. [21]金鹏,吕慕雯,孙萃萃,等. MeJA与低温预贮对枇杷冷害和活性氧代谢的影响[J].园艺学报,2012,39(2):461-468. A comparison of reactive oxygen species production and scavenging inmuskmelon fruits during storage under three low temperatures LI Hai-jie,GE Yong-hong,DONG Bo-yu,GONG Di,LIU Wen-ni,BI Yang* (College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China) muskmelons;reactive oxygen species;low temperature;chilling injury 2014-05-04 李海杰(1987-),女,硕士研究生,研究方向:果蔬采后生物学与技术。 *通讯作者:毕阳(1962-),男,博士,教授,研究方向:果蔬采后生物学与技术。 农业部行业专项(201303075)。 TS255.3 A 1002-0306(2015)05-0325-05 10.13386/j.issn1002-0306.2015.05.060
3 讨论


4 结论

——栽培注意事项

