(±)-2-甲基-5-羟基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃黄烷酮的全合成
陈兵兵,杨金会,罗桂林,毕吉利,武 娥
(1.宁夏理工学院文理学院,宁夏石嘴山 753000;2.宁夏大学天然气转化国家重点实验室培育基地,宁夏银川 750021)
黄烷酮化合物是植物体内广泛存在的一类天然产物,大部分具有生理和药理活性[1-3]。(±)-2-甲基-5-羟基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃黄烷酮(1)是 Win Nwet-Nwet等[4]从凹唇姜(Boesenbergia Pandurata)中分离到的一种苯并吡喃黄烷酮;凹唇姜大多生长在热带国家,如马来西亚、缅甸、印度尼西亚等[5],已被广泛用于中药配方治疗哮喘、腹泻、发烧[6]等疾病,研究表明其具有抑制人胰腺癌(PANC-1)细胞的生长的活性。
本课题组一直关注黄烷酮化合物的研究[7-10],1的全合成尚未见报道。作为前期工作的继续,本文以2,4,6-三羟基苯乙酮(2)和柠檬醛为起始原料,经环化、保护酚羟基、羟醛缩合、脱保护、催化环化等反应以5.9%的总产率完成了1的全合成(Scheme 1),其结构经1H NMR,13C NMR和HR-ESI-MS确证。
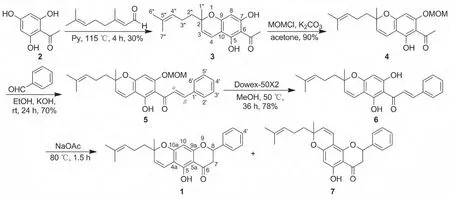
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker AM-400 MHz型核核共振仪(CDCl3为溶剂,TMS为内标);Bruker Ultrafle Xtreme MALDI-TOF/TOF型质谱仪。
硅胶(200目~300目)和GF254硅胶,青岛海洋化工厂;其余所用试剂均为分析纯。
1.2 合成
(1)2-甲基-6-乙酰基-5,7-二羟基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃的合成(3)[11]
在反应瓶中依次加入吡啶3 mL和2 1.070 g(6.0 mmol),搅拌使其溶解;加入97%柠檬醛1.000 g(6.0 mmol),回流(115 ℃)反应 4 h。冷却至室温,减压蒸除溶剂,加少量水,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(石油醚)=1∶15]纯化得淡黄色油状液体3 318.5 mg,产率 30%;1H NMR δ:13.77(s,1H,5-OH),8.29(s,1H,7-OH),6.61(d,J=10.0 Hz,1H,4-H),5.95(s,1H,8-H),5.38(d,J=10.0 Hz,1H,3-H),5.07(dt,J=7.0 Hz,1.6 Hz,1H,4″-H),2.67(s,3H,COCH3),2.06 ~2.14(m,2H,2″-H),1.82 ~ 1.88(m,1H,3″-H),1.73 ~ 1.69(m,1H,3″-H),1.67,1.56,1.43(s,CH3,1″,6″,7″-H);13C NMR δ:203.76(C=O),165.46(C9),159.32(C7),157.74(C5),132.10(C5″),123.76(C3),123.20(C4″),117.11(C4),105.72(C6),102.23(C10),95.91(C8),81.08(C2),41.60(C2″),33.04(C7″),26.68(C1″),25.67(CH3),23.15(C6″),17.64(C3″);HR-ESI-MSm/z:Calcd for C18H22O4{[M+Na]+}325.141 0,found 325.140 9。
(2)2-甲基-6-乙酰基-5-羟基-7-甲氧甲氧基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃的合成(4)[7]
在反应瓶中依次加入干燥丙酮20 mL和3 723 mg(2.4 mmol),搅拌使其溶解;剧烈搅拌下加入无水碳酸钾400 mg(2.87 mmol),回流反应10 min;缓慢滴加氯甲基甲基醚(MOMCl)230 mg(2.87 mmol),滴毕,反应 30 min。冷却至室温,减压蒸除溶剂,加少量水,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=1∶5)纯化得红棕色油状液体 4 605.5 mg,产率 90%;1H NMR δ:13.62(s,1H,5-OH),6.58(d,J=10.4 Hz,1H,4-H),6.10(s,1H,8-H),5.33(d,J=9.6 Hz,1H,3-H),5.11(s,2H,OCH2),5.01 ~ 5.04(dt,J=7.0 Hz,1.6 Hz,1H,4″-H),3.39(s,3H,OCH3),2.59(s,3H,COCH3),2.01 ~2.11(m,2H,2″-H),1.80 ~1.61(m,2H,3″-H),1.76,1.46,1.40(s,CH3,1″,6″,7″-H);13C NMR δ:202.88(C=O),165.86(C9),158.27(C7),156.43(C5),131.63(C5″),123.63(C3),123.21(C4″),116.97(C4),106.14(C6),102.75(C10),94.20(C8),94.02(OCH2),80.53(C2),56.16(OCH3),41.33(C2″),33.01(C7″),26.34(C1″),25.41(CH3),22.95(C6″),17.34(C3″);HR-ESIMSm/z:Calcd for C20H26O5{[M+Na]+}369.167 2,found 369.165 9。
(3)2-甲基-5-羟基-7-甲氧甲氧基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃查尔酮(5)的合成
在反应瓶中依次加入乙醇1.5 mL,4 92 mg(0.3 mmol)和苯甲醛 40 mg(0.36 mmol),搅拌使其溶解;于0℃缓慢加入氢氧化钾1.01 g(18 mmol)和60%乙醇6.7 mL,氮气保护下反应1 h。自然升至室温,反应24 h。于0℃用3 mol·L-1盐酸调至pH<3,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸去溶剂后经硅胶柱层析(洗脱剂:A=1∶3)纯化得红棕色油状液体5 76 mg,产率 70%;1H NMR δ:14.01(s,1H,5-OH),8.09(d,J=15.6 Hz,1H,α-H),7.77(d,J=15.6 Hz,1H,β-H),7.39 ~ 7.60(m,5H,ArH),6.66(d,J=10.1 Hz,1H,4-H),6.24(s,1H,8-H),5.45(d,J=10.1 Hz,1H,3-H),5.20(s,2H,OCH2),5.08(dt,J=7.1 Hz,1.6 Hz,1H,4″-H),3.49(s,3H,OCH3),2.02 ~2.67(m,2H,2″-H),1.86 ~1.71(m,2H,3″-H),1.66,1.47,1.45(s,CH3,1″,6″,7″-H);13C NMR δ:193.09(C=O),167.80(C1'),166.96(C9),158.77(C7),156.26(C5),142,50(Cβ),135.63(C3'),132.47(C5'),131.04(C5″),130.24(C2'),129.00(C6'),128.43(C3),127.61(C4″),123.70(C4'),117.36(C4),106.91(C6),103.39(C10),95.18(C8),94.39(OCH2),80.77(C2),71.90(Cα),56.64(OCH3),41.55(C2″),27.83(C7″),25.76(C1″),23.12(C6″),19.28(C3″);HR-ESI-MSm/z:Calcd for C27H30O5{[M+Na]+}457.198 6,found 457.198 5。
(4)2-甲基-7-二羟基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃查尔酮(6)的合成
在反应瓶中依次加入甲醇2 mL和5 70.1 mg(0.17 mmol),搅拌使其溶解;加入阳离子交换树脂(Dowex-50X2)53.2 mg,于50 ℃反应36 h(TLC跟踪)。过滤,滤液加少量水,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=1∶5)纯化得淡黄色油状液体 6 21.2 mg,产率 78%;1H NMR δ:14.12(s,1H,5-OH),8.08(d,J=15.6 Hz,1H,α-H),7.76(d,J=15.6 Hz,1H,β-H),7.42 ~ 7.38(m,5H,ArH),6.63(d,J=10.1 Hz,1H,4-H),6.20(s,1H,7-OH),6.06(s,1H,8-H),5.45(d,J=9.9 Hz,1H,3-H),5.08 ~5.10(dt,J=7.1 Hz,1.7 Hz,1H,4″-H),2.10 ~2.14(m,2H,2″-H),1.92 ~1.73(m,2H,3″-H),1.63,1.52,1.51(s,CH3,1″,6″,7″-H);HR-ESI-MSm/z:Calcd for C25H26O4{[M+Na]+}391.190 0,found 391.190 2。
(5)1的合成
在反应瓶中依次加入乙醇1.5 mL和6 21.2 mg(0.054 mmol),搅拌使其溶解;加入无水醋酸钠52.6 mg(0.64 mmol)和一滴水,回流(80 ℃)反应1.5 h。冷却至室温,加少量水,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水和饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:A=1∶1)纯化得无色油状液体 1 4.1 mg,产率 40%;1H NMR δ:12.30(s,1H,5-OH),7.46 ~ 7.40(m,5H,ArH),6.66(d,J=10.0 Hz,1H,4-H),6.00(s,1H,10-H),5.44(d,J=10.0 Hz,1H,3-H),5.42(dd,J=2.7 Hz,17.1 Hz,1H,8-H),5.08(dt,J=7.0 Hz,1.6 Hz,1H,4″-H),3.02 ~ 3.11(dd,J=12.8 Hz,17.1 Hz,1H,7-Hax),2.79 ~2.85(dd,J=3.2 Hz,17.5 Hz,1H,7-Heq),2.08(m,2H,3″-H),1.71(m,1H,2″-H),1.65(s,3H,6″-H),1.57(s,3H,7″-H),1.41(s,3H,1″-H);13C NMR δ:195.70(C6),162.50(C9a),162.40(C10a),158.90(C5),138.50(C1'),132.10(C4″),128.99(C3',5'),126.30(C2',6'),126.20(C4'),125.20(C3),123.85(C3″),115.90(C4),102.90(C4a),102.80(C5a),96.20(C10),80.99(C2),79.10(C8),43.50(C7),41.86(C1″),27.30(C2),25.70(C5″),22.75(C2″),17.80(C6″);HR-ESI-MSm/z:Calcd for C25H26O4{[M+Na]+}391.190 0,found 391.190 4。
2 结果与讨论
2.1 合成
以廉价的2与柠檬醛为起始原料,在无水吡啶溶液中发生分子间环化反应以30%的产率制得中间体3;3在K2CO3作用下与MOMCl反应以90%的产率制得4;在氮气保护下,4与苯甲醛在氢氧化钾的乙醇溶液中反应以70%的产率制得查耳酮5;5在强酸性阳离子树脂(Dowex-50X2)的甲醇溶液中脱除保护基以78%的产率制得6;6在醋酸钠的乙醇溶液中发生环化反应以80%的产率获得1和副产物7(比例为1/1)。
2与柠檬醛在无水吡啶的催化下生成3时有大量副产物8和9生成[11](Chart 1),通过对反应时间的考察发现,反应时间延长有利于8和9的生成,在8 h时趋于平衡且最佳产率约为50%,而在4 h时产率最佳为30%,之后随时间延长产率降低。
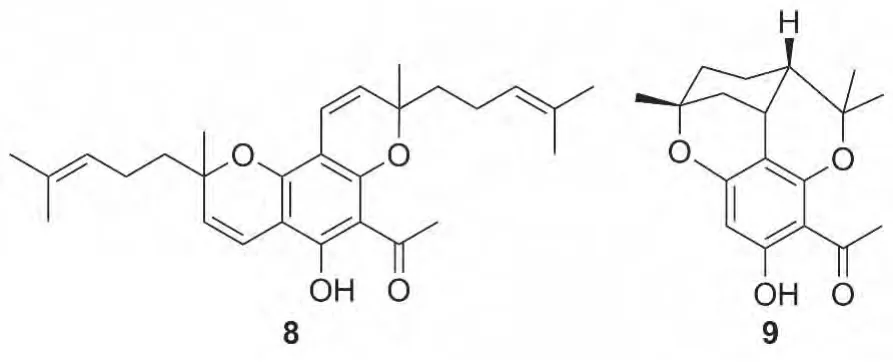
Chart 1
本课题组[8]曾报道过C-6和C-8位异戊烯基黄烷酮的合成,5若在醋酸钠的乙醇溶液中反应将得到C-8黄烷酮,而本文目标分子1为C-6黄烷酮,因此1的合成应先脱保护基再环化;用经典的盐酸的甲醇溶液脱除5的保护基时产率低、拖尾严重,而用强酸性阳离子树脂(Dowex-50X2)脱除时反应条件温和,对原料无影响且产率高。
综上所述,本文以廉价易得的原料完成了天然产物(±)-2-甲基-5-羟基-2-(4'-甲基-3'-戊烯基)-二氢-1-苯并吡喃黄烷酮的全合成,表征数据与文献一致[4]。
[1]Meragelman T L,Tucker K D,McClord T G,et al.Antifungal flavonoids from Hildegardia barteri[J].J Nat Prod,2005,68:1790 -1792.
[2]Rahman M M,Gray A I.Antibacterial and antifungal activities of the constituents of Flemingia paniculata[J].Pharm Biol,2008,46:356 -359.
[3]Hirpara K V,Aggarwal P,Mukherjee A J,et al.Quercetin and its derivatives:Synthesis,pharmacological uses with special emphasis on antitumor properties and prodrug with enhanced bioavailability[J].Curr Med Chem,2009,9(2):138 -161.
[4]Win N N,Awale S,Esumi H,et al.Bioactive secondary metabolites from boesenbergia pandurata of myanmar and their preferential cytotoxicity against human pancreatic cancer PANC-1 Cell Line in nutrient-deprived medium[J].J Nat Prod,2007,70:1582 -1587.
[5]Kress W J,DeFilipps R A,Farr E,et al.A Checklist of the Trees,Shrubs,Herbs,and Climbers of Myanmar[M].Washington,D.C.:Department of Botany,Smithsonian Institution,2003,120.
[6]Tuchinda P,Reutrakul V,Claeson P,et al.Anti-inflammatory cyclohexenyl chalcone derivatives in Boesenbergia pandurata[J].Phytochemistry,2002,59(2):169-173.
[7]Yang J H,Luo J S,Guo D D,et al.Total synthesis of(± )-5,3'-dihydroxy-4'-methoxy-6″-dimethyl-chromeno-(7,8,2″,3″)-flavanone[J].Chin J Org Chem,2012,32:1749 -1752.
[8]Yang J H,Zhang Y H,Li H J,et al.First total synthesis of(±)-puyanin and(±)-4'-O-methylbonannione[J].Chin Chem Lett,2010,21:1267 -1269.
[9]Yang J H,Chen B B,Xie Y M,et al.First total synthesis of(±)-malaysianone A and(±)-tanariflavanones B[J].Chin Chem Lett,2013,24(11):1027-1029.
[10]郭冬冬,杨金会,落俊山,等.Coryfolia D的全合成[J].合成化学,2012,20(6):701 -704.
[11]Narender T,Khaliq T,Shweta,et al.Synthesis of chromenochalcones and evaluation of their in vitro antileishmanial activity[J].Bioorg Med Chem,2005,13:6543-6550.

