多抗性稗草中2个谷胱甘肽转移酶基因的克隆与分析
杨 霞, 王 笑,, 管荣展, 李永丰, 董明超,, 张自常
(1.江苏省农业科学院植物保护研究所,江苏 南京 210014;2.南京农业大学农学院,江苏 南京 210095)
谷胱甘肽转移酶(GST)是一类由超基因家族编码的古老的多功能酶类,以同源或异源二聚体形式的可溶性蛋白广泛存在于微生物和动植物中。目前GST至少分为13个种类,在植物中仅发现7种,即phi(F)、tau(U)、theta(T)、lambda(L)、zeta(Z)、谷胱甘肽依赖的抗坏血酸还原酶(DHAR)和四氯代氢琨脱卤素酶(TCHQD)[1]。除theta和zeta在动物中存在外,其他GST家族为植物中所特有。phi类和tau类是种类最多、含量最为丰富的植物GST基因,利用G位点含有保守的丝氨酸残基将还原型谷胱甘肽与外源亲电子物质相结合,进行催化作用,从而达到解毒作用[2-3];lambda类与植物耐药性相关,如水稻中的OsGSTL1和OsGSTL2[4-5];zeta类在酪氨酸催化机制中起功能;theta类在解毒氧化脂类中起作用[6]。植物体中GST除对包括除草剂在内的异源物质具有解毒功能外[7-9],还发现其在抗氧化胁迫、抗逆反应、抗病、细胞信号转导、跨膜运输定位等方面也有重要作用[10-13]。
稗草(Echinochloa crus-galli)是全球农业生产中的重要恶性杂草之一,同时也是中国稻田恶性杂草之首,严重影响水稻的生长发育和产量[14-15]。使用除草剂防控杂草是广大农户最简单、有效的措施,但是由于长时间连续使用单一作用机理的除草剂,加速了农田杂草产生抗药性,目前已报道了中国稻田稗草对禾草丹、丁草胺、精喹禾灵、精恶唑禾草灵及二氯喹啉酸等除草剂产生了抗药性[16-17]。前期研究中,江苏省农业科学院植物保护研究所草害与农药研究室已筛选获得具有兼抗二氯喹啉酸、五氟磺草胺和双草醚等多种除草剂的多抗性稗草[18-19]。本研究拟从多抗性稗草中克隆抗性基因,通过原核表达、荧光定量PCR和酶比活力测定等方法进行功能分析,研究稗草的抗药性机制和GST解毒机理,为改良作物抗逆性、开发新型除草剂提供理论依据。
1 材料与方法
1.1 供试材料与供试药剂
供试材料:多抗性和敏感性稗草(Echinochloa crus-galli)种子均于2010年7月采集于安徽省庐江县稻田。
供试药剂:50%二氯喹啉酸可湿性粉剂(Quinclorac,浙江新安化工集团股份有限公司产品),2.5%五氟磺草胺油悬浮剂(Penoxsulam,商品名为稻杰,美国陶氏益农公司产品)和20%双草醚可湿性粉剂(Bispyribac-sodium,江苏省激素研究所有限公司产品)。
1.2 稗草总RNA的提取及cDNA的合成
在装有土的塑料盆钵中分别播种多抗性和敏感性稗草种子,置于人工气候箱(光照16 h/黑暗8 h、白天30℃/夜间25℃)中培养。待稗草苗长至2~ 3叶期时,分别收获多抗性和敏感性的稗草叶片进行总RNA提取,提取方法参照RNA提取试剂盒(原平皓生物技术有限公司产品)说明书进行。以1 μg RNA为模板,采用反转录试剂盒(GBT公司产品)进行稗草cDNA第一链的合成,反应条件为25℃10 min,42℃ 30 min,85℃ 5 min。
1.3 EcGST基因的克隆及生物信息学分析
根据前期稗草转录组测序数据中得到的GST基因序列为探针,登陆NCBI网站(http://www.ncbi.nlm.nih.gov)进行Blastn搜索,分析其他物种已知GST同源基因序列,设计基因克隆的引物。扩增EcGSTF1基因的正向引物5′-GAAGAGAGATCATGGCTCCGAT-3′和反向引物5′-CCACTTCAAGCAGATGGCTTC-3′;扩增EcGSTZ1基因的正向引物5′-CACCTGACCTACTGCTGCATCT-3′和反向引物5′-GATGGCTCGGTAATCTTGATTC-3′。分别以多抗性和敏感性稗草cDNA为模板进行PCR扩增,50 μl反应体系中包括:cDNA 1 μl,5×PrimeSTAR Buffer(Mg2+) 10 μl,dNTP mixture(10 mmol/L)4 μl,PrimeSTAR HS DNA polymerase 1 μl,正、反向引物(10 μmol/L)各2 μl,ddH2O 30 μL。PCR反应程序为95℃预变性3 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,33个循环。将PCR产物经1.0%琼脂糖凝胶电泳后用胶回收试剂盒(BIOMIGA公司产品)进行回收纯化。然后将PCR纯化产物进行3′端加polyA尾,70 μl反应体系为:10×Buffer(Mg2+)7 μl,Taq酶4 μl,dNTP(10 mmol/L)7 μl,PCR纯化产物和ddH2O 52 μl。72℃延伸30 min后于冰上冷却,反应产物进行胶回收纯化。将纯化好的已加polyA尾的片段连接至pMD-18T载体(TaKaRa公司产品),筛选阳性单克隆送英潍捷基(上海)贸易有限公司进行测序。采用BioXM 2.6软件对测序得到的基因序列进行开放阅读框(ORF)分析,翻译得到相应的氨基酸序列,以其氨基酸序列为探针,在NCBI网站上进行BLASTP搜索,获得其他物种的同源蛋白质氨基酸序列,利用 MEGA5.05程序的 Neighbourjoining(NJ)模型对这些GST家族成员进行系统发生树分析。
1.4 载体构建及其原核表达
采用BioXM 2.6软件对EcGSTZ1和EcGSTF1的ORF序列进行酶切位点分析,结合原核表达载体pET-28b多克隆位点限制性内切酶类型,设计基因C端和N端分别含NdeⅠ和XhoⅠ酶切位点。其中EcGSTZ1基因的载体构建引物为EcGSTZ1-Nde-F: 5′-GGTATATACATATGGCGACGGCGAAACC-3′(划线处为Nde I位点),EcGSTZ1-Xho-R:5′-GGCTCTCACTCGAGTCATTATGATGGTGCATCTGG-3′(划线处为XhoⅠ位点);EcGSTF1基因的载体构建引物为EcGSTF1-Nde-F:5′-GGTATATACATATGGCTCCGATGAAGCTGTAC-3′(划线处为Nde I位点),EcGSTF1-Xho-R:5′-GGCTCTCACTCGAGTTATCAAGCAGATGGCTTCATCAG-3′(划线处为XhoⅠ位点)。EcGSTZ1基因以EcGSTZ1-Nde-F和EcGSTZ1-Xho-R为两端引物,EcGSTF1以EcGSTF1-Nde-F和EcGSTF1-Xho-R为两端引物,分别扩增EcGSTZ1和EcGSTF1的ORF序列。用NdeⅠ和XhoⅠ酶双酶切PCR扩增产物,同时用相同的酶双酶切含有HIS标签的原核表达载体pET-28b,分别回收基因片段和线性载体,经T4-DNA连接酶(TaKaRa公司产品)16℃连接过夜后转化大肠杆菌DH5α,在含有卡那霉素(Km+)的LB固体培养基上37℃过夜培养。经PCR和双酶切鉴定出阳性单克隆后进行测序验证。
将测序正确的重组质粒转化大肠杆菌菌株BL21接种到含Km+的LB固体培养基上37℃过夜培养后,挑取单菌落接种到10 ml含Km+(50 mg/ L)的LB液体培养基中,37℃培养过夜。按1∶100的比例接种至新鲜的含Km+的LB培养基中,37℃培养至OD600约0.6时,加入IPTG至终浓度为0.4 mmol/L,37℃诱导0 h、1 h、2 h、3 h、4 h和5 h,并依次取样。4 000 g离心收集菌体,用缓冲液(20 mmol/L Tris-HCl、200 mmol/L NaCl、1 mmol/L EDTA)悬浮后,13 000 g离心10 min后,取上清液分别加入5×SDS上样缓冲液,进行12%SDS-PAGE蛋白质表达检测。
1.5 实时荧光定量PCR
取3叶期多抗性和敏感性稗草喷施50%二氯喹啉酸可湿性粉剂(制剂用药量为450 g/hm2)、2.5%五氟磺草胺悬浮剂(制剂用药量为1 200 ml/ hm2)和20%双草醚可湿性粉剂(制剂用药量为200 g/hm2),并设喷施清水为空白对照。药剂喷施处理24 h后收获植株,提取RNA并反转录为cDNA。以cDNA为模板进行实时荧光定量PCR分析,设β-actin基因为内参,内参的特异性引物为5′-CACACTGGTGTCATGGTAGG-3′和5′-AGAAAGTGTGATGCCAGAT-3′。目标基因EcGSTZ1的特异性引物为:5′-AGGCTATGCCGTTATTGGTT-3′ 和 5′-TTGATGGCTCGGTAATCTTG-3′;目标基因EcGSTF1的特异性引物为:5′-TTCCAGTGCCTCATCAGTCC-3′和5′-CCATCCGCATTAGGAAAACC-3′。实时定量PCR在ABI-Stepone plus实时定量PCR仪上进行,反应体系及程序参照TaKaRa SYBR Premix EX TaqTMⅡ说明书操作。3次重复,对EcGST基因在施药前敏感性稗草(SC)、施药处理后敏感性稗草(ST)、施药前多抗性稗草(RC)和施药处理后多抗性稗草(RT)进行荧光定量PCR,利用2-ΔΔCT方法对不同抗性稗草施药前后EcGST基因的相对定量进行计算[20]。以SC为对照,其EcGST基因的表达量定义为1个单位,对其他基因的表达量进行定量分析。
1.6 GST酶比活力测定
多抗性和敏感性稗草2~3叶期,同时以50%二氯喹啉酸可湿性粉剂(制剂用药量为450 g/ hm2)、2.5%五氟磺草胺悬浮剂(制剂用药量为1 200 ml/hm2)和20%双草醚可湿性粉剂(制剂用药量为200 g/hm2)进行喷施处理,收获处理第0 d、1 d、2 d、3 d、5 d和7 d的叶片于-80℃保存,每次处理重复3次。参照Pamela等的方法提取酶液[21],参照Gerard等方法测定酶活力[22],参照Bradford考马斯亮蓝G-250方法测定蛋白质含量[23]。酶比活力[nmol/(min·mg)]=酶活性单位/蛋白质含量。
2 结果与分析
2.1 EcGST基因的克隆与序列分析
以稗草cDNA为模板进行PCR扩增,EcGSTZ1基因扩增大小为750 bp左右,EcGSTF1基因扩增大小为650 bp左右(图1)。将回收纯化后的PCR产物连接至pMD-18T载体中进行测序,测序结果分别获得了EcGSTZ1和EcGSTF1基因扩增的全长序列及其对应编码的氨基酸序列(图2和图3)。EcGSTZ1的核苷酸序列长度为747 bp,在第86个核苷酸处有起始密码子ATG,在725个核苷酸处有终止密码子TGA,其编码区为639 bp,编码212个氨基酸残基;EcGSTF1的核苷酸序列长度为661 bp,在第12个核苷酸处有起始密码子ATG,在654个核苷酸苷酸处有终止密码子TGA,其编码区为645 bp,编码214个氨基酸残基。将EcGSTZ1和EcGSTF1基因登陆至 NCBI网站,GenBank登录号分别为: JX122857和JX122858。同时,以敏感性稗草cDNA为模板,PCR扩增出的EcGSTZ1和EcGSTF1基因的序列与从多抗性稗草中PCR扩增出的序列完全一致。
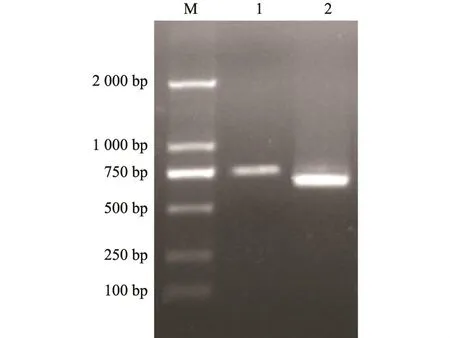
图1 EcGSTZ1和EcGSTF1基因的PCR扩增结果Fig.1 Electrophoresis of EcGST genes amplified by PCR
2.2 EcGST基因的生物信息学分析
将EcGST氨基酸序列通过NCBI的PSI-BLAST搜索,对其进行保守结构域分析,EcGSTZ1属于zeta类GST;EcGSTF1属于phi类GST。这两类EcGST均有2个保守的结构域,N端为类似硫氧还蛋白超家族结构域,C端为GST超家族结构域。
选取单子叶植物高粱(Sorghum bicolor)、玉米(Zeamays)、二穗短柄草 (Brachypodiumdistachyon)、粳稻(Oryza sativa Japonica Group),双子叶植物油桃(Prunus persica)、毛果杨(Populus trichocarpa)、大豆(Glycine max)和昆虫纲柑桔全爪螨(Panonychus citri)、帝王蝶(Danaus plexippus)的GST家族成员与稗草中的EcGSTZ1和EcGSTF1进行多重序列比较,并构建系统进化树。结果显示,GST家族归为两类,即phi类GST和zeta类GST。EcGST和单子叶植物的高粱、玉米、二穗短柄草和粳稻的GST聚为一枝,亲缘关系较近;双子叶植物油桃的GST和毛果杨的GST聚为一枝,亲缘关系较近;昆虫纲的帝王蝶的GST和柑橘全爪螨的GST聚为一枝(图4)。
2.3 EcGST的原核表达分析
将EcESTZ1和EcGSTF1的ORF序列插入至含HIS标签的pET28b载体中,对重组质粒HIS::EcGSTs进行双酶切和测序验证,结果显示EcGST基因序列无缺失和突变,表明HIS::EcGST载体构建成功。

图2 EcGSTZ1基因的核苷酸序列及其所编码的氨基酸序列Fig.2 Nucleotide and putative amino acid sequence of EcGSTZ1
以空载体 pET28b为阴性对照,0.4 mmol/L IPTG诱导HIS::EcGST的表达产物经12%SDSPAGE电泳分析结果显示,蛋白质大小约26 000左右,与预测蛋白质分子量接近,表明HIS::EcGST经 IPTG诱导后能够在大肠杆菌BL21中成功表达(图5)。

图3 EcGSTF1基因的核苷酸序列及其所编码的氨基酸序列Fig.3 Nucleotide and putative amino acid sequence of EcGSTF1
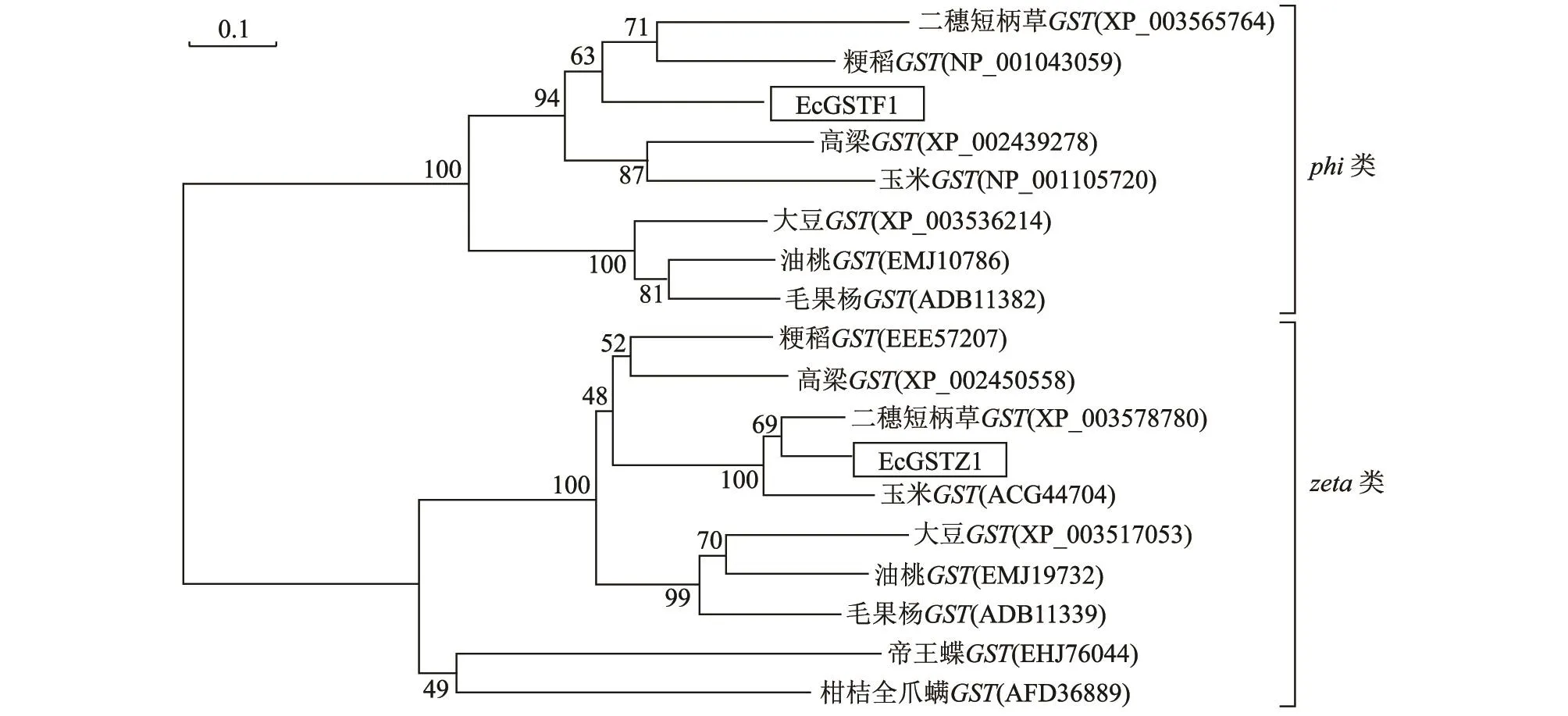
图4 邻接法构建的GST家族成员的系统进化树Fig.4 Phylogenetic trees constructed by neighbor-joining based on GST family from various plant species
2.4 EcGST基因的实时荧光定量分析
实时荧光定量PCR分析结果显示,EcGSTZ1和EcGSTF1基因在多抗性和敏感性稗草中均有表达,且在处理前的稗草中表达量无显著性差异。而在喷药处理后,EcGSTZ1和EcGSTF1基因在多抗性稗草中表达量均最高,相对表达量分别为6.25和8.79,比其在喷药处理后的敏感性稗草中的表达量高(图 6)。
2.5 稗草GST酶比活力
图7显示在处理前多抗性稗草的GST酶比活力高于敏感性稗草。多抗性稗草GST酶比活力在药剂处理第1 d降低到最低值后开始持续上升;敏感性稗草的GST酶比活力在药剂处理后持续下降2 d后才开始上升,并在处理第5 d达到最高值后开始呈现下降趋势。在处理第7 d时多抗性稗草的GST酶比活力高于敏感性稗草。

图5 SDS-PAGE电泳分析HIS::EcGSTs的诱导表达Fig.5 SDS-PAGE analysis of HIS::EcGSTs fusion protein induced with IPTG

图6 EcGST基因在多抗性和敏感性稗草施药前后的相对表达水平Fig.6 The relative expression level of EcGST before or after herbicide application in herbicide-resistant and susceptible barnyardgrass
3 讨论
本研究通过PCR扩增获得了稗草中GST家族的2个不同成员,即zeta类EcGSTZ1和phi类EcGSTF1,通过生物信息学方法分析了其基因序列。结果显示EcGSTF1和EcGSTZ1分别在多抗性和敏感性稗草中碱基序列没有差异;原核表达分析结果显示HIS::EcGST融合蛋白质的分子量大小约为26 000,与推测理论值相一致。构建的系统进化树结果显示,phi类GST和zeta类GST分别聚为一大簇,其中稗草GST与禾本科植物高粱、玉米、二穗短柄草和粳稻的GST聚为一大簇,具有较高的同源性,推测禾本科植物在进化上具有相似性,形态特征与系统进化关系紧密,形态相同的禾本科植物亲缘关系较近。
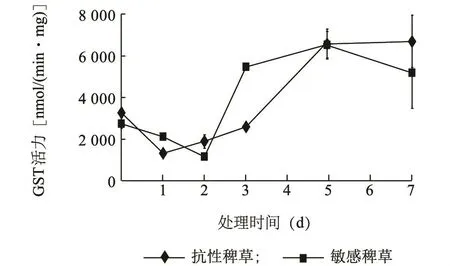
图7 抗性及敏感种群叶片谷胱甘肽转移酶比活力Fig.7 GSTs specific activity in the leaves of resistant and susceptible barnyardgrass
实时定量PCR分析结果显示,EcGSTZ1和EcGSTF1基因在施药前的多抗性稗草中的表达量(1.18和1.73)均高于其在敏感性稗草中的表达量(1.00和1.00);在施药后的多抗性稗草中的表达量(6.25和8.79)均比其在施药后的敏感性稗草中的表达量(3.33和6.18)要高,这与稗草GST酶比活力测定结果一致,施药前多抗性稗草的GST酶比活力高于敏感性稗草,施药7 d后敏感性稗草的GST酶比活力明显低于多抗性稗草。同时施药1 d后GST酶比活力在多抗性和敏感性稗草中先呈下降趋势,随后多抗性稗草首先出现上升趋势,虽然敏感性稗草也出现上升趋势,但最终仍明显低于多抗性稗草,这与高效氟吡甲禾灵处理日本看麦娘后GST酶的活性趋势[24-25]相一致。而荧光定量PCR结果显示施药1 d后GST酶基因表达量均得到提高,表明在施药初期GST酶比活力与酶表达量并非呈正相关,从基因激活、转录到翻译成蛋白质需要一段时间进程,从而导致GST酶比活力存在一定的滞后性。
实时荧光定量PCR分析结果还发现,无论施药前还是施药后,EcGSTF1在多抗性稗草中的表达量均比EcGSTZ1要高,推测phi类GST在催化谷胱甘肽(GSH)与除草剂共轭作用过程中可能比zeta类更为显著,有力地支撑了phi类GST的强解毒功能。国际上已对phi类GST做了深入的研究,发现其对包括除草剂在内的外源化学物质有广泛的解毒能力[26],因此稗草中的phi类GST可以作为植物抵抗除草剂能力的一个重要指标。zeta类GST酶具有异构酶活性,在苯丙氨酸/酪氨酸分解代谢中作为马来酰乙酰乙酸异构酶(MAAI)将GSH可逆地与马来酰乙酰乙酸(MAA)的顺式双键结合,形成延胡索乙酰乙酸(FAA),是苯丙氨酸/酪氨酸降解代谢的关键步骤。康乃馨的2个zeta家族启动子上存在乙烯响应元件,能被乙烯或逆境诱导表达,在芳香族氨基酸的分解代谢中起作用[27]。本试验得到的 zeta类GST在除草剂处理后的多抗性和敏感性稗草中表达量增加,说明此类GST产生解毒能力可能与异构酶活性有一定的关系。
GST介导的除草剂代谢解毒功能的研究结果可应用于除草剂安全剂、增效剂的筛选以及抗药性杂草治理和改良作物抗逆性方面,如精恶唑禾草灵除草剂的安全剂吡唑解草酯和解草唑诱导了鼠尾看麦娘中GSTF1活性,导致GPOX活性加倍,类黄酮保护类物质增加[28];多抗性鼠尾看麦娘AmGSTF1转基因拟南芥植株表现出了多药抗性,在次生代谢、外源物质代谢和抗氧化代谢方面与多抗性鼠尾看麦娘有着相似之处[29]。因此,拟通过phi类EcGSTF1和zeta类EcGSTZ1的转基因植株,分析供试除草剂的降解动力学和催化效率,从而深入阐明多抗性稗草的GST介导的除草剂代谢解毒机制,为改良作物抗逆性及开发新型除草剂提供理论基础。
[1] DIXON D P,LAPTHORN A,MADESIS P,et al.Binding and glutathione conjugation of porphyrinogens by plant glutathione transferases[J].Journal of Biological Chemistry,2008,283(29): 20268-20276.
[2] NOCTOR G,MHAMDI A,CHAOUCH S,et al.Glutathione in plants:an integrated overview[J].Plant Cell and Environment,2012,35(2):454-484.
[3] EDWARDS R,DIXON D P,CUMMINS I,et al.New perspectives on the metabolism and detoxification of synthetic compounds in plants[M]//SCHRÖDER P,COLLINS C D.Organic xenobiotics and plants:from mode of action to ecophysiology.New York: Springer Science+Business Media BV,2011:125-148.
[4] HU T,QU X,XIAO G,et al.Enhanced tolerance to herbicide of rice plants by over-expression of a glutathione S-transferase[J].Molecular Breeding,2009,24(4):409-418.
[5] HU T,HE S,YANG G,et al.Isolation and characterization of a rice glutathione S-transferase gene promoter regulated by herbicides and hormones[J].Plant Cell Report,2011,30(4):539-549.
[6] SOMERVILLE C,MEYEROWITZ E.The Arabidopsis book[M].Washington DC:American Society of Plant Biologists,2010:e0131.
[7] CUMMINS I,DIXON D P,FREITAG-POHL S,et al.Multiple roles for plant glutathione transferases in xenobiotic detoxification[J].Drug Metabolism Reviews,2011,43(20):266-280.
[8] BENEKOS K,KISSOUDIS C,NIANIOU-OBEIDAT I,et al.Overexpression of a specific soybean GmGSTU4 isoenzyme improves diphenyl ether and chloroacetanilide herbicide tolerance of transgenic tobacco plants[J].Journal of Biotechnology,2010,150(1): 195-201.
[9] LO CICERO L,MADESIS P,TSAFTARIS A,et al.Tobacco plants over-expressing the sweet orange tau glutathione transferases(CsGSUs)acquire tolerance to the diphenyl ether herbicide fluorodifen and to salt and drought stresses[J].Phytochemistry,2015,116 (8):69-77.
[10]戚元成,张 慧,赵彦修.植物谷胱甘肽转移酶和盐胁迫[J].山东师范大学学报:自然科学版,2002,17(2):71-75.
[11]SCHRÖDER P,LYUBENOVA L,HUBER C.Do heavy metals and metalloids influence the detoxification of organic xenobiotics in plant?[J].Environmental Science and Pollution Research International,2009,16(7):795-804.
[12]DIXIT P,MUKHERJEE P K,RAMACHANDRAN V,et al.Glutathione transferase from Trichoderma virens enhances cadmium tolerance without enhancing its accumulation in transgenic Nicotiana tabacum[J].Plos One,2011,6(1):e16360.
[13]LIU D,LIU Y,RAO J,et al.Overexpression of the glutathione S-transferase gene from Pyrus pyrifolia fruit improves tolerance to abiotic stress in transgenic tobacco plants[J].Molekulyarnaya Bi-ologiya,2013,47(4):591-601.
[14]张自常,李永丰,张 彬,等.稗属杂草对水稻生长发育和产量的影响[J].应用生态学报,2014,25(11):3177-3184.
[15]张自常,李永丰,张 彬,等.江苏省稻田常见稗草的生物学特性[J].江苏农业科学,2013,41(12):136-138.
[16]HEAP I.International survey of herbicide resistant weeds[R].(2013-12-19)[2015-05-23]www.weedscience.org.
[17]李公春,孙 婷,鞠志宇,等.1-甲基-6-三氟甲基-3-取代脲嘧啶类化合物的合成及除草活性[J].江苏农业科学,2013,41 (7):110-111.
[18]俞欣妍,葛林利,刘丽萍,等.直播稻田稗草对二氯喹啉酸、氰氟草酯与双草醚除草剂复合抗性的初步研究[J].江苏农业学报,2010,26(6):1438-1440.
[19]YANG X,YU X Y,LI Y F.De novo assembly and characterization of the barnyardgrass(Echinochloa crus-galli)transcriptome using next-generation pyrosequencing[J].Plos One,2013,8 (7):e69168.
[20]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[21]PAMELA J H,DAVID D P.Glutathione transferase activities and herbicide selectivity in maize and associated weed species[J].Pesticide Science,1996,46(3):267-275.
[22]GERARD P,IRZY K,PATRICK F E.Purification and characterization of a glutathione S-transferase from benoxacor-treated maize (Zea mays)[J].Journal of Plant Physiology,1993,102(3): 803-810.
[23]BRADFORD M M.A rapid and sensitive method for the quantitation of micrograrn quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(5): 248-254.
[24]READE J P H,MILNER L J,COBB A H.A role for glutathione S-transferases in resistance to herbicides in grasses[J].Weed Science,2004,52(3):468-474.
[25]韩瑞娟,董立尧,李 俊,等.日本看麦娘对高效氟吡甲禾灵代谢抗性的初步研究[J].杂草科学,2010,21(1):3-7.
[26]KAPOLI P,AXARLI I A,PLATIS D,et al.Engineering sensitive glutathione transferase for the detection of xenobiotics[J].Biosensors and Bioelectronics,2008,24(3):498-503.
[27]DIXON D P,COLE D J,EDWARDS R.Characterisation of a zeta class glutathione transferase from Arabidopsis thaliana with a putative role in tyrosine catabolism[J].Archives of Biochemistry and Biophysics,2000,384(2):407-412.
[28]CUMMINS I,BRYANT D N,ROBERT EDWARDS.Safener responsiveness and multiple herbicide resistance in the weed blackgrass(Alopecurus myosuroides)[J].Plant Biotechnology Journal,2009,7(8):807-820.
[29]CUMMINS I,WORTLEY D J,SABBADIN F,et al.Key role for a glutathione transferase in multiple-herbicide resistance in grass weeds[J].Proc Natl Acad Sci USA,2013,110(15):5812-5817.

