甘肃高山细毛羊TLR2基因遗传多态性及其与乳房炎相关性
张 欣, 张小丽, 马小军, 李发弟, 张 晨, 陈富强, 宋晓育
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;3.甘肃省肉羊繁育生物技术工程实验室,甘肃 民勤 733300)
甘肃高山细毛羊(Gansu alpine fine-wool sheep)是中国育成的第一个高山型毛肉兼用细毛羊品种,它是以新疆细毛羊、高加索细毛羊为父本,当地蒙古羊、西藏羊为母本,经过杂交改良、横交固定、选育提高3个育种阶段培育而成的。甘肃高山细毛羊主要分布在祁连山高寒牧区,有优良的高原抗逆性,在高寒草原有着重要的生态学地位和社会经济意义[1-2]。品种育成后,为提高生产性能及羊毛品质开展了大量的选育工作并取得很大成效,但在选育过程中也出现一些常见的控制难度大的疾病,乳房炎就是其中之一,严重阻碍养羊业迅速发展。乳房炎是母羊在哺乳期及羔羊断乳前后常见的疾病,而且隐性乳房炎发病率高,病程长,给养羊业造成严重的经济损失[3-4]。链球菌与葡萄球菌是引起乳房炎的主要病原菌[5-6],但是由于细菌的耐药性,仅利用抗生素治疗很难达到理想的效果。随着动物育种向分子水平发展,对乳房炎抗性候选基因的研究成为控制乳房炎的一个新切入点。Toll样受体(TLR)属于I型跨膜蛋白受体,该受体在病原体入侵机体的早期即启动天然免疫[7],在抗感染中起重要作用。基因多态性影响机体对疾病的遗传易感性,基因TLR位点多态性与炎性应答损伤和感染性疾病的遗传易感性相关[8-10]。TLR2基因为TLR大家族中第2个成员,TLR2基因编码的蛋白质分布很广泛,在脾脏、外周血白细胞和乳腺组织均高度表达[11-12],它能够识别多种病原体相关分子模式,可对G+菌的胞壁成分肽聚糖和脂磷壁酸、G-的类脂A、细菌DNA等进行模式识别,还可识别完整G+菌,从而激活细胞内信号传导机制。因此,TLR2是研究羊乳房炎抗病性的重要候选基因。
研究结果表明,乳房炎和体细胞评分(SCS)的遗传力系数大约为 0.30~0.98,并认为能够根据SCS对抗乳房炎性状进行间接选择,因此SCS是目前对乳房炎进行监测最可靠的方法[13]。乳样中体细胞数(SCC)直接计数所得的数值差距范围太宽,且为偏态的分布频率,为避免分析中的不足,呈现较理想的统计学特征,可通过公式SCS=lg2(SCC/ 100 000)+3[14-16]将SCC转换成SCS。
为探索甘肃高山细毛羊TLR2基因多态性与乳房炎抗性之间的关系,本试验采用PCR-SSCP技术检测TLR2基因多态位点,并分析其多态性与体细胞评分(Somatic cellscore,SCS)的相关性,为进一步研究标记辅助选择育种、培育乳房炎抗性新品系提供理论依据。
1 材料与方法
1.1 材料
1.1.1 血样 286份甘肃高山细毛羊血液样品采自甘肃省天祝县某规模化养殖场。
1.1.2 乳样 286份乳样采自甘肃省天祝县某规模化养殖场,每只羊采集常乳10 ml左右。
1.2 方法
1.2.1 采血 每只羊于颈静脉采血10 ml,柠檬酸葡萄糖(ACD)抗凝,-20℃冷冻保存备用。
1.2.2 乳样的处理 采用Fossomatic Minor仪器测得体细胞数(SCC),通过公式SCS=lg2(SCC/ 100 000)+3换算成体细胞评分(SCS)。
1.2.3 基因组DNA提取 采取常规酚氯仿抽提法从全血中提取基因组DNA,经1%琼脂糖电泳检测后-20℃冷冻保存。
1.2.4 引物设计与合成 根据GenBank发表的绵羊基因序列(登录号:NM-001048231)并参考相关文献,利用PrimerPremier5.0软件对羊TLR2基因可能存在突变位点的基因片段设计1对引物(表1)。引物由上海生工生物有限公司合成。
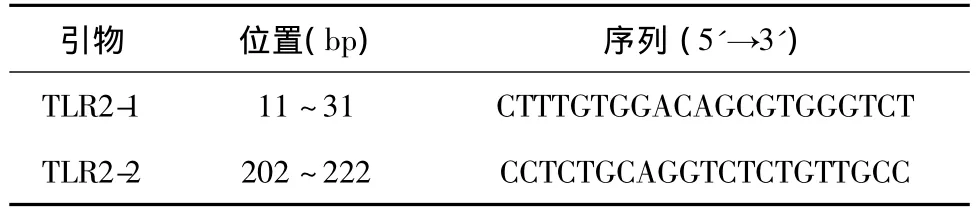
表1 引物名称、位置及序列Table 1 The name,position and sequence of primers
1.2.5 基因的扩增 采用25 μl反应体系:上下游引物各1 μl,模板DNA 2 μl,灭菌双蒸水8.5 μl,DNA-TAQ预混酶12.5 μl。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火45 s,72℃延伸1 min,35个循环,最后72℃延伸15 min。PCR产物用1%的琼脂糖凝胶电泳检测。
1.2.6 PCR产物的SSCP分析 取2 μl PCR产物,8 μl变性剂(98%去离子甲酰胺、0.03%二甲苯青、0.025%溴酚蓝、0.5 mol/L混合而成),经98℃变性10 min,迅速放置于冰上10 min,以保持变性状态。在14%非变性聚丙烯酰胺凝胶上,4℃、150 V,电泳17 h,银染法显色。
1.2.7 克隆测序 PCR产物经SSCP分析后,纯合基因型个体的PCR扩增产物进行凝胶纯化后送至北京金唯智生物科技有限公司进行双向测序。杂合基因需进行克隆再进行测序。
1.2.8 数据统计分析 用DNASTAR中的Megalign、Clustal对所测的甘肃高山细毛羊TLR2基因序列进行同源序列比对分析。通过POPGEN32计算TLR2基因的基因型频率、等位基因频率以及杂合度、卡方值等。体细胞计数(SCC)高于6.40× 106或低于5 000均为异常,在分析时剔除,采用SPSS19.0统计软件一般线性模型,对乳房炎性状受TLR2基因各基因型影响做显著性检验。采用下列公式进行最小二乘分析,分析基因型效应:yjkl=μ+ Gl+Hj+Pk+ejkl其中:yjkl为体细胞评分值;μ为群体均值;Gl为第l种基因型的固定效应;Hj为第j个羊场的固定效应,j=1,2;Pk为第k个胎次的固定效应,k=1,2,3;ejkl为随机误差效应。
2 结果
2.1 TLR2基因的PCR扩增
应用特异性引物以提取的总DNA为模板进行PCR扩增,经琼脂糖凝胶电泳检测,扩增出212 bp的特异性目的条带(图1),与预期片段大小一致。
2.2 SSCP分型及测序分析
PCR产物经SSCP电泳,在扩增片段中发现多态性,根据条带不同分为3种基因型(图2):AA、AB、BB。将不同基因型的PCR产物测序,以GenBank中羊的TLR2基因序列(登录号NM-001048231)为参考进行序列比对分析(图3),共发现5个突变位点,分别为62 bp处G→A,72 bp处C→T,92 bp处 T→G,120 bp处A→G,179 bp处G→A。突变引起3处氨基酸的改变(图4),62 bp处和179 bp处核苷酸的颠换导致精氨酸(Arg)变为赖氨酸(Lys),92 bp处的核苷酸颠换导致缬氨酸(Val)变为甘氨酸(Gly)。

图1 TLR2基因目的片段的扩增Fig.1 Amplification of TLR2 gene

图2 TLR2基因的PCR-SSCP检测Fig.2 Electrophoresis profile of TLR2 gene by PCR-SSCP

图3 TLR2基因等位基因核苷酸比对结果Fig.3 Nucleotide sequences alignment of alleles of TLR2
2.3 基因型频率与等位基因频率
根据PCR-SSCP结果,通过遗传学统计方法对286头甘肃高山细毛羊进行基因型频率和等位基因频率的统计分析,结果见表2。
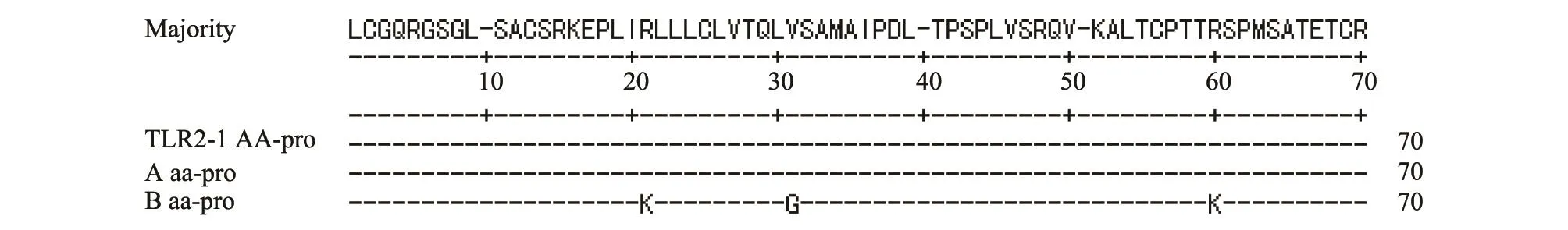
图4 TLR2基因等位基因氨基酸序列比对结果Fig.4 Amino acid sequences alignment of alleles of TLR2
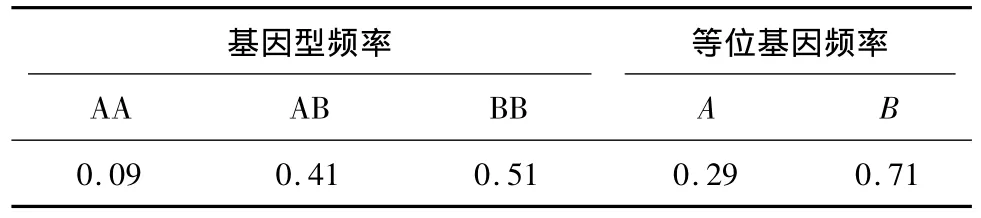
表2 基因型频率和等位基因频率Table 2 Genotype frequency and allele frequency
2.4 遗传多态性分析
群体的多态信息含量(PIC)、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和Hardy-Weinberg平衡分析结果见表3,由表3可以看出多态信息含量(PIC)为0.25~0.50,处于中度多态。经χ2适合性检验,χ2值为0.085(P>0.05),该突变达到Hardy-Weinberg平衡状态。

表3 TLR2基因的遗传多态性指标Table 3 PIC,Ho,He,Neand χ2 of TLR2 gene
2.5 基因型与SCS相关性分析
应用SPSS19.0软件中的一般线性模型分析基因型对乳房炎性状的效应,结果(表4)表明,AB和BB基因型个体的SCS显著高于AA型个体,表明A等位基因可能是甘肃高山细毛羊乳房炎抗性的优势基因。
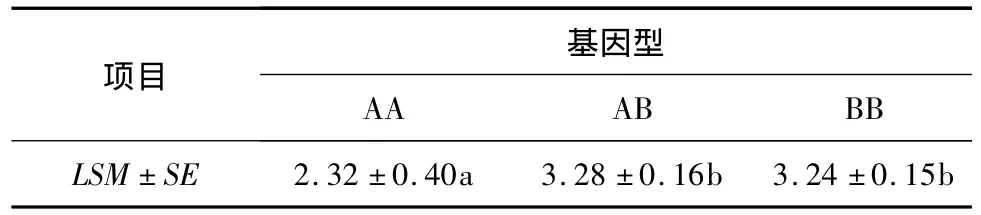
表4 TLR2基因不同基因型在群体中SCS的最小二乘均值及标准误Table 4 Group least squares mean value and standard error of TLR2 gene of different genotypes
3 讨论
3.1 TLR2基因遗传多态性分析
本试验对甘肃高山细毛羊TLR2基因的多态性进行了分析,χ2检验结果显示,试验群体遗传突变处于Hardy-Weinberg平衡状态,说明所选甘肃高山细毛羊群体TLR2基因处于遗传平衡状态。对于一个群体来说,He与PIC数值越大,反映此群体基因的一致性越差、变异性越大,选择潜力越大;反之,数值越小,反映群体变异越小,选择潜力也就越小[17]。本试验中PIC达到0.327(0.25<P<0.50),为中度多态,遗传变异大。因此,在甘肃高山细毛羊选育过程中应该加强人工选择的强度。就基因频率而言,A、B等位基因在试验羊群中均有分布,等位基因频率分别为0.29和0.71,B等位基因在群体中占优势,可能是因为核苷酸的颠换导致蛋白质氨基酸的改变,从而改变了基因的部分功能;另外,甘肃高山细毛羊是毛肉兼用细毛羊品种,在对其选育过程中可能过于注重产毛量与产肉率的提高,忽视了抗病性的选育,从而增加了B等位基因频率,相对降低了A等位基因频率。
3.2 TLR2基因多态性与甘肃细毛羊乳房炎的关系
相关研究结果表明,TLR2基因多态性与某些疾病的发生有相关性,TLR2基因参与猪链球菌诱导的自噬作用,其多态性与蛋鸭免疫细胞因子TL-2显著相关,Asp299Gly(表示299位点突变导致氨基酸突变,使天冬氨酸突变为甘氨酸)与病情的严重程度有较大相关性[18],Arg667Trp(表示667位点突变导致氨基酸突变,使精氨酸突变为色氨酸)多态性与结核的易感性相关[19]。TLR2基因能够识别完整的G+菌,比如引起羊乳房炎的主要致病菌金黄色葡萄球菌和链球菌[20]。本试验发现甘肃高山细毛羊TLR2基因存在多态位点,其中179 bp处发生突变,存在多态性,这与马腾壑等[21]的研究结果相近,表明此处突变可能对乳房炎抗性有极大影响。SCS与乳房炎的遗传力约为0.30~0.98,因此,本试验将SCC转换为SCS,并将其作为乳房炎的表征数据进行相关性分析,结果显示不同基因型对SCS影响有显著差异,AA基因型个体SCS显著低于AB型和BB型个体(P<0.05),说明AA基因型与乳房炎抗病性有关,所以A等位基因可能为抗乳房炎的优势基因。
甘肃高山细毛羊TLR2基因有遗传多态性,属中度多态。TLR2基因多态性对乳房炎有较大调控作用,TLR2基因可作为甘肃细毛羊乳房炎抗性的候选基因,培育甘肃高山细毛羊乳房炎抗性品种。
[1] 李 伟.甘肃高山细毛羊的品种选育与利用[J].中国牧业通讯,2009(24):33-34.
[2] 刘 秀,安清明,胡 江,等.甘肃高山细毛羊瘦素基因Leptin第3外显子多态性与生长速度相关性分析[J].农业生物技术学报,2014,22(4):470-475.
[3] CHEW B P,HOLLEN L L,HILLERS J K,et al.Relationsip between Vitarmin A and β-carot-ens in blood plasma and milk and mast it is in lactating H olsteins[J].Dairy Sci,1982,65:2111-2118.
[4] MENZIES P I,RAMANOON S Z.Mastitis of sheep and goats[J].Vet Clin North Am Food Anim Pract,2001,17(2): 333-358.
[5] 王晓兰,孙庆华.奶牛隐性乳房炎病原菌的分离鉴定与药物敏感性试验[J].畜牧与兽医,2005,37(10):43-44.
[6] 刘长彬,钟发刚,卢春霞,等.新疆石河子地区隐性乳房炎致病菌调查及分离鉴定[J].江苏农业科学,2014,42(5): 181-184.
[7] 吴 双,朱善元,王永娟,等.鸡Toll样受体2的克隆表达及多克隆抗体的制备[J].江苏农业学报,2014,30(3):586-589.
[8] SZOMOLANYI-TSUDA E,LIANG X,WELSH R M,et al.Role for TLR2 in NK cell-mediated control of murine cytomegalovirus in vivo[J].J Viorl,2006,80:4286-4291.
[9] DING K,SHIBUI A,WANG Y,et al.Imparied recognition by Toll-like receptor 4 is responsible for exacerbated murine Pneumocystis pneumonia[J].Microbes Infect,2005,7:195-203.
[10]ZHANG C,WANG S H,LASBURY M E,et al.Toll-like receptor 2 mediates alveolar macrophage response to Pneumocystis murina[J].Infect Immun,2006,74:1857-1864.
[11]FLO T H,H ALAAS O,LIEN E.Human toll-like receptor 2 mediates monocyte activation by L isteria monocytogenes,but not by group B strept ococci or lipopolysaccharide[J].Immunol,2000,164(4):2064-2069.
[12]GOLDAMMER T,ZERBE H.Mastitis increases mammary mRNA abundance of bet a-defensin 5,toll-like-recep-tor2(TLR2),and TLR 4 but not TLR9 in cattle[J].Clin Diagn Lab Immunol,2004,11(1):174-185.
[13]MRODE R A,SWANSONG J T.Genetic and statistical properties of somatic cell count and its suitability asan indirect means of reducing the incidence of mastitis in dairy cattle[J].Animal Breeding Abstracts,1996,64(11):847-857.
[14]SCHUKKEN Y H,WILSON D J,WELCOMEF,et al.Monitoring udder health and milk quality using somatic cell counts[J].Vet Res,2003,34(5):579-596.
[15]CARLEN E,STRANDBERG E,ROTH A,Genetic parameters for clinical mastitis,somatic cell score,and production in the first three lactations of Swedish holstein cows[J].J Dairy Sci,2004,87(9):3062-3070.
[16]ODEGARD J,JENSEN J,MADSENP,et al.Detection of mastitis in dairy cattle by use of mixture models for repeated somatic cell scores,a Bayesian approach via gibbs sampling[J].J Dairy Sci,2003,86(1):3694-3703.
[17]孔晶晶,滚双宝.猪SLA-DQA基因外显子4多态性分析[J].华北农学报,2012,27(3):86-90.
[18]YANG I A,BARTON S J,RORKE S,et al.Toll-like receptor 4 polymorphism and severity of atopy in asthmaties[J].Genes Immun,2004,11:41-45.
[19]BEN-ALI M,BARBOUCHE M R,BOUSNINA S,et al.Toll-like receptor 2 Arg677Trp polymorphism is associated with susceptibility to tuberculosis in Tunisian patients[J].Clinical and Diagnostic Laboratory Immunology,2004,11(3):625-626.
[20]HEBERT A,SAYASITH K,SENECHAL S,et al.Demonstration of intracellular Staphylococcus aureus in bovinemastitis alveolar cells and macrophages isolated from naturally infected cow milk[J].FEMS Microbiol Lett,2000,193:57-62.
[21]马腾壑,许尚忠,王兴平,等.奶牛TLR2基因遗传变异与乳腺炎体细胞评分的相关研究[J].畜牧兽医学报,2007,38(4): 332-336.

