C1~C4烷烃混合气体热爆燃的简化机理与分析*
吴松林,杜 扬,李国庆,张培理
(1.后勤工程学院供油系,重庆 401311;2.后勤工程学院基础部,重庆 401311)
C1~C4烷烃混合气体热爆燃的简化机理与分析*
吴松林1,2,杜 扬1,李国庆1,张培理1
(1.后勤工程学院供油系,重庆 401311;2.后勤工程学院基础部,重庆 401311)
为了探索油气在受限空间热爆燃发生的化学反应机理,以CHEMICAL4.1为平台,分析了C1~C4烷烃混合气体热爆燃过程的系统温度、主要组分浓度和中间产物生成率的变化规律。通过敏感性分析、生成速率分析和路径分析等方法,简化了C1~C4烷烃混合气体的详细机理,得到了一个包含37种组分、80个基元反应组成的简化机理,并进行了对比验证。在反应机理上印证了气体热爆燃过程存在缓慢氧化、快速氧化和反应平衡3个阶段。发现与超氧化氢和过氧化氢有关的基元反应是热爆燃发生的关键反应,而大量产生的氢基和羟基最终导致了热爆燃的发生。
爆炸力学;简化机理;敏感性分析;C1~C4烷烃;油气;生成速率分析
汽油的主要成分为C4~C12的脂肪烃和环烃类,并含少量芳香烃和硫化物组成的混合物。对汽油燃烧的研究主要存在两方面的困难:(1)汽油成分复杂,其燃烧过程涉及上千个化学基元反应,因此,往往采用汽油的替代物来研究燃烧过程[1-2],如庚烷和异辛烷的混合物;(2)尽管对汽油燃烧的研究已经取得了很多成果,得到了详细的化学反应机理,但是对化学基元反应的深入研究还一直在进行。
汽油的挥发物与空气充分混合,易形成油气。一般认为油气的主要组分是C1~C4的轻质烷烃。当满足适当的气体浓度、温度和氧气浓度条件,油气极易引起爆炸,常常会带来重大的人员伤亡和财产损失,如2013年“11·22”青岛输油管道燃爆事故共造成62人遇难,136人受伤,直接经济损失7.5亿元。但同样受到油气成分的不确定和详细机理的复杂性的限制,对油气爆炸的研究也一直是当前的热点研究。
由于燃烧、爆炸类试验难以控制,数值模拟成为对其过程精细研究的主要方法。但数值模拟受化学反应刚性的影响和计算能力的限制,需要简化详细化学反应机理。详细化学反应机理的简化成为当前燃烧领域的研究热点之一,特别是对内燃机条件下甲烷、正庚烷、异辛烷、正葵烷、正十二烷等化合物,以及正庚烷和甲苯,正庚烷、异辛烷和乙醇等混合物详细机理的简化[3-13]。详细化学反应机理的简化方法主要有3类:(1)通过敏感性分析[14-16]、反应速率分析、主成分分析等直接提取骨干机理;(2)通过奇异摄动法、低维流形技术等数学方法进行简化;(3)利用路径通量分析等方法补充简化机理。
本文中,针对受限空间油气因温度上升使得热爆燃发生的工况,采用敏感性分析、生成速率分析和路径分析等对C1~C4轻质烷烃热爆燃机理进行探索,并对详细反应机理进行简化,探讨油气在受限空间的热爆燃,甚至热爆炸的化学反应动力学机理,以期为进一步对爆炸过程的研究提供化学反应基础。
1 化学反应数学模型
可燃气体化学反应的组分方程为:
(1)

可燃气体化学反应的能量方程为:
(2)

2 简化方法和模型

图1 简化机理的研究思路Fig.1 Research ideas for simplifing reaction mechanism
2.1 简化方法
首先,获取由Lawrence Livermore国家实验室提供的包括155种成分、689个基元反应的C1~C4详细反应机理[17],利用化学动力学软件CHEMKIN4.1中的Closed Homogeneous Batch Reactor模拟计算特定工况下氧化燃烧现象,对计算结果进行温度敏感性分析,并结合组分浓度分析,提取出骨干机理。其次,通过反应路径分析和基团生成速率分析对骨干机理进行补充,最终得出简化机理,并进行对比验证。其研究思路如图1所示。
2.2 初始条件设定
化学反应模型采用等容能量方程模型,假设系统绝热,初始环境压力为100 kPa,温度为1 200 K,空间体积为500 cm3。混合气体中组分的初始摩尔分数为:CH4,0.010;C2H4,0.010;C2H6,0.010;C3H8,0.028;C4H10,0.038;O2,0.190;N2,0.714。
2.3 温度和摩尔分数分析
通过模拟运算,得到了系统的温度变化曲线(见图2),以及主要反应物和生成物的摩尔分数随时间的变化曲线(见图3)。从图2~3可以发现:轻质烷烃的热爆燃过程存在3个明显阶段,分别是缓慢氧化阶段、快速氧化或者热爆燃阶段和反应平衡阶段。
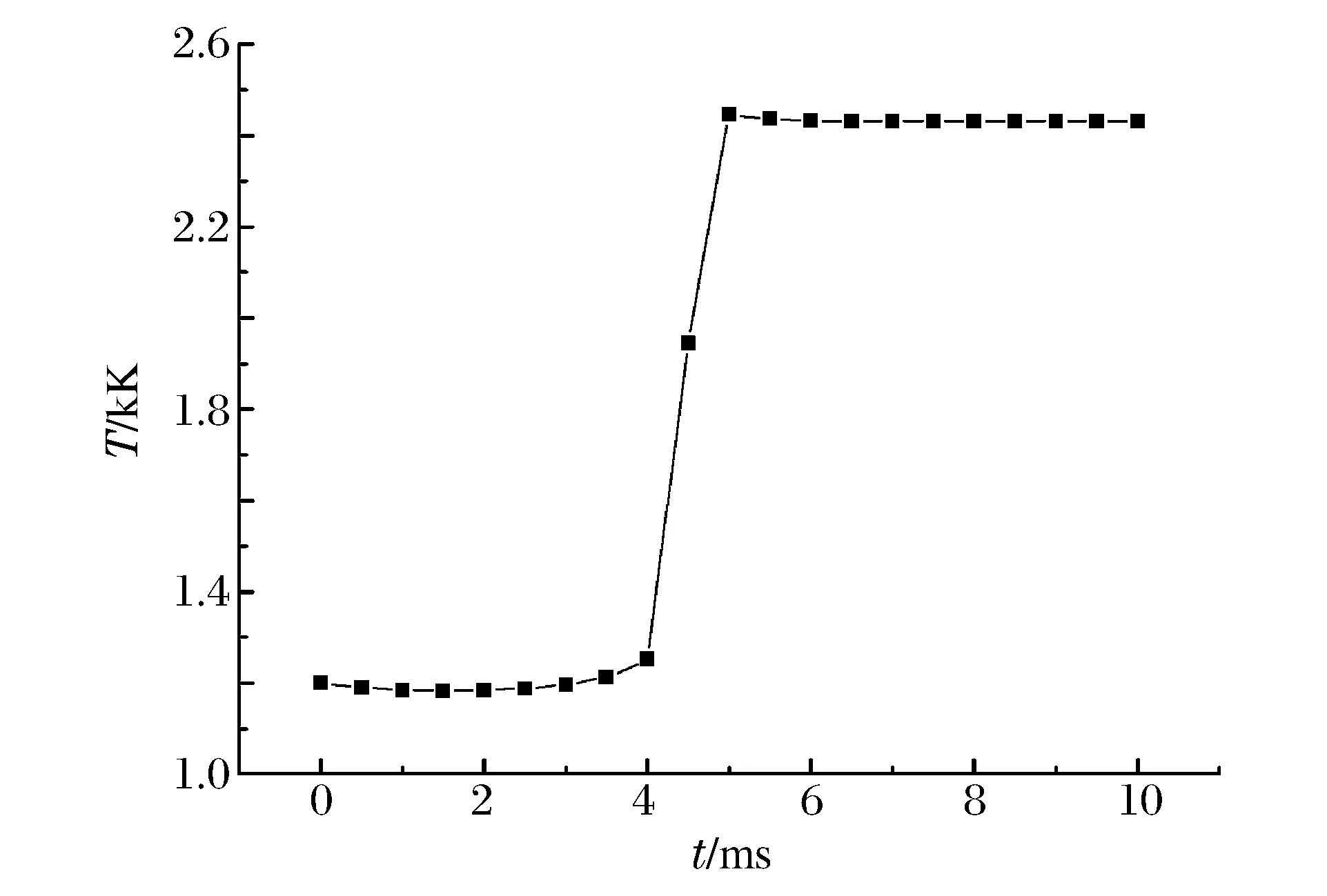
图2 温度随时间的变化曲线Fig.2 Temperature varied with time in the system

图3(a) 主要烷烃的摩尔分数随时间的变化曲线Fig.3(a) Mole fractions of main alkanes varied with time

图3(b) 主要产物的摩尔分数随时间的变化曲线Fig.3(b) Mole fractions of main products varied with time

图3(c) 主要烃基的摩尔分数随时间的变化曲线Fig.3(c) Mole fractions of main hydrocarbon varied with time

图3(d) 甲醛和氢基的摩尔分数随时间的变化曲线Fig.3(d) Mole fractions of formaldehyde and hydrogen radical varied with time

图3(e) 其他基团的摩尔分数随时间的变化曲线Fig.3(e) Mole fractions of other groups varied with time
图3分别给出了主要轻质烷烃(图3(a))、主要最终产物(图3(b))和主要中间产物的摩尔分数随时间的变化曲线(图3(c)、(d)、(e))。
从图3可以发现:在缓慢氧化阶段,主要是高碳烷烃逐渐被氧化成低碳烷烃和一些基团的过程,造成O2、C4H10、C3H8和C3H6等的摩尔分数逐渐减少,而一些低碳烷烃CH4、C2H2等,基团、以及生成物H2、CO2、CO和H2O的摩尔分数逐渐增加。特别是CH2O(图3(d)),以及H2O2和HO2(图3(e))的摩尔分数增加规律比较明显。在快速氧化阶段,温度突然剧增,所有组分都发生了突变,除了生成物CO2、CO、H2O ,以及H2、OH的摩尔分数增加外,所有反应物和中间产物的摩尔分数突然减小,基本接近为零。在反应平衡阶段,所有组分的摩尔分数维持平衡,基本没有变化。在整个热反应过程中,不同组分的摩尔分数呈现独自的变化规律,它们的反应量级上也有很大的区别。
以上分析表明:在缓慢氧化阶段,主要是高碳烷烃经过加氧、脱氢等转化为低碳烷烃和基团的过程,低碳的烷烃或者基团的摩尔分数增加的量级和规律有显著区别。而快速氧化阶段,所有组分的摩尔分数发生突变,特别是过氧化氢和超氧化氢的摩尔分数达到最大值,最终生成的氢基H和羟基OH使得热爆燃得以发生。
2.4 温度敏感性分析和骨干机理
敏感性分析是研究计算结果对反应参数的敏感程度。通过分析敏感性,可以考察哪些反应对计算结果影响较大,哪些反应影响较小,从而将影响较小的反应去除,达到简化的目的。为了得到温度对基元反应的敏感度,设式(2)的解可写成:
F(T,t,A)=0
(3)
式中:A=(A1,A2,…,An)为各反应步的指前因子向量。
(4)
通过CHEMICAL程序包对上式求解,得到温度对基元反应的敏感度。以0.1为阀值,将所有基元反应的敏感度列成直方图,如图4所示。于是,将温度敏感度大于1的基元反应作为骨干机理,见表1~2带*的反应。

图4 基元反应的温度敏感度直方图Fig.4 Histograms of temperature sensitivity for basic reactions

表1 C1~C4简化机理的反应方程Table 1 Reaction equations for reduced mechanism of C1~ C4
2.5 简化机理
2.5.1 生成速率分析法

图5 主要基团的总生成速率随时间的变化曲线Fig.5 Generation rates of main groups varied with time

图6(a) 基元反应对氢基生成速率的影响Fig.6(a) Effect of basic reactions on generation rates of hydrogen

图6(b) 基元反应对甲醛生成速率的影响Fig.6(b) Effect of basic reactions on generation rates of formaldehyde
生成速率分析法可以用来判别不同基元反应对某种组分生成或分解的重要性指数,可以迅速得出链锁反应过程所经历的主要反应。设某组分Z的生成速率为:
(5)
式中:I为涉及组分Z的基元反应总数,vZi为第i个基元反应化学当量系数,ki为反应速率。

(6)
图5给出了几个主要基团的总生成速率随时间的变化曲线。从图中可以发现,H、OH明显促进了基元反应的进行,而CH2O则明显延缓基元反应的进行。
图6给出了部分基元反应对氢基H和甲醛CH2O的生成速率,显示了这些基元反应对H和CH2O生成的影响。基元反应R121、R146都有利于H生成,也就是HCO和C2H4的加氢;而基元反应R141、R2等不利于H生成。基元反应R151有利于CH2O生成,也就是C2H3加氧反应;而基元反应R117、R116等都不利于CH2O生成,也就是CH2O同氢基H和羟基OH异构化生成HCO的反应。
因此,氢基H和羟基OH的总正向生成速率有利于热爆燃发生,而甲醛CH2O的生成不利于热爆燃的发生。特别是R23和R295都有利于氢基H和羟基OH的生成,它们应该是锁链反应的重要传递过程,这2个反应也涉及到超氧化氢HO2和过氧化氢H2O2,再次印证了它们对热爆燃发生的重要性,这就需要补充涉及超氧化氢、过氧化氢、氢基H和羟基OH的基元反应。
2.5.2 路径分析法
将以上骨干基元反应生成化学反应路径,得到图7。从图中发现,存在一些路径缺失,需要补充一些基元反应,形成完整的从反应物到生成物的网络,使链锁反应能够以不同支链进行。
通过上述2种方法,补充与重要基团相关的基元反应和补充因反应网络缺失的基元反应,最终得到整个简化机理,如表1~2所示,包含37个组分和80个基元反应,37个组分分别为H2、H、CH4、CH3、CH2O、HCO、CO、O2、O、OH、HO2、H2O2、H2O、HCCO、C2H2、C2H3、C2H4、C2H5、C2H6、CH3O、CH2HCO、C4H10、s-C4H9、C3H6、a-C3H5、C3H8、i-C3H7、n-C3H7、CH2CO、CH2CHCHO、CH2、CH、CO2、C2H、C、CH2CHCO、N2。

表2 C1~C4简化机理反应速率方程的参数Table 2 Parmeters of reaction rate equations for reduced mechanism of C1-C4

图7 骨干机理的反应路径Fig.7 The reaction path of skeleton mechanism
3 简化机理的验证

图8 两种化学反应机理下计算得到的温度的比较 Fig.8 Comparison of temperature simulated under two chemical reaction mechanisms

图9 两种化学反应机理下计算得到的主要反应物和产物摩尔分数的比较Fig.9 Comparison of mole fractions simulated under two chemical reaction mechanisms for main reactants and products
在同样的条件下,由简化机理模拟C1~C4烷烃混合气体在封闭空间中热爆燃发生,得到的对比温升曲线和主要反应物和生成物的摩尔分数分别如图8~9所示。
从图8可以看出,由简化机理和详细机理模拟计算得到的温升曲线基本一致。从图9可以看出,生成物结果存在一些差别:一氧化碳摩尔分数从0.197 96减少到0.181 67,相对误差为8.73%;二氧化碳摩尔分数从0.009 53增加为0.011 08,相对误差为16.3%;水蒸气摩尔分数却从0.059 34增加到0.078,相对误差达到了23.4%,说明反应更彻底。因此,简化机理可以代替详细机理描述C1~C4可燃气体的热爆燃发生过程。
通过获得的简化机理,可以进一步模拟计算一定范围内影响热爆燃发生的其他影响因素,如湿度、压强等,研究着火半岛以及增加流动后的复杂耦合计算问题等。
4 结 论
(1)通过敏感性分析、路径分析等方法,针对C1~C4轻质烷烃气体混合物的热爆燃发生背景,对其详细化学反应机理进行了简化,得到了包含37个组分、80个基元反应的简化机理,并进行了对比验证。
(2)通过对热爆燃发生过程的温度、组分摩尔分数的分析,印证了热爆燃过程存在3个阶段:缓慢氧化阶段,快速氧化阶段(热爆燃发生)和反应平衡阶段,并对每个阶段组分变化特征进行了分析。
(3)通过对基团摩尔分数和组分生成速率的分析,得到了热爆燃发生的大致机理:在缓慢氧化阶段,主要是高碳的氧化分解,生成低碳的烷烃和中间基团,如C3H6、C2H4和CH2O等;在快速氧化阶段前期,过氧化氢和超氧化氢生成反应成了关键反应,通过它们生成大量的氢基H和羟基OH,从而导致热爆燃的发生。
[1] Battin-Leclerc F. Detailed chemical kinetic models for the low-temperature combustion of hydrocarbons with application to gasoline and diesel fuel surrogates[J]. Progress in Energy and Combustion Science, 2008,34:440-498.
[2] Wang Yi-feng, Yao Ming-fa, Zheng Zun-qing. A semi-detailed chemical kinetic model of a gasoline surrogate fuel for internal combustion engine applications[J]. Fuel, 2013,113(2):347-356.
[3] 刘合,陈方,刘洪,等.甲烷/空气预混超声速燃烧的18 步简化机理[J].燃烧科学与技术,2012,18(5):467-472. Liu He, Chen Fang, Liu Hong, et al. 18-step reduced mechanism for methane/air premixed supersonic combustion[J]. Journal of Combustion Science and Technology, 2012,18(5):467-472.
[4] 梁运涛.封闭空间瓦斯爆炸过程的反应动力学分析[J].中国矿业大学学报,2010,39(2):196-200. Liang Yun-tao. Analysis of reaction kinetic for gas explosion in enclosed space[J]. Journal of China University of Mining and Technology, 2010,39(2):196-200.
[5] 刘耀东,解茂昭,贾明,等.一个改进的异辛烷氧化化学动力学骨架模型[J].工程热物理学报,2013,34(4):791-795. Liu Yao-dong, Xie Mao-zhao, Jia Ming, et al. An improved skeletal chemical kinetic model for iso-octane oxidation[J]. Journal of Engineering Thermophysics, 2013,34(4):791-795.
[6] 方亚梅,王全德,王繁,等.正十二烷高温燃烧详细化学动力学机理的系统简化[J].物理化学学报,2012,28(11):2536-2542. Fang Ya-mei, Wang Quan-de, Wang Fan, et al. Reduction of the detailed kinetic mechanism for high-temperature combustion ofn-dodecane[J]. Acta Physico-Chimica Sinica, 2012,28 (11):2536-2542
[7] 姚通,钟北京.正癸烷着火及燃烧的化学动力学模型[J],物理化学学报,2013,29(2):237-244. Yao Tong, Zhong Bei-jing. Chemical kinetic model for auto-ignition and combustion ofn-decane[J]. Acta Physico-Chimica Sinica, 2013,29(2):237-244.
[8] 雒婧,尧命发.正庚烷甲苯混合物燃烧简化机理分析[J].燃烧科学与技术,2012,18(4):367-374. Luo Jing, Yao Ming-fa. Reduced combustion mechanism ofn-heptane/toluene mixtures[J].Journal of Combustion Science and Technology, 2012,18(4):367-374.
[9] 郑东,钟北京.异辛烷/正庚烷/乙醇三组分燃料着火的化学动力学模型[J].物理化学学报,2012,28(9):2029-2036. Zheng Dong, Zhong Bei-jing. Chemical kinetic model for ignition of three-component fuel comprising iso-octane/n-heptane/ethanol[J]. Acta Physico-Chimica Sinica, 2012,28(9):2029-2036.
[10] Mehl M, Pitz W J, Westbrook C K, et al. Kinetic modeling of gasoline surrogate components and mixtures under engine conditions[J]. Proceedings of the Combustion Institute, 2011,33(1):193-200.
[11] 曾文,解茂昭.正庚烷HCCI燃烧下多环芳烃生成机理与影响因素分析[J].大连理工大学学报,2012,52(2):183-190. Zeng Wen, Xie Mao-zhao. Analyses of influencing factors and formation mechanism of polycyclic aromatic hydrocarbons inn-heptane HCCI combustion[J]. Journal of Dalian University of Technology, 2012,52(2):183-190.
[12] 张庆峰,郑朝蕾,何祖威,等.适用于HCCI 发动机的基础燃料化学动力学模型:Ⅱ:构造骨架机理[J].内燃机学报,2011,29(2):133-138. Zhang Qing-feng, Zheng Zhao-lei, He Zu-wei, et al. A chemical kinetic model of PRF oxidation for HCCI engine: II: Structure of a skeletal model[J]. Transactions of CSICE, 2011,29(2):133-138.
[13] Ra Y, Reitz R D. A reduced chemical kinetic model for IC engine combustion simulations with primary reference fuels[J]. Combustion and Flame, 2008,155(4):713-738.
[14] Narayanaswamy K, Blanquart G, Pitsch H. A consistent chemical mechanism for oxidation of substituted aromatic species[J]. Combustion and Flame, 2010,157(10):1879-1898.
[15] 贾宝山,李艳红,曾文,等.受限空间瓦斯爆炸链式反应机理的敏感性分析[J].环境工程,2011,29(增刊):318-323. Jia Bao-shan, Li Yan-hong, Zeng Wen, et al. Sensitive analysis of chain reaction mechanism of gas explosion[J]. Environmental Engineering, 2011,29(Suppl):318-323.
[16] Li Shan-ling, Jiang Yong, Qiu Rong. Detailed mechanism reduction for C3H8/DMMP/air flame based on path flux analysis-sensitivity analysis method[J]. Journal of Combustion Science and Technology, 2012,18(5):473-478.
[17] Lawrence Livermore National Laboratory. C1-C4mechanism with PAH formation[EB/OL].[2014-2-10].https://combustion.llnl.gov/mechanisms/aromatic-and-pah-formation/c1c4-mechanism-with-pah-formation.
(责任编辑 张凌云)
Reduced mechanism and analysis for thermal deflagration of C1-C4alkane mixture
Wu Song-lin1,2, Du Yang1, Li Guo-qing1, Zhang Pei-li1
(1.DepartmentofPetroleumSupplyEngineering,LogisticalEngineeringUniversity,Chongqing401311,China;>2.DepartmentofFundamentalStudies,LogisticalEngineeringUniversity,Chongqing401311,China)
For studying the chemical mechanism of thermal deflagration of gasoline-air mixture in the confined space, the temperature of the system, the concentration of main components and the generation rate of production in the deflagration process of C1-C4alkane were simulated with CHEMICAL4.1 as a platform. Based on the analysis for the simulated data of the chemical mechanism, three results were obtained as follows. (1)By sensitivity analysis, rate-of-production analysis, path analysis and so on, the detailed oxidation mechanism of C1-C4alkane was studied, and drew a reduced mechanism which consisted of 37 species and 80 reactions. The comparison of the two mechanisms was presented. (2) There existed three distinct stages in the thermal deflagration process based on the analysis for the mechanism, namely slow oxidation, rapid oxidation and reaction equilibrium. (3) In the whole chain reaction process, the reactions generating hydroperoxyl and hydrogen peroxide were the key reactions because the hydrogen and hydroxyl groups were largely generated from them so that they induced the deflagration happen finally.
mechanics of explosion; reduced mechanism; sensitivity analysis; C1-C4alkane; gasoline-air mixture; rate-of-production analysis
10.11883/1001-1455(2015)05-0641-10
2014-04-08;
2014-05-18
国家自然科学基金项目(51276195);重庆市基础与前沿计划研究项目(cstc2013jcyjA00006)
吴松林(1973— ),男,博士研究生,副教授,wusonglin100@163.com。
O381 国标学科代码: 1303510
A

