大肠杆菌O157∶H7微滴数字PCR定量方法的建立
董莲华等

摘 要 以大肠杆菌O157∶H7 (E. coli O157∶H7)rfbE基因为靶基因,建立了可对其准确定量的微滴数字PCR(ddPCR)方法。对ddPCR反应中的探针浓度进行了优化,考察了方法的线性范围、精密度、定量限和检出限。最终确定ddPCR反应中的最佳探针浓度为300 nmol/L。E. coli O157∶H7基因组DNA浓度范围为4~1.25×105拷贝/20 μL ddPCR反应液时,ddPCR方法线性相关系数(R2)为0.999。当DNA浓度为760~88400拷贝/20 μL时,方法的精密度最好(RSD<5%)。本方法的定量限为4拷贝/20 μL,检出限为3拷贝/20 μL。特异性验证结果表明,建立的ddPCR方法特异性良好,对13份猪肉、牛肉和鸡肉样品的检测结果与定量PCR方法检出结果一致。
关键词 微滴数字聚合酶链式反应; 大肠杆菌O157∶H7; 拷贝数
1 引 言
大肠杆菌O157∶H7(E. coli O157∶H7)是肠出血性大肠杆菌常见的血清型,是以食物为主要的传播途径的致病菌,牛、羊、猪和鸡等家畜家禽是其主要宿主[1,2]。可引起严重并发症, 甚至导致死亡,死亡率可达5%~10%。近年,肠出血性大肠杆菌O157∶H7感染在世界各地都有不同规模的爆发和流行,在世界范围内都受到普遍关注。此外,E. coli O157∶H7的感染剂量极低,在食入不足10个细菌就可能引起疾病[2,3]。目前还没有一种特效药或有效的治疗手段,因此建立快速、有效的检测方法对E. coli O157∶H7的预防工作显得尤为重要。
目前,检测肠出血性E. coli O157∶H7的方法可分为传统方法、免疫方法和分子检测方法。传统的分离培养法和生化鉴定时间长,灵敏度低; 免疫学方法虽然检测时间相对较短[4],但是容易发生于大肠杆菌的多种血清型的交叉反应。刘霞等[5]采用纳米金标记抗体增强表面等离子体共振(SPR)传感器对E. coli O157∶H7进行检测。随着分子生物学技术的发展,聚合酶链式反应(PCR)方法被广泛用于E. coli O157∶H7 疾病的快速诊断中。实时荧光定量PCR(Real time quantitative PCR,qPCR)[6,7]技术以其特异性强、灵敏度高、速度快等优点在基因表达、病原体基因检测等方面得到广泛应用,已经成为当前细菌快速检测的重要方法,并已成功用于不同来源的E. coli O157∶H7的检测中[8~12]。如Fratamico等[10]建立了不同食品中针对stx1、stx2、wzyO157、eae和 fliC目标基因检测E. coli O157∶H7的多重定量PCR方法。Bonetta等[12]建立了一步富集法结合PCR方法检测地表水中的E. coli O157∶H7,解决了由于方法灵敏度的限制而难以检测地表水中的E. coli O157∶H7,检测限低至3 CFU/L。
微滴数字PCR方法(Droplet digital PCR, ddPCR)是近年来发展起来的快速、准确、可实现DNA绝对定量的PCR方法。其原理是通过把稀释到一定浓度的DNA分子分布在一定数目的微滴中,使大部分微滴中的DNA分子数目为1或0,然后通过PCR扩增和荧光信号的累计读取阳性微滴数目,再根据泊松分布计算出样本中的DNA分子数[13~15]。本方法无需依赖外部核酸标准,可实现核酸绝对定量分析。ddPCR与qPCR方法相比,本方法无需核酸标准品,又兼具qPCR方法的优点,用于环境微生物[16]和病原体基因的检测具有更广阔的应用前景。因此, 研究和建立E. coli O157∶H7的ddPCR方法,对E. coli O157∶H7的快速、 准确的定性和定量检测具有重大意义。本研究在之前建立的qPCR方法[17]基础上,进行ddPCR检测E. coli O157∶H7方法的建立和优化。
2 实验部分
2.1 仪器与试剂
Nanodrop 2000超微量紫外分光光度计(美国赛默飞世尔公司); Roche Light Cycle 480实时荧光定量PCR仪(瑞士罗氏诊断公司); QX100微滴式数字PCR仪(美国伯乐公司)。
E. coli O157∶H7(ATCC 35150)、志贺氏菌、霍乱弧菌、金黄色葡萄球菌、副溶血性弧菌等非大肠杆菌菌株和5 株非O157∶H7 血清型大肠杆菌基因组DNA由北京基因组研究所提供。实时荧光定量PCR试剂盒(美国Life Technology公司)。微滴数字PCR定量试剂盒(美国伯乐公司)。肉类样品购自本地超市和集贸市场。
2.2 实验方法
2.2.1 引物探针设计 根据E. coli O157∶H7编码脂多糖的rfbE特异性基因序列,设计的引物和探针序列见表1,采用设计好的引物和探针建立实时荧光定量PCR方法,包括扩增循环条件的优化及引物和探针浓度的优化。
2.2.2 探针浓度优化 PCR体系中上下游引物浓度分别为400 nmol/L,设置探针浓度分别为100, 200, 300和400 nmol/L,然后加入12.5 μL PCR mastermix,DNA模板5 μL,用1×TE0.1补足25 μL。然后进行qPCR扩增。扩增条件确定为:95 ℃,4 min,40个循环; 95 ℃,15 s; 60 ℃,1 min。
2.2.3 微滴数字PCR线性范围 将E. coli O157∶H7基因组DNA进行梯度稀释,分别标记为S0~S8,根据紫外分光光度计测定结果计算,在总体积为20 μL的ddPCR反应体系中加入稀释好的S0~S8的DNA模板4 μL,使稀释后的浓度分别为1.08×106, 2.63×105, 1.07×105, 1.05×104, 1.04×103, 1.06×102 , 21.2, 10.6和1.01拷贝/20 μL ddPCR反应液,进行ddPCR方法的线性范围研究[16]。ddPCR扩增的循环条件为:95 ℃,4 min,40个循环; 95 ℃,15 s; 60 ℃,1 min; 98 ℃,10 min。
在考察本方法的线性范围时,每个浓度梯度设置4次重复。以4次重复测量结果的RSD值表示ddPCR测定O157∶H7时相应浓度下的精密度,以E. coli O157∶H7基因组DNA浓度的对数为横坐标,以相应浓度下测定的ddPCR方法的精密度为纵坐标作图,研究ddPCR方法精密度与目标基因组浓度之间的相关性。
2.2.4 方法特异性验证 分别提取购自ATCC的菌株E. coli O157∶H7 参考株、沙门氏菌、军团菌、霍乱弧菌、金黄色葡萄球菌、单增李斯特菌和5 株非O157 血清型大肠杆菌的纯培养物菌液的基因组DNA,浓度分别为:4.1×103拷贝、3.8×103拷贝、4.2×103拷贝、5.1×103拷贝、4.1×103拷贝、5.2×103拷贝、5.7×103拷贝、4.8×103拷贝、4.7×103拷贝、5.2×103拷贝和5.4×103拷贝,按照优化的条件进行ddPCR检测,验证其特异性。
2.2.5 实际样品分析 无菌条件下取10 g样品于90 mL含20 mg/L新生霉素的改良EC肉汤中, 42 ℃培养,取适量培养液参考文献[18]的方法进行基因组DNA的提取。然后进行ddPCR和实时荧光定量PCR[19]两种方法检测。
3 结果与讨论
3.1 探针浓度的确定
由于ddPCR方法对结果的判读是基于反应终点阅读到的微滴的荧光信号强度,荧光信号高于阈值的反应判定为阳性反应,低于阈值的反应则判定为阴性反应,然后根据得到的阳性微滴和阴性微滴的数目,利用泊松分布公式[16]计算出目标DNA分子的浓度。因此ddPCR方法中所有反应扩增后累积的荧光信号的强弱直接决定了该方法的准确性,而荧光信号的累积与PCR扩增效率密切相关。在没有PCR抑制因子的情况下,PCR扩增效率与PCR扩增体系中的引物、探针浓度密切相关。通常qPCR方法的扩增体系可以直接用到ddPCR方法上,但如果微滴数字PCR扩增结果不够理想,需要对探针浓度进行调整。
采用qPCR对探针的浓度进行了优化和确定。探针浓度分别为100, 200, 300和400 nmol/L时,qPCR扩增的Ct值分别为27.85, 28.49, 28.80和29.05,即探针浓度在100 nmol/L时,Ct值最小。从荧光信号强度来看,探针浓度为300 nmol/L时, qPCR荧光信号强度达到最高,探针浓度在400 nmol/L时,荧光信号强度与300 nmol/L时的荧光信号强度无显著差异。综合考虑荧光信号强度和Ct值两个指标,确定探针浓度为300 nmol/L。
3.2 微滴数字PCR扩增
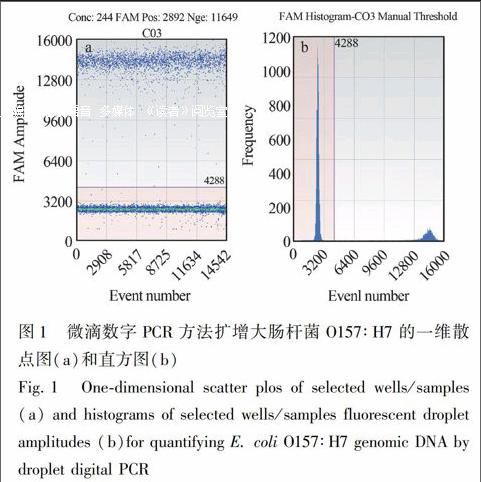
ddPCR对E. coli O157∶H7 DNA扩增的一维散点图和直方图见图1。经过优化的PCR体系对O157∶H7基因组DNA扩增结果良好,其中阳性微滴和阴性微滴明显分成两簇(图1a),而且中间弥散的微滴数目很少; 直方图(图1b)中阳性峰和阴性峰显著分开,中间没有任何干扰,表明经过优化确定的ddPCR探针浓度和扩增体系适合对E. coli O157∶H7进行定量分析。
3.3 微滴数字PCR线性范围
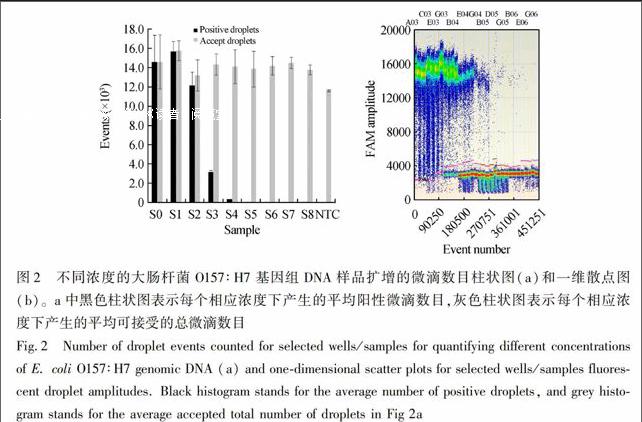
所有反应(32个)生成的平均微滴数目为14101±1759,每个浓度下产生的可接受的平均微滴数目均大于10000(图2a),表明所有反应微滴生成正常,保证了后续定量分析的准确性。从S1至S8生成的可接受总微滴数和阳性微滴数分布图(图2a)还可看出,DNA样品从高浓度至低浓度经过扩增后,阳性微滴数目随着浓度的降低而逐渐减少,但阴性微滴数目却逐渐增加。在S0中,阳性微滴数与微滴总数接近,表明所有的微滴有DNA分子分布,该浓度下所有微滴均被DNA饱和,无阴性微滴存在,这可在一维散点图(图2b)上得到证实。如果DNA浓度过高,微滴不满足泊松分布,定量结果将显著偏离真实值,无法实现ddPCR的准确定量。因此在图3中,S0不在线性直线上。此外,NTC中没有检测到阳性微滴,可见该体系中没有污染或非特异性扩增,方法的特异性较好。
由图3可知,从S7至S1,E. coli O157∶H7基因组DNA浓度范围在4.16拷贝/20 μL ~1.25×105拷贝/20 μL, 线性关系良好,线性相关系数为0.999,因此可以确定ddPCR方法对E. coli O157∶H7定量检测的线性范围为5个数量级。这与之前的研究结果[20]一致。
3.4 微滴数字PCR方法测定大肠杆菌O157∶H7基因组DNA的定量限(LOQ)和检出限(LOD)
由图3可见,S7为可准确定量的最低浓度,ddPCR测定的S7在PCR反应液中的浓度为0.2 拷贝/μL,因此该方法检测E. coli O157∶H7基因组DNA的定量限为4拷贝/20 μL。对于检测限的确定,当20 μL ddPCR反应液中含1拷贝、2拷贝、3拷贝和4拷贝DNA时,经ddPCR检测后,3拷贝和4拷贝的样品检测结果均为阳性,因此ddPCR方法测定E. coli O157∶H7的检测限确定为3 拷贝/20 μL。
3.5 微滴数字PCR方法的精密度与目标基因组DNA浓度之间的关系
由图4可见,ddPCR方法的精密度和所测定的DNA浓度有很好的相关性,R2=0.91。当每个反应中DNA量由低到高逐渐增加时,测定结果的精密度逐渐增高,即RSD降低; 但DNA量增加到一定值时,方法精密度不再增加,之后随着每个反应中的DNA量的增加,精密度降低,即RSD增加。由图4可知,当DNA浓度为4拷贝/20 μL时,测量结果的RSD=51%,而当浓度增加到759拷贝/20 μL时,测定结果的重复性达到5%, DNA浓度为8419拷贝/20 μL时,测定结果的精密度达到最好(RSD为0.39%)。当DNA浓度在760拷贝/20 μL~88400拷贝/20 μL时,测量结果的RSD小于5%。因此,采用ddPCR对E. coli O157∶H7基因组DNA进行绝对定量时,将DNA浓度控制在759~88417拷贝/20 μL范围内,可保证ddPCR测量结果的精密度好、准确度高。
3.6 特异性检测
采用5株非大肠杆菌和5株大肠杆菌非O157∶H7血清型的菌株基因组DNA进行ddPCR方法特异性验证,结果表明,除了E. coli O157∶H7得到了特异性扩增,其它菌株的检测均为阴性,表明建立的ddPCR方法特异性良好。
3.7 肉类样品检测
从市场和超市共采集肉类样品13份,其中猪肉7份、牛肉3份、鸡肉3份。分别采用我国出入境检验检疫行业标准中规定的qPCR方法和本研究建立的ddPCR方法对肉类样品进行E. coli O157∶H7检测。检测结果表明,13份样品中,猪肉和鸡肉各1份样品为E. coli O157∶H7阳性,两种方法检测结果一致。
猪肉、牛肉和鸡肉各1份阴性样品,各添加高、中、低3个浓度(5.25×103,5.25×102和1.20 CFU)的标准E. coli O157∶H7菌液后,经ddPCR测定后的回收率均大于96%,表明肉类基质对ddPCR测定E. coli O157∶H7无显著影响。
3.8 肠出血性E. coli O157∶H7 dd PCR方法的优点
采用传统的分离培养方法进行肠出血性E. coli O157∶H7的鉴定和检测至少需要4~7天,检出限约为104 CFU/mL。郭小英等[21]利用化学发光磁酶免疫分析法,将食品中肠出血性E. coli O157∶H7的检出限降低至850 CFU/mL。徐义刚等[22]利用对退火温度不敏感的DPOPCR技术,检测E. coli O157∶H7的检出限达到94 CFU/mL。通常,在无预增菌的情况下,普通的PCR技术可检测30 CFU/mL的E. coli[12]。姜君等[17]针对E. coli O157∶H7的同一基因(rfbe)建立了特异性更好的TaqMan探针荧光定量PCR方法,在无需富集的情况下,检出限可达到10 拷贝/20 μL(3 CFU/mL)。本研究中针对O157∶H7的rfbe基因所建立的ddPCR方法的检测限可到3拷贝/20 μL(1CFU/mL)。可见,ddPCR方法检测肠出血性E. coli O157∶H7的灵敏度非常高。
由于前期研究[18]中用经生化鉴定和血清学鉴定为阳性的13 株O157∶ H7 大肠杆菌、50 株非O157∶H7大肠杆菌对针对同一基因的荧光定量PCR方法的特异性进行了验证,本研究中ddPCR方法所使用的引物和探针与之前研究相同,而PCR方法的特异性主要取决于引物和探针的特异性,经过验证,本研究建立的ddPCR方法的特异性与qPCR方法的特异性表现一致。
ddPCR测定E. coli O157∶H7基因组含量的结果与紫外吸收法测定结果相比显著偏低,方法的特异性更强。而紫外方法测定的是所有在260 nm处有吸收的物质,无法区分DNA与RNA、蛋白质等杂质[23,24],通常会导致测定结果偏高,这与文献\[20\]的结果一致。
References
1 NI DaXin, WANG Hua, GU Ling. Chinese J. Epidemiology, 2002, 23(2): 102-104
倪大新, 汪 华, 顾 玲. 中华流行病学杂志, 2002, 23(2): 102-104
2 YIN YiZheng, CHENG ChunRong, YANG JianGuo. Modern Preventive Medicine, 2007, 34(21): 4175-4177
殷毅峥, 程春荣, 杨建国. 现代预防医学, 2007, 34(21): 4175-4177
3 Kehl S C. Clin .Microbiol., 2002, 40(8): 2711-2715
4 CUI Xi, XIONG QiRong, XIONG YongHua, SHAN Shan, LAI WeiHua. Chinese J. Anal.Chem., 2013, 41(12): 1812-1816
崔 希, 熊齐荣, 熊勇华, 山 珊, 赖卫华. 分析化学, 2013, 41(12): 1812-1816
5 LIU Xia, LI RongZuo, LI Lei, LI WenJin, ZHOU ChunJiao. Chem. J. Chinese Universities, 2013, 34(6): 1516-1520
刘 霞, 李蓉卓, 李 蕾, 李文进, 周春娇. 高等学校化学学报, 2013,34(6): 1516-1520
6 CHEN Si, HUANG KunLun, XU WenTao. J. Agricultural Biotech, 2006, 14(5): 779-782
陈 思, 黄昆仑, 许文涛. 农业生物技术学报, 2006, 14(5): 779-782
7 Reischl U, Mohammad T Y, Jochen K. J. Clin. Microbiol, 2002, 40(7): 2555-2565
8 XU XiaoKe, WU QingPing, ZHOU YanHong, ZHANG JuMei, YANG XiaoJuan. Microbiol., 2008, 35(4): 619-622
徐晓可, 吴清平, 周艳红, 张菊梅, 杨小娟. 微生物学通报, 2008, 35(4): 619-622
9 HU Hui, CHEN YaJun, DUAN ZhiGang, MENG ZhenBei, PENG XinRan, ZHANG LongXian, CUI BaoAn, WANG YaBin. Food Sci., 2011, 32(12): 278-282
胡 慧, 陈雅君, 段志刚, 孟振北, 彭新然, 张龙现, 崔保安, 王亚宾. 食品科学, 2011, 32(12): 278-282
10 Fratamico P M, DebRoy C. Food Anal. Methods, 2010, 3(4): 330-337
11 Vidová B, Tóthová E, Blahut L, Horváthová V, Godány A. Biologia., 2011, 66(3): 401-405
12 Bonetta S, Borelli E, Bonetta S, Conio O, Palumbo F, Carraro E. Environ. Monit. Assess, 2011, 177(14): 493-503
13 Kalinina O, Lebedeva I, Brown J, Silver J. Nucleic Acids Res., 1997, 25(10): 1999-2004
14 Sykes P J, Neoh S H, Brisco M J, Hughes E, Condon J, Morley A A. Biotechnol., 1992, 13: 444-449
15 Vogelstein B, Kinzler K. P. Natl. Acad. Sci. USA, 1999, 96(16): 9236-9241
16 DONG LianHua, MENG Ying, WANG Jing. J. Microbio., 2014, 54(3): 179-188
董莲华, 孟 盈, 王 晶. 微生物学报, 2014, 54(3): 179-188
17 JIANG Jun, WANG PengZhi, LIU LiCheng, WU WeiLi, CHEN WeiJun. Progress in Modern Biomedicine, 2012, 12(12): 2201-2204
姜 君, 王鹏志, 刘利成, 吴伟立, 陈唯军. 现代生物医学进展, 2012, 12(12): 2201-2204
18 LIU Gang, ZHAI ChaoYang. Medical Journal of West China, 2004, 16(2): 111-113
刘 刚, 翟朝阳. 西部医学, 2004, 16(2): 111-113
19 SN/T18702007, Detection of Pathogens in FoodRealTime PCR Method. Entryexit Inspection & Quarantine Trade Standard of the People′s Republic of China
食品中致病菌检测方法实时PCR法. 中华人民共和国出入境检验检疫行业标准. SN/T18702007
20 Dong L, Meng Y, Wang J. Anal. Bioanal. Chem., 2014, 406: 1701-1712
21 GUO XiaoYing, WANG YongNing, GU LinGang. J. Cellular Molecular Immunology, 2006, 22(3): 395-398
郭小英, 王永宁, 顾林岗. 细胞与分子免疫学杂志, 2006, 22(3): 395-398
22 XU YiGang, LI DanDan, CUI LiChun, LIU ZhongMei, LI SuLong. Food Sci., 2014, 35(8): 160-164
徐义刚, 李丹丹, 崔丽春, 刘忠梅, 李苏龙. 食品科学, 2014, 35(8): 160-164
23 Whale, A S , Huggett J F, Cowen S, Speirs V, Shaw J, Ellison S, Foy C A, Scott, D J. Nucleic. Acids Res., 2012, 40(11): 82-87
24 Dng L, Zang C, Wang J, Li L, Gao Y, Wu L, Li P. Anal. Bioanal. Chem., 2012, 402(6): 2079-2088
Abstract A droplet digital polymerase chain reaction (ddPCR) method for quantifying E. coli O157∶H7 by targeting rfbE gene was developed. The probe concentration in ddPCR was optimized and the linearity range, precision, limit of detection (LOD) and limit of quantification (LOQ) were also evaluated. The optimized probe concentration was 300 nmol/L. The ddPCR response was linear over the E. coli O157∶H7 genome DNA concentration range from 4 to 1.25×105 copies in 20 μL ddPCR system and the linear correlation coefficient (R2) was 0.999. The ddPCR precision (RSD) was less than 5% over the DNA concentration range from 760 to 88400 copies/20 μL. The LOD and LOQ was 3 copies in 20 μL and 4 copies in 20 μL, respectively. Specificity test showed that the ddPCR was specific for detecting E. coli O157∶H7. Both ddPCR and standard real time quantitative PCR showed the same results for 16 real samples of chicken meat, pork and beef, which indicated that ddPCR method was suitable for detection of E. coli O157∶H7 in food.
Keywords Droplet digital polymerase chain reaction; Escherichia coli O157∶H7; Copy number
(Received 3 July 2014; accepted 1 December 2014)

