纳米银的来源及其影响污水和污泥处理的研究进展
吴丽娟,郑雄,陈银广(同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室,上海200092)
纳米银的来源及其影响污水和污泥处理的研究进展
吴丽娟,郑雄,陈银广
(同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室,上海200092)
第一作者:吴丽娟(1989—),女,硕士研究生,主要从事污水脱氮除磷研究工作。E-mail wlij2009@126.com。
联系人:郑雄,讲师,研究方向为纳米材料对污水及污泥处理系统的影响。E-mail xiongzheng@tongji.edu.cn。
摘要:近年来随着纳米银生产和使用的逐渐增多,导致环境中纳米银的浓度逐渐升高。物质流分析表明,大部分的纳米银将随污水进入污水处理厂,进而富集到污泥中。鉴于纳米银的抗菌性,其可能会对污水处理系统中的微生物产生影响。本文首先系统介绍了环境水体中纳米银的不同来源(即天然来源和人为来源),着重总结了目前对其影响污水和污泥处理系统的研究,即对污水中碳、氮、磷的去除效率和污泥厌氧消化过程的影响,并进一步分析了其对这一过程中微生物的毒性作用,探讨了其毒性效应的来源及作用机理,最后对该领域的研究进行了展望。综述内容为深入研究纳米银对污水和污泥处理系统的潜在风险提供了一定的理论基础。
关键词:纳米材料;环境;污染;脱氮除磷;污泥发酵
纳米材料(nanomaterials)是指结构在三维尺度中至少有一维处于纳米范围(1~100nm)的物质,其表现出强烈的表面效应、小尺寸效应、宏观量子隧道效应和量子尺寸效应,使得纳米材料的理化特性优于一般材料,因而被广泛应用于表面涂料、医药业、化妆品和催化剂等领域[1]。目前应用最为广泛的是金属及其氧化物和碳纳米材料,而金属纳米颗粒中的纳米银(silver nanoparticles,简称AgNPs)因其优越的抗菌性而被广泛应用于日常生活中,如医疗、食品、纺织、水质净化等,每年工业上使用的纳米材料中超过50%含有Ag[2],纳米银在制备、使用、废弃及循环过程中将不可避免地进入到环境当中。
目前的研究已证实,纳米银在较低的暴露浓度下即可抑制模式微生物如大肠杆菌的生长和代谢[3-4]。而污水处理系统中起主要作用的是微生物,若其活性受到抑制,污水处理效率将受到很大影响。近年来,关于纳米银的来源及毒性效应的研究已取得了很大进展,而其对污水处理和污泥厌氧消化的影响研究也有了大量成果[5]。所以,本文综述了环境中纳米银的不同来源,包括水体的光致还原生成和人类生产活动产生的纳米银;讨论了纳米银对污水碳、氮、磷的去除效率及污泥厌氧消化的影响;最后概述了纳米银对其微生物的毒性机制,为进一步研究纳米银在污水处理中的影响提供一定的理论基础。
1 纳米银来源
据初步估计,2008年全世界生产的纳米银达到500t,且产量仍在不断增加[6]。2011年,Woodrow Wilson国际中心列出的1317个产品中,含有纳米银的产品数量位列第一(24%,313种产品)[7]。纳米银所呈现出的优于大部分金属的性质,引起了将其应用于新领域的探讨。关于环境中纳米银的来源(如图1),也引起了社会的关注,尤其是近来发现的自然水体中Ag+的光致还原现象。
1.1自然来源
近来有研究证实纳米银在自然水体中也能形成。Yin等[8]证实了Ag+在天然日光照射的自然水体(如河水)中,可被溶解性有机质(dissolved organic matter,简称DOM)还原成纳米银,但这样生成的纳米银不稳定,可与如Ca2+或Mg2+的无机阳离子结合。其反应机理可能是:①苯酚基团的电子直接转移到金属离子上,形成络合物;②溶解氧与苯酚基团反应生成超氧负离子,将金属离子还原成低价态。推测反应如式(1)~式(4)。
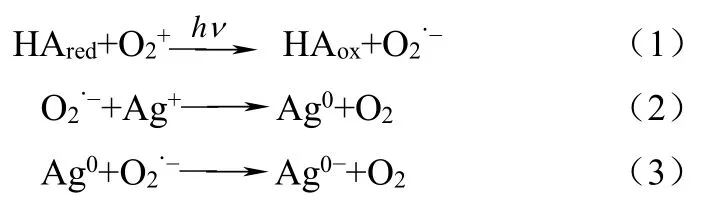
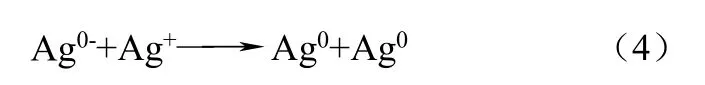
这项研究表明,自然光照引发Ag+的还原是纳米银可能的天然来源,且在富含溶解性有机物的环境水体中,溶解氧的存在可明显促进纳米银的生成。Adegboyega等[9]用富烯酸为有机物质,研究了在Ag+存在的条件下,水体中形成纳米银的过程及其稳定性,结果表明纳米银的形成依赖于溶液的pH值和温度等因素。Ag+浓度与温度升高,纳米银的生成量将会增加,且其稳定性优于用柠檬酸修饰的纳米银。Akaighe等[10]发现在腐殖酸存在时,在室温下(22℃),浓度低的Ag+(1mg/L)也可与沉积物或河流中的腐殖酸反应生成纳米银。另有研究表明,物品的含银涂层通过氧化和还原也可生成纳米银,如钢丝、珠宝和餐具等[11]。Gardea等[12]发现紫花苜蓿的根可以吸收银离子,通过特殊的渠道运输至不同的部位,合成纳米银。
由以上可知,并不是所有的纳米银皆是人类活动引入环境的,当条件适宜时,环境中存在的Ag+可以还原生成纳米银,植物体内也可合成纳米银。但环境中生成纳米银的数量有限,人类活动仍是纳米银的主要来源。

图1 环境中纳米银的来源
1.2人为来源
据调查,家用电器、服装、电子产品、儿童玩具、住房材料均是纳米银的潜在释放源。在洗涤纺织品或冲洗塑料制品时,其涂层上的纳米银会溶解进入水中。Benn等[13]用650μg Ag/500mL H2O溶液淋溶袜子得到最大浓度为1360μg Ag/g sock的溶液。Geranio等[14]发现大部分释放的纳米银(>50%~75%)来自于洗衣机内部涂层,其释放的纳米银的最大浓度可达到377μg/g,且粒径大于450nm。Benn 等[15]从衬衫、面具和医疗用品等检测到有粒径小于100nm的纳米银释放,而牙膏、洗发水和清洁剂中释放的纳米银粒径大于100nm。
在制造工业产品时,车间气溶胶可能含有纳米银,其通过敞开的窗口逸出,进而流入大气。另外,其他生产过程,如机器研磨、包装等均可造成纳米银泄露。消毒喷雾剂的使用,进一步增加了空气中的纳米银含量[16]。根据菲克第一定律,纳米银可在空气中快速扩散,使人类暴露在此环境中。纳米银比表面积较大,粉尘、细菌等黏附在其表面,使其比原始粒子的毒性更强。在传输的过程中,由于聚集或重力作用沉降在物质表面,被雨水冲刷进入污水处理厂或水生系统。污水经处理后可在很大程度上降低纳米银的浓度,但仍有一部分纳米银随污水进入地表水。而去除的纳米银沉积在污泥上,模拟可得到每年进入填埋场的纳米银平均有4.77t[6]。处置后的污泥作为农业肥料或添加剂会导致纳米银进入土壤中,可能会对土壤微生物产生影响。
此外有研究表明纳米银可释放出Ag+,而极低浓度的Ag+对水生生物也具有较强的毒性,故进入污水处理厂的纳米银可能会抑制其中有益微生物的生长。虽然纳米银对环境存在一定的潜在风险,但对于其对污水和污泥处理的影响尚缺乏系统和完整的报道,本文在现有文献的基础上,总结和讨论了纳米银对污水处理系统的影响。
只犹豫了片刻,他便有了主意,乘人力车直奔警察局。虽然他不喜欢石警官,但通过警员来问四小姐的住址,显然是行之有效的办法。还好,他没遇见石西岳。面对他的提问,一名警员上上下下打量他几眼,才笑着说:“四小姐都不知道?陈司令家的千金,就在隔壁大院。”
2 纳米银对污水处理的影响
目前城市的污水处理多采用生物法,通过微生物对污水中的氮磷进行吸收、转化和降解(如图2)。大部分的纳米银进入到污水中,致使活性污泥中的微生物群体暴露在纳米银的环境中。最新的研究表明,污水中纳米银的浓度范围主要在100~200ng/L[17]。尽管目前污水中纳米银浓度还未达到较高水平,但是随着含纳米银的消费产品使用的快速增长,其在环境中浓度将不断增加。同时由于纳米银及Ag+有抗菌性,其对污水处理的潜在影响不能被忽视。
2.1纳米银对碳去除的影响
污水处理是利用微生物的新陈代谢作用去除污染物,其正常生长对污水中有机物和营养物质的去除至关重要。Alito等[18]发现在SBR反应器中,当加入0.2mg/L纳米银时,COD的去除率从最初的99%下降至71%,一段时间(3天)后,COD去除率恢复至原水平(92%)。Liang等[19]建立了一个MIE(modified ludzack–ettinger)过程评估纳米银对污水处理的潜在影响,并确定纳米银对细菌的冲击荷载(峰值浓度为0.75mg/L),其结果表明废水中的平均COD的浓度无明显差异,分别为(10.2± 4.4)mg/L和(10.2±3.1)mg/L。Hou等[20]采用3个SBR反应器,纳米银浓度分别为0、0.1mg/L、0.5mg/L,得到处理后的污水COD的浓度无明显区别。Zhang 等[21]表明污水中纳米银的浓度等于或低于0.1mg/L对活性污泥系统无明显的影响。与此类似,Wang 等[22]发现浓度为0.5~2.5mg/L的纳米银对COD的去除无抑制作用。
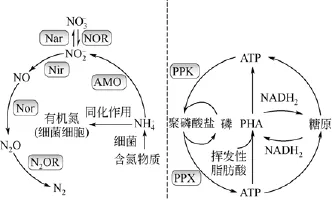
图2 污水处理过程中氮磷的转化
综上所述,低剂量的纳米银对污水中碳去除无显著性影响。Liang等[19]认为其原因可能是污水中COD去除主要依赖于异养微生物的分解,其对低浓度的纳米银具有一定的抗性能力。同时污水处理系统中含有多种其他离子,纳米银进入系统中可能与其发生反应,生成其他化学物质,或者其自身形态在光照条件下发生变化,因而降低其毒性效应。然而随着社会的发展及纳米银的广泛应用,以及污水中污染物质的成分和种类也日益复杂,污水处理技术也日新月异,高浓度的纳米银对污水处理系统的影响同样值得探究。
2.2纳米银对脱氮的影响
污水中除了含有有机污染物,也含有大量的营养物质(如氮、磷等)。氮的去除一般经过两步,即硝化与反硝化过程。硝化过程被认为是易受外界影响的过程之一,起作用的主要是自养生物,其生长缓慢,对温度、pH值、溶解氧和有毒的化学物质敏感。氨氧化细菌是其中最敏感的微生物,其含有amoA基因,可编码氨单加氧酶(AMO),可将氨氧化成羟氨(NH2OH),而AMO活性容易被重金属等抑制[23]。
Yang等[24]发现在低浓度(10%最小抑菌浓度)时,纳米银或Ag+对假单胞杆菌脱氮基因narG、napB、nirH、norB的表达无明显的影响,硝化细菌的硝化基因表达提升了2.1~3.3倍,在高浓度时转变为抑制作用。Fabrega等[25]研究了不同条件(溶液pH值、纳米银浓度、有机物浓度等)下纳米银对假单胞杆菌生长的影响,发现纳米银的存在使得该微生物的生长受到抑制(0.002mg/L,3 h)。Yang 等[26]发现40mg/L的纳米银(粒径35nm)可抑制氨氧化细菌的生长,其细菌丰度比空白减少了24%。张汝嘉[27]采用浓度0.12~4.82mg/L的纳米银悬浊溶液(粒径9nm、13nm、15nm、23nm)测试其对氨氧化细菌和亚硝酸盐氧化菌的抑制作用。结果表明在4.82mg/L的纳米银(粒径23nm)悬浊溶液中,氨氮去除率下降到原来的70%,亚硝酸盐的去除率变化不显著,由此可见氨氧化细菌比亚硝酸盐氧化菌更易受到外界条件的影响。Choi等[3]发现低浓度的纳米银(0.05~1mg/L)能抑制硝化菌的生长。
纳米银不仅会对纯种微生物产生毒性作用,其对污水处理系统中的微生物群也会产生影响。Liang 等[19]研究了纳米银(1mg/L)对污水处理系统的影响,结果表明连续进料12h之后,反应器中出现了长时间的硝化抑制现象,硝化反应仅为空白的44%,表现为氨氮和亚硝酸盐的积累。Jeong等[28]研究了纳米银在有氧和缺氧条件下对生物脱氮过程的短期和长期影响。在短期的序批式处理系统中,纳米银浓度分别为1mg/L和10mg/L,其硝化速率分别下降7%和26%,反硝化速率没有明显差异,进一步说明硝化过程比反硝化过程更易受到影响。而Hou 等[20]研究发现加入低浓度纳米银(0.5mg/L)在SBR反应器中,氨氮的去除率在初始阶段降低,后续阶段去除率得到恢复。Alito等[18]也发现纳米银对污水中氨氮的去除没有明显的抑制作用。
目前纳米银对氮去除的影响仍未定论,分析可能是纳米银的毒性效应与其剂量、好氧或厌氧状态及其物理聚集性质等有关。同时,污水的成分较为复杂,微生物种类较多,对外界不良环境的抵御能力比纯种微生物高。其次纳米银释放的Ag+可能与污水中部分物质反应,生成可溶性低的物质,进一步降低了纳米银的毒性效应。在生物脱氮的过程中会产生温室气体N2O,其增温潜力是CO2的310倍,而纳米银对N2O产生的影响机制同样值得关注。
2.3纳米银对除磷的影响
污水中的磷可以通过强化生物除磷(EBPR)去除,其特点是厌氧和有氧条件循环进行,这一过程与微生物的活动也密切相关。Chen等[29]研究了纳米银和Ag+(0~5mg/L)对生物强化除磷(EPBR)的影响及其作用机理,结果表明纳米银对磷去除没有显著影响,而1mg/L的Ag+溶液使磷的去除率降低至48.8%,当Ag+浓度大于2mg/L时,磷的去除受到抑制。Chen等[30]继续研究了纳米银及Ag+对EBPR的长期影响,结果表明纳米银的增加对EBPR短期和长期试验均无明显的影响。而Ag+浓度的急剧增加会造成磷去除率的下降,聚羟基脂肪酸和糖原的转换减少,胞外多磷酸酯酶的活性降低,但在长期的培养下都可恢复原状,细菌种群结构和聚磷菌生物量没有发生改变。长期暴露在Ag+环境中,细菌的胞外聚合物质增加,其缓解了Ag+对EPBR关键酶和微生物的毒性效应,除磷效率得到恢复。Sheng等[31]证实即使在高浓度(200mg/L)纳米银条件下,生物膜系统仍不受其影响。但是,当生物膜表层不存在胞外聚合物时,纳米银可显著降低生物膜的活性,这说明胞外聚合物在一定程度上缓解了纳米银对生物膜的毒性效应。
由前述可知纳米银对污水中磷的去除影响并不显著,推测此过程中细菌的胞外聚合物为细菌抵抗纳米银的毒性起到了重要作用。而目前关于纳米银对常规的污水生物处理工艺中磷去除的影响研究较少,有待研究着继续进行深入探索。生物除磷是通过排放大量的富磷污泥实现的,Liang等[19]发现污水中70%~90%的纳米银吸附在污泥上,10%~30%留在上清液中。有研究表明,污泥中纳米银的浓度范围为2~195mg/L[32],其将随污泥进入后续的处理或处置系统。
3 纳米银对污泥厌氧消化的影响
污水处理的过程中产生的剩余污泥若处理不当,有可能引起二次污染。目前厌氧消化是其资源化利用的主要方式,包括3个阶段(如图3所示)。研究发现,厌氧系统中的微生物对有毒物质的反应比有氧系统的微生物对表面活性高和原状稳定的抑制剂更敏感,对代谢抑制剂不敏感[33]。
纳米银能使污泥的絮状体结构受损,可能会对污泥资源化利用产生影响。Garcia等[34]研究了厌氧条件下纳米银对嗜热微生物和嗜温微生物产沼气的影响,发现纳米银可抑制33%~50%的甲烷产量。Yang[35]发现纳米银能降低甲烷的产量,引起挥发性脂肪酸的积累。而Gottschalk等[36]发现纳米银对厌氧生物的毒性效应不明显。Fabrega等[25]表明纳米银对污泥厌氧消化过程中气体的产量无显著性影响。与此类似,Yang等[37]研究了厌氧条件下纳米银对葡糖糖降解、污泥消化和产甲烷的影响,实验中纳米银的浓度维持在40mg/L(13.2g Ag/kg BCOD)。与空白对照相比,发现中等浓度的纳米银对产甲烷没有明显的影响,短时间内检测到的挥发性脂肪酸只有乙酸和丙酸,超过90%的纳米银从发酵液中去除。在厌氧条件下没有检测到Ag+的释放,主要微生物甲烷丝状菌和甲烷微菌的多样性和数量没有发生变化。因此纳米银对污泥厌氧消化的影响并不显著,推测其原因可能是纳米银在污泥中不稳定,易与其他物质如S2-等发生化学反应,生成毒性较低的物质。同时,纳米银容易发生聚集及沉降,诱发假阴性现象[34]。其次可能是在厌氧环境下纳米银溶出Ag+的量相对较小,对微生物的活性几乎没有抑制作用。
有学者表明吸附,聚合和低溶解是纳米银影响污泥中微生物群落结构和功能的重要因素[18]。当纳米银的浓度达到峰值时,微生物的多样性会下降;当微生物被驯化后,其在加入纳米银后也可以存活。不同尺寸,不同种类的纳米银对微生物的作用可能存在差别。故纳米银对污水处理和污泥厌氧消化的不同微生物的毒性作用机制需要进一步探讨。

图3 污泥厌氧消化三阶段
4 纳米银的毒性机制
目前普遍接受的纳米银的毒性作用机制包括:①诱导产生过氧自由基(ROS),可与细胞膜的脂质、蛋白质、核酸反应,扰乱细胞正常的传输系统,抑制DNA复制等;②纳米银本身具有毒性或其在溶液中溶出的Ag+抑制微生物的活性。其毒性作用机制如图4所示[38]。
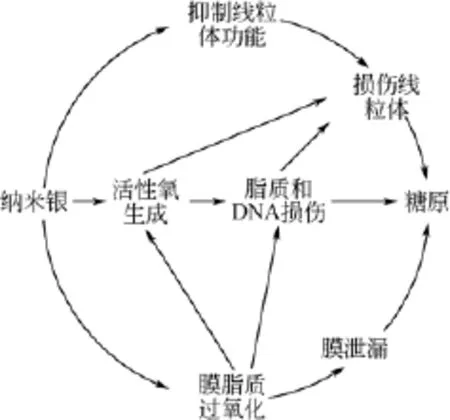
图4 纳米银的毒性作用机制
对于污水及污泥处理系统中涉及的微生物而言,有研究表明纳米银能减少硝化细菌的数量[39]。Yuan等[40]研究了纳米银对纯种硝化细菌(Nitrosomonas europaea ATCC 19718)的影响,发现细菌细胞和电解质能影响纳米银的聚集,且纳米银能破坏细胞壁,抑制重要蛋白质的合成。Choi 等[41]通过细胞膜完整性测试,表明纳米银对硝化作用的抑制是由于吸附在膜上的纳米银引起细胞间的活性氧含量升高,同时破坏了细胞壁的完整性。Radniecki等[32]发现纳米银可抑制硝化过程中AMO的活性,同时能破坏外膜的稳定性。小粒径的纳米银在水中的溶解量大,与大粒径的纳米银相比,其比表面积大,对硝化作用的抑制更强。Choi等[3]发现悬浮液中抑制硝化细菌的纳米银粒径小于5nm。张汝嘉[27]发现粒径小的纳米银溶液对硝化细菌的毒性更强,猜测是由于小尺寸的纳米颗粒更容易穿透细胞膜,可直接作用到氨氧化酶所在的硝化菌细胞膜上,从而导致了细菌生长抑制。
纳米材料溶出金属离子是其对微生物产生抑制作用的重要原因。多数学者认为超细状态的银由于其比表面积极大,遇水或在水溶液中发生反应(Ag=Ag++e),所以纳米银的杀菌作用主要与银离子有关。Navarro等[42]认为纳米银在有氧的条件下释放出的Ag+是其抗菌性的来源。Xiu等[43]表明纳米银对大肠杆菌的毒性作用低于Ag+[半数致死浓度EC50:(2.04±0.07)mg/L vs (0.10±0.01)mg/L]。Chen 等[29]表明Ag+对碳源吸收及厌氧和好氧条件下含磷物质、聚羟基烷酸(PHA)和糖原的转换抑制作用大于纳米银。不少学者表达与此相反的观点,认为与从固体银(微米级以上)中释放的银离子相比,纳米银有更优良的杀菌效果[44]。Liang等[19]比较了相同浓度的Ag+和纳米银对SBR反应器的影响,发现纳米银对生物脱氮的抑制远远高于Ag+,分别为41.4%和13.5%。Choi等[41]使用呼吸运动计量法和微量滴定分析,发现在短时间内1mg/L的纳米银对硝化细菌的生长抑制(42%)显著高于同浓度的Ag+(86%)。Yang等[39]采用焦磷酸测序的方法研究了相同浓度的纳米银及Ag+对污泥中微生物群落结构的影响,结果表明,低浓度的纳米银对微生物群落结构的影响更明显。
Fabrega等[25]认为纳米银的特定效应不能通过溶解产生的Ag+解释,与纳米银本身有关。Yin等[45]认为纳米银抑制生长或者破坏细胞的毒性效应与纳米粒子本身或者其释放金属离子的能力有关。不少学者指出纳米银毒性在低浓度时取决于其颗粒大小,认为1~10nm大小的纳米银可与细胞壁结合,进入细胞并释放Ag+,使细胞酶和DNA失活,生成活性氧(ROS),导致细胞死亡,如大肠杆菌及其他革兰氏阴性细菌[46]。Pal等[47]认为纳米银的毒性依赖于其形状,其发现三角形纳米银毒性比球状和杆状的毒性更强。纳米银表面的修饰基团对其毒性作用也有影响,柠檬酸盐和阿拉伯糖修饰的纳米银颗粒对硝化作用的抑制大于聚乙烯吡咯烷酮修饰的纳米银颗粒[48]。
由以上可推断,纳米银的毒性效应与其尺寸、种类、剂量及环境条件等众多因素有关。目前,大部分纳米银是通过有机涂层增加其稳定性,其对纳米银的性质如银离子释放及抗菌性的影响未有详细的研究。而在大多数纳米银毒性试验的研究中,并没有明确提到其释放的Ag+浓度[49]。同时影响纳米银溶出Ag+的因素包括纳米银种类和溶解氧。不同种类的纳米银的溶解性和性质不同,因此对微生物产生毒性也有所不同。溶解氧是纳米银溶出离子的重要条件。纳米银在缺少溶解氧的条件下并没有溶出银离子,对微生物的毒性作用不明显。因此,很多不确定因素需要深入探索,以便能更好地寻找降低其不利影响的途径。
有研究发现,半胱氨酸或硫化物能与Ag+形成配体化合物降低其毒性[20],也可以通过添加不同配体(SO42−、S2−、Cl−、PO43−和EDTA−)使其毒性得到一定程度的缓解,其中氯离子(Cl−)和硫离子(S2−)可以恢复氨氧化细菌30%的氨氮去除能力,而有机配体对纳米银的毒性作用没有明显缓解效果,甚至会造成更严重的抑制作用[27]。最新研究成果表明,采用细胞诱捕技术可减轻纳米银对硝化作用的抑制作用[50]。今后随着研究的不断深入,人们需要在享受纳米材料所带来便利的同时有效地防止纳米材料在生产和使用过程对环境可能造成的危害。
5 结语与展望
随着纳米银对环境的危害日益显著,环境浓度增大,当其进入水生生物体内,随着食物链的积累,对生态系统和人体的健康存在潜在的危害。因此,在未来一段时间内,关于纳米银的环境效应研究应需着眼于以下几个方面。
(1)虽然一些学者已经进行了纳米银对污水中碳和氨氮的去除的影响,但对除磷和污泥厌氧消化的影响研究较少,同时纳米银对污水处理系统的毒性作用机制仍有待完善,如何有效地减缓纳米银对污水处理系统的影响需要进一步探索。因此,纳米银对污水处理系统的影响仍有很大程度上处于未知状态。
(2)目前对于群落结构的分析大多数停留在较为传统的分子生物学方法,研究纳米银对污水处理及厌氧消化影响的关键在于微生物群落的结构分析,因此需要更为先进的分子生物学手段对污泥中微生物群落的变化进行更加细致准确的分析。
(3)纳米银可抑制微生物、污染生物膜和影响消毒过程的效率,目前有关纳米银的毒性研究中,由于纳米银的类别、粒径及暴露途径的不同,其毒性机制仍未形成定论。该领域的研究正处于起步阶段,一些研究方法或毒理性表达方式需要统一。
参考文献
[1] Lowry G V,Gregory K B,Apte S C,et al.Transformations of nanomaterials in the environment[J].Environmental Science & Technology,2012,46(13):6893-6899.
[2] Nowack B,Krug H F,Height M.120 years of nanosilver history:Implications for policy makers[J].Environmental Science & Technology,2011,45(4):1177-1183.
[3] Choi O,Hu Z.Size dependent and reactive oxygen species related nanosilver toxicity to nitrifying bacteria[J].Environmental Science & Technology,2008,42(12):4583-4588.
[4] Shrivastava S,Bera T,Roy A,et al.Characterization of enhanced antibacterial effects of novel silver nanoparticles[J].Nanotechnology,2007,18(22):225103.
[5] Sun X,Sheng Z,Liu Y.Effects of silver nanoparticles on microbial community structure in activated sludge[J].Science of the Total Environment,2013,443:828-835.
[6] Mueller N C,Nowack B.Exposure modeling of engineerednanoparticles in the environment[J].Environmental Science & Technology,2008,42(12):4447-4453.
[7] Fabrega J,Luoma S N,Tyler C R,et al.Silver nanoparticles:Behaviour and effects in the aquatic environment[J].Environment International,2011,37(2):517-531.
[8] Yin Y,Liu J,Jiang G.Sunlight-induced reduction of ionic Ag and Au to metallic nanoparticles by dissolved organic matter[J].ACS Nano,2012,6(9):7910-7919.
[9] Adegboyega N F,Sharma V K,Siskova K,et al.Interactions of aqueous Ag+with fulvic acids:Mechanisms of silver nanoparticle formation and investigation of stability[J].Environmental Science & Technology,2012,47(2):757-764.
[10] Akaighe N,MacCuspie R I,Navarro DA,et al.Humic acid-induced silver nanoparticle formation under environmentally relevant conditions[J].Environmental Science & Technology,2011,45(9):3895-3901.
[11] Glover R D,Miller J M,Hutchison J E.Generation of metal nanoparticles from silver and copper objects:Nanoparticle dynamics on surfaces and potential sources of nanoparticles in the environment[J].ACS Nano,2011,5(11):8950-8957.
[12] Gardea-Torresdey J L,Gomez E,Peralta-Videa J R,et al.Alfalfa sprouts:A natural source for the synthesis of silver nanoparticles[J].Langmuir,2003,19(4):1357-1361.
[13] Benn T M,Westerhoff P.Nanoparticle silver released into water from commercially available sock fabrics[J].Environmental Science & Technology,2008,42(11):4133-4139.
[14] Geranio L,Heuberger M,Nowack B.The behavior of silver nanotextiles duringwashing[J].Environmental Science& Technology,2009,43(21):8113-8118.
[15] Benn T,Cavanagh B,Hristovski K,et al.The release of nanosilver fromconsumer products used in the home[J].Journal of Environmental Quality,2010,39(6):1875-1882.
[16] Park J,Kwak B K,Bae E,et al.Characterization of exposure to silver nanoparticles in a manufacturing facility[J].Journal of Nanoparticle Research,2009,11(7):1705-1712.
[17] Mitrano D M,Lesher E K,Bednar A,et al.Detecting nanoparticulate silver usingsingle-particle inductivelycoupledplasma-mass spectrometry[J].Environmental Toxicology and Chemistry,2012,31 (1):115-121.
[18] Alito C L,Gunsch C K.Assessing the effects of silver nanoparticles on biological nutrient removal in bench-scale activated sludge sequencing batch reactors[J].Environmental Science & Technology,2014,48(2):970-976.
[19] Liang Z,Das A,Hu Z.Bacterial response to a shock load of nanosilver in an activated sludge treatment system[J].Water Research,2010,44(18):5432-5438.
[20] Hou L,Li K,Ding Y,et al.Removal of silver nanoparticles in simulated wastewater treatment processes and its impact on COD and NH4+reduction[J].Chemosphere,2012,87(3):248-252.
[21] Zhang C,Liang Z,Hu Z.Bacterial response to a continuous long-term exposure of silver nanoparticles at sub-ppm silver concentrations in a membrane bioreactor activated sludge system[J].Water Research,2014,50:350-358.
[22] Wang Y,Westerhoff P,Hristovski K D.Fate and biological effects of silver,titanium dioxide,and C60(fullerene)nanomaterials during simulated wastewater treatment processes[J].Journal of Hazardous Materials,2012,201-202:16-22.
[23] Kim J Y,Lee C,Cho M,et al.Enhanced inactivation of E.coli and MS-2 phage by silver ions combined with UV-A and visible light irradiation[J].Water Research,2008,42(1):356-362.
[24] Yang Y,Wang J,iu Z,et al.Impacts of silver nanoparticles on cellular andtranscriptional activityof nitrogen-cyclingbacteria[J].Environmental Toxicology and Chemistry,2013,32(7):1488-1494.
[25] Fabrega J,Fawcett S R,Renshaw J C,et al.Silver nanoparticle impact on bacterial growth:Effect of pH,concentration,and organic matter[J].Environmental Science & Technology,2009,43(19):7285-7290.
[26] Yang Y,Li M,Michels C,et al.Differential sensitivity of nitrifying bacteria to silver nanoparticles in activated sludge[J].Environmental Toxicology and Chemistry,2014,33(10):2234-2239.
[27]张汝嘉.纳米银对硝化细菌以及SBR反应器中的活性污泥的抑制作用的研究[D].哈尔滨:哈尔滨工业大学,2010.
[28] Jeong E,Chae S,Kang S,et al.Effects of silver nanoparticles on biological nitrogen removal processes[J].Water Science & Technology,2012,65(7):1298-1303.
[29] Chen Y,Chen H,Zheng X,et al.The impacts of silver nanoparticles and silver ions on wastewater biological phosphorous removal and the mechanisms[J].Journal of Hazardous Materials,2012,239:88-94.
[30] Chen H,Zheng X,Chen Y,et al.Long-term performance of enhanced biological phosphorus removal with increasing concentrations of silver nanoparticles and ions[J].RSC Advances,2013,3(25):9835-9842.
[31] Sheng Z Y,Liu Y.Effects of silver nanoparticles on wastewater biofilms[J].Water Research,2011,45(18):6039-6050.
[32] Radniecki T S,Stankus D P,Neigh A,et al.Influence of liberated silver fromsilver nanoparticles on nitrification inhibition of Nitrosomonas europaea[J].Chemosphere,2011,85(1):43-49.
[33] Doolette C L,McLaughlin M J,Kirby J K,et al.Transformation of PVP coated silver nanoparticles in a simulated wastewater treatment process and the effect on microbial communities[J].Chemistry Central Journal,2013,7(1):1-18.
[34] Garcia A,Delgado L,Tora J A,et al.Effect of cerium dioxide,titanium dioxide,silver,and gold nanoparticles on the activity of microbial communities intended in wastewater treatment[J].Journal of Hazardous Materials,2012,199:64-72.
[35] Yang Y.Impact of metallic nanoparticles on anaerobic digestion[D].New York:University of Missouri–Columbia,2012.
[36] Gottschalk F,Sonderer T,Scholz R W,et al.Modeled environmental concentrations of engineered nanomaterials(TiO2,ZnO,Ag,CNT,fullerenes)for different regions[J].Environmental Science & Technology,2009,43(24):9216-9222.
[37] Yang Y,Chen Q,Wall J D,et al.Potential nanosilver impact on anaerobic digestion at moderate silver concentrations[J].Water Research,2012,46(4):1176-1184.
[38]施畅,徐丽明,邵安良.纳米银的毒理学研究现状[J].药物分析杂志,2013,33(12):2025-2033.
[39] Yang Y,Quensen J,Mathieu J,et al.Pyrosequencing reveals higher impact of silver nanoparticles than Ag+on the microbial community structure of activated sludge[J].Water Research,2014,48:317-25.
[40] Yuan Z,Li J,Cui L,et al.Interaction of silver nanoparticles with pure nitrifying bacteria[J].Chemosphere,2013,90(4):1404-1411.
[41] Choi O,Deng K K,Kim N J,et al.The inhibitory effects of silver nanoparticles,silver ions,and silver chloride colloids on microbial growth[J].Water Research,2008,42(12):3066-3074.
[42] Navarro E,Piccapietra F,Wagner B,et al.Toxicity of silver nanoparticles to Chlamydomonas reinhardtii[J].Environmental Science & Technology,2008,42(23):8959-8964.
[43] Xiu Z M,Ma J,Alvarez P J J.Differential effect of common ligands and molecular oxygen on antimicrobial activity of silver nanoparticles versus silver ions[J].Environmental Science & Technology,2011,45 (20):9003-9008.
[44] Ip M,Lui S L,Poon V K,et al.Antimicrobial activities of silver dressings:An in vitro comparison[J].Journal of Medical Microbiology,2006,55(1):59-63.
[45] Yin L,Cheng Y,Espinasse B,et al.More than the ions:The effects of silver nanoparticles on Lolium multiflorum[J].Environmental Science & Technology,2011,45(6):2360-2367.
[46] Morones J R,Elechiguerra J L,Camacho A,et al.The bactericidal effect of silver nanoparticles[J].Nanotechnology,2005,16(10):2346-2353.
[47] Pal S,Tak Y K,Song J M.Does the antibacterial activity of silver nanoparticles depend on the shape of the nanoparticle? A study of the gram-negativebacteriumEscherichiacoli[J].Appliedand Environmental Microbiology,2007,73(6):1712-1720.
[48] Arnaout C L,Gunsch C K.Impacts of silver nanoparticle coating on thenitrificationpotentialofNitrosomonaseuropaea[J].Environmental Science & Technology,2012,46(10):5387-5395.
[49] El Badawy A M,Silva R G,Morris B,et al.Surface charge-dependent toxicity of silver nanoparticles[J].Environmental Science & Technology,2011,45(1):283-287.
[50] Siripattanakul-Ratpukdi S,Ploychankul C,Limpiyakorn T,et al.Mitigation of nitrification inhibition by silver nanoparticles using cell entrapment technique[J].Journal of Nanoparticle Research,2014,16(2):2210-2227.
应用技术
综述与专论
Source of silver nanoparticles and its influence on sewage and sludge treatment
WU Lijuan,ZHENG Xiong,CHEN Yinguang
(State Key Laboratory of Pollution Control and Resource Reuse,School of Environmental Science and Engineering,Tongji University,Shanghai 200092,China)
Abstract:In recent years,the production and use of silver nanoparticles(AgNPs)has gradually increased,resulting in higher concentration of AgNPs in the environment.Material flow analysis shows that most of AgNPs in wastewater enter into wastewater treatment plants(WWTPs),and finally accumulate in the sludge.Due to the antibacterial property,AgNPs might have adverse effects on microorganisms involved in WWTPs.This paper comprehensively summarizes different sources of AgNPs in water systems(i.e.natural and artificial sources),potential risks to wastewater and sludge treatment facilities,such as the effects on removal efficiencies of carbon,nitrogen and phosphorus and anaerobic sludge digestion,and the underlying mechanisms of their toxicities to microorganisms involved in WWTPs.Finally,the development direction of this research field is also discussed.These results can provide a theoretical basis for further investigation of the potential risks of AgNPs to wastewater and sludge treatment systems.
Key words:nanomaterials;enviroment;pollution;nitrogen and phosphorus removal;sludge fermentation
基金项目:国家自然科学基金项目(41301558)。
收稿日期:2014-06-27;
DOI:10.16085/j.issn.1000-6613.2015.02.038
文章编号:1000–6613(2015)02–0542–08
文献标志码:A
中图分类号:X 703
修改稿日期:2014-08-27。

