细胞外基质蛋白介导膀胱癌化疗耐药的研究
潘春武 王伟明 刘建河 康健 刘海龙 齐隽 沈周俊
肌层非浸润性膀胱癌患者行经尿道膀胱肿瘤电切术后有着很高的复发率,部分原因是因为膀胱癌有多生发中心的特点,但另一个重要原因是肿瘤对术后的膀胱灌注化疗不敏感。以往对肿瘤化疗耐药的研究主要集中于肿瘤细胞本身,而对肿瘤微环境所扮演的角色关注甚少。近年来,肿瘤所处的细胞外基质(extracellular matrix,ECM)介导的化疗耐药(cell adhesion mediated drug resistance,CAMDR)概念的提出是化疗耐药领域重要进展之一[1-2]。膀胱癌中是否也存在CAM-DR及其机制尚不清楚。本研究通过检测ECM中的主要成分纤维连接蛋白(fibronectin,FN)与膀胱癌细胞黏附后,细胞出现的凋亡及细胞周期改变,以及涉及的信号通路,探讨膀胱癌中可能出现的CAM-DR及分子机制。
材料与方法
一、细胞培养
T24人膀胱癌细胞购自中国科学院,在含10%的胎牛血清的RPMI-1640培养液,37℃,5%CO2条件下培养。
二、药物处理
将对数生长期的T24细胞接种在6孔板中,分为4组(组A~D),每组3个复孔。除组A为对照组外,组B~D均用100μg/ml的丝裂霉素C(MMC,美国Calbiochem公司)处理。组C和D孔板底部预先用2μg/cm2的FN(美国GIBCO公司)4℃包被过夜。组D细胞在接受MMC处理前先用磷 脂 酰 肌 醇 3-激 酶 (PI3-K)特 异 性 抑 制 剂LY294002(50μmol/L,美国Calbiochem公司)预处理1h。
三、凋亡检测
Vybrant凋亡检测试剂盒(美国 Molecular Probes公司)用于细胞凋亡染色,该试剂盒包含Alexa Fluor 488Annexin V和100μg/ml的PI溶液。染色的细胞通过流式细胞仪(FCM,BD FACSCalibur System)和共聚焦显微镜(CLSM,Zeiss LSM510)检测。
四、细胞周期检测
细胞用63%乙醇4℃固定24h,冰PBS洗2次,PI/Triton X-100 染 色 液 (Sigma 公 司 )避 光37℃染色15min,FCM检测细胞周期变化。
五、比色法检测Caspase激活
Caspase-8和Caspase-9比色法检测试剂盒(美国Chemicon公司)用于检测Caspase-8和Caspase-9的激活。细胞经MMC分别处理0、6、12、24h后,裂解离心提取上清,利用上述试剂盒通过分光光度计(Anthos Zenyth 1100Spectrophotometer)分别读取吸光度,计算Caspase-8和Caspase-9的激活情况。
六、免疫荧光
生长在盖玻片上的T24细胞予以4%多聚甲醛固定,0.2% (v/v)Triton X-100打孔,5%的牛血清蛋白(BSA)4℃封闭1h,抗凋亡诱导因子(AIF)抗体(1∶100,美国Santa Cruz公司)4℃孵育过夜,Alexa Fluor 488标记的二抗(1∶400,美国Molecular Probes公司)4℃孵育1h。PI(1μg/ml,美国Molecular Probes公司)4℃避光染色15min。CLSM检测AIF核分布情况。
七、胞质蛋白及核蛋白提取
细胞质蛋白及核蛋白提取使用NucBuster Protein Extraction试剂盒(美国Novagen公司),严格按试剂盒说明操作。
八、蛋白印迹法
收集细胞裂解后,高速离心提取蛋白,SDSPAGE电泳后转移至PVDF膜,5%的BSA常温封闭2h后与一抗4℃孵育过夜。TBST洗膜3次后,与相应二抗常温孵育1h。TBST洗膜3次后,用增强化学发光底物(ECL,美国Millipore公司)显影。本研究采用的一抗包括抗AIF抗体(1∶200,Santa Cruz)、抗 Histone 1 抗 体 (1∶200,Santa Cruz)、抗 GSK-3β抗体(1∶1 000,Cell Signaling)、抗Phospho-GSK-3β-Ser9抗体(1∶1 000,Cell Signaling)、抗 Cyclin D1抗体(1∶2 000,Cell Signaling)、抗β-Tubulin抗体(1∶1 000,Sigma)、抗 β1-integrin抗体(1∶1 000,Cell Signaling)、抗 PI3-K抗体 (1∶1 000,Cell Signaling)、抗 Akt抗 体(1∶100,Cell Signaling)、抗 Phospho-Akt-Ser473抗体(1∶1 000,Cell Signaling)、抗β-Actin抗体(1∶10 000,Sigma)等。二抗包括 HRP标记的羊抗鼠IgG抗体(1∶10 000,Pierce)和 HRP标记的羊抗兔IgG抗体(1∶10 000,Pierce)。
八、统计学方法
所有计量数据以均数±标准差表示。统计学分析采用SPSS 11.5软件系统,多组计量指标比较采用多因素方差分析(ANOVA)。显著性水平α设为0.05。
结 果
一、FN拮抗了MMC诱导的T24细胞凋亡
MMC(100μg/ml)处理24h后,T24细胞予以Annexin V/PI双染后用CLSM及FCM分别检测。CLSM结果如图1A所示,MMC处理24h后,T24细胞出现明显凋亡,但与FN黏附的细胞凋亡受到显著抑制,而预处理LY294002则明显对抗了上述FN的作用。FCM结果与CLSM一致,见图1B。

图1 FN拮抗了MMC诱导的T24细胞凋亡
二、FN 抑制了 Caspase-9而非 Caspase-8凋亡途径的激活
我们研究了FN对两条经典凋亡途径Caspase-8和 Caspase-9的作 用。如图2A 所示,MMC(100μg/ml)处理6、12、24h,Caspase-8有轻度激活,但组B、C、D间差异无统计学意义(P>0.05)。相反,Caspase-9在组B、D显著升高,与对照组比较差异有统计学意义(P<0.05),但组C无明显激活,与组B、D比较差异有统计学意义(P<0.05)。
三、FN抑制了MMC诱导的AIF凋亡通路的激活
AIF是一条独立于Caspase途径的凋亡通路,当AIF转移至细胞核内即可直接引起细胞凋亡[3]。首先我们通过免疫荧光观察了各组细胞AIF核转位情况,如图2B所示,MMC处理后出现明显的AIF核转位,但与FN黏附后AIF核转位被抑制,而以LY294002预处理后的细胞仍然出现明显的AIF核转位。我们接着分离了各组细胞MMC处理后4个时间点的胞质蛋白与核蛋白,行蛋白印迹法检测。如图2C所示,组B细胞经MMC处理后6、12h,核内AIF表达显著增加,而组C细胞与FN黏附后,核内AIF表达无明显升高,组D细胞经LY294002预处理,核内AIF表达升高明显。各组细胞胞质AIF表达水平无明显变化。

图2 FN通过调节Caspase-9和AIF而非Caspase-8凋亡途径对抗MMC诱导的细胞凋亡
四、FN拮抗了MMC诱导的G1/S期停滞
我们通过FCM检测了细胞周期变化情况。如图3A所示,组B细胞经 MMC(100μg/ml)处理24h后,G0/G1期细胞出现明显累积,提示 MMC诱导了T24细胞G1/S期停滞。组C细胞与FN黏附后,G0/G1期细胞较组B细胞明显减少,提示MMC诱导的G1/S期停滞被FN拮抗,而组D细胞预处理LY294002后,FN的上述作用消失。
五、FN 通过 GSK-3β/Cyclin D1调控细胞周期改变
Cyclin D1是细胞G1期进入S期的关键调节因子,而Cyclin D1受 GSK-3β调节[4]。因此,我们检测了各组细胞 GSK-3β、p-GSK-3β、Cyclin D1的表达水平。如图3B所示,FN黏附后上调了p-GSK-3β水平进而稳定了Cyclin D1的表达,从而促使细胞进入S期,该作用可以被LY294002所拮抗。

图3 FN通过调控GSK-3β/Cyclin D1拮抗了MMC诱导的G1/S期停滞
六、FN介导的MMC耐药是PI3-K/Akt依赖的
T24细胞经 MMC(100μg/ml)处理24h后,蛋白印迹法检测β1-integrin、PI3-K、p-Akt、Akt,结果如图4A、B所示。FN与T24细胞黏附后,上调了PI3-K表达水平,进而磷酸化激活Akt。LY294002作为PI3-K特异性抑制剂,可以完全阻断FN诱导的PI3-K/Akt激活。β1-integrin,作为 FN 与细胞黏附的膜受体,其表达水平不受FN、MMC、LY294002影响。
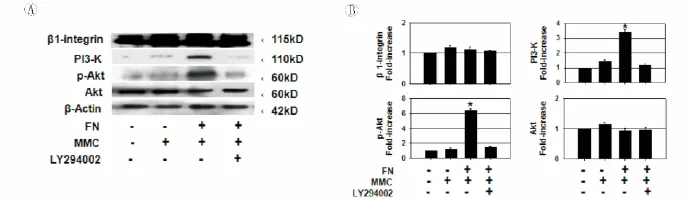
图4 FN介导的MMC耐药是PI3-K/Akt依赖的
讨 论
ECM蛋白保护肿瘤细胞免受化疗药物杀伤导致CAM-DR 已在 多 种 肿 瘤中 发 现[1-2],然而 ECM在膀胱癌化疗耐药中的作用尚不清楚。本研究证实,FN(一种ECM中的主要蛋白)与膀胱癌细胞黏附后显著抑制了MMC诱导的凋亡,这提示FN介导的肿瘤细胞保护作用在膀胱癌化疗耐药中起重要作用,也提示CAM-DR是一种在恶性肿瘤中广泛存在的现象。
目前认为存在两种Caspase依赖的经典凋亡途径:Caspases-8和 Caspases-9途径,Caspase-3是它们共同的执行Caspase。在小细胞肺癌的研究中发现,ECM通过抑制Caspase-3激活从而对抗化疗药物的杀伤,但未明确作用于哪条Caspase途径[5]。Estrugo等[6]在白血病的研究中发现,ECM蛋白通过抑制Caspases-8的激活导致肿瘤对阿糖胞苷及放疗的耐受。本研究发现FN与T24细胞黏附后显著抑制了 MMC激活的Caspase-9途径而非Caspase-8途径。
AIF是一条Caspase非依赖的凋亡途径,其从线粒体转移至细胞核内后可以直接引起DNA降解[3]。本研究发现,MMC可以诱导AIF入核,但FN可以显著抑制该过程。值得注意的是,Caspase-9和AIF都是线粒体功能紊乱所诱发的下游分子,因此,我们认为FN与T24细胞黏附后主要通过调节线粒体途径来抑制MMC诱导的凋亡。必须注意的是,本研究只使用了一种化疗药物作为研究工具,不同的化疗药物可能会有不同的凋亡途径,进一步的研究可以采用多种化疗药物及多种膀胱癌细胞进行更全面的研究。
影响肿瘤细胞周期的因素是引起耐药的另一个重要方面。有研究发现G1或G2期的周期停滞在CAM-DR中发挥重要作用[7-8]。本研究发现 FN 与T24细胞黏附后拮抗了 MMC诱导的G1/S期停滞。Cyclin D1诱导的有丝分裂是G1期向S期转换的重要事件,随着G1/S期转换的完成,GSK-3β表达增加导致Cyclin D1失活[4]。本研究进一步证实,FN 上调了p-GSK-3β水平导致 GSK-3β失活,从而稳定了Cyclin D1表达,最终促使肿瘤细胞跨越G0/G1停滞继续分裂增殖。因此,FN对细胞周期的调控也在T24细胞的CAM-DR中发挥重要作用。
以往的研究证实,ECM与细胞黏附后通过激活PI3-K/Akt信号通路从而抑制肿瘤细胞死亡[5,9]。Akt通常被Class 1A或Class 1B的PI3-K激活,但也有文献报道其可以PI3-K非依赖的形式激活[10-11]。本研究中,FN 上调了 PI3-K 及 p-Akt水平,且 Akt的 激 活 可 以 被 PI3-K 的 阻 滞 剂LY294002完全阻断。因此,在T24细胞中,FN对Akt信号的激活是PI3-K依赖的。Akt信号通路是目前认识到的最重要的促肿瘤信号通路。Akt可以磷酸化抑制BAD,也可以直接减弱Caspase-9的激活从而抑制凋亡[12-13]。Akt的另一个功能是抑制GSK-3的激活[14]。本研究结果与上述研究结果一致,在膀胱癌细胞中,FN介导的对Caspase-9及GSK-3β的抑制作用可以被LY294002所取消,因此FN的上述作用是PI3-K/Akt所依赖的。
总之,本研究表明,FN介导的PI3-K/Akt信号通路激活从而保护了膀胱癌细胞免受MMC的杀伤,该作用是通过抑制Caspase-9和AIF凋亡途径以及通过 GSK-3β/Cyclin D1通路促进了 G1/S的转换实现的。基于以上机制的阐明,阻断FN激活的信号通路可能是提高膀胱癌化疗效果的新策略。进一步的动物实验研究正在进行中。
[1] Damiano JS,Cress AE,Hazlehurst LA,et al.Cell adhesion mediated drug resistance(CAM-DR):role of integrins and resistance to apoptosis in human myeloma cell lines[J].Blood,1999,93(5):1658-1667.
[2] Sethi T,Rintoul RC,Moore SM,et al.Extracellular matrix proteins protect small cell lung cancer cells against apoptosis:a mechanism for small cell lung cancer growth and drug resistance in vivo[J].Nat Med,1999,5(6):662-668.
[3] Susin SA,Lorenzo HK,Zamzami N,et al.Molecular characterization of mitochondrial apoptosis-inducing factor[J].Nature,1999,397(6718):441-446.
[4] Diehl JA,Cheng M,Roussel MF,et al.Glycogen synthase kinase-3beta regulates Cyclin D1proteolysis and subcellular localization[J].Genes Dev,1998,12(22):3499-3511.
[5] Hodkinson PS,Elliott T,Wong WS,et al.ECM overrides DNA damage-induced cell cycle arrest and apoptosis in smallcell lung cancer cells through beta1integrin-dependent activation of PI3-kinase[J].Cell Death Differ,2006,13(10):1776-1788.
[6] Estrugo D,Fischer A,Hess F,et al.Ligand bound beta1integrins inhibit procaspase-8for mediating cell adhesion-mediated drug and radiation resistance in human leukemia cells[J].PLoS ONE,2007,2(3):e269.
[7] Hazlehurst LA,Damiano JS,Buyuksal I,et al.Adhesion to fibronectin via beta1integrins regulates p27kip1levels and contributes to cell adhesion mediated drug resistance(CAMDR)[J].Oncogene,2000,19(38):4319-4327.
[8] Cordes N,Blaese MA,Plasswilm L,et al.Fibronectin and laminin increase resistance to ionizing radiation and the cytotoxic drug Ukrain in human tumour and normal cells in vitro[J].Int J Radiat Biol,2003,79(9):709-720.
[9] Aoudjit F,Vuori K.Integrin signaling inhibits paclitaxel-induced apoptosis in breast cancer cells[J].Oncogene,2001,20(36):4995-5004.
[10] Sable CL,Filippa N,Hemmings B,et al.cAMP stimulates protein kinase B in a Wortmannin-insensitive manner[J].FEBS Lett,1997,409(2):253-257.
[11] Filippa N,Sable CL,Filloux C,et al.Mechanism of protein kinase B activation by cyclic AMP-dependent protein kinase[J].Mol Cell Biol,1999,19(7):4989-5000.
[12] Datta SR,Dudek H,Tao X,et al.Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.
[13] Cardone MH,Roy N,Stennicke HR,et al.Regulation of cell death protease caspase-9by phosphorylation[J].Science,1998,282(5392):1318-1321.
[14] Cross DA,Alessi DR,Cohen P,et al.Inhibition of glycogen synthase kinase-3by insulin mediated by protein kinase B[J].Nature,1995,378(6559):785-789.

