叔丁基对苯二酚激活骨髓间充质干细胞蛋白酶体活性延缓复制性衰老*
宋慧芳,杨佳超,牛晓洁,陆 利(山西医科大学人体解剖学教研室,山西太原030001)
叔丁基对苯二酚激活骨髓间充质干细胞蛋白酶体活性延缓复制性衰老*
宋慧芳,杨佳超,牛晓洁,陆利△
(山西医科大学人体解剖学教研室,山西太原030001)
[摘要]目的:探讨叔丁基对苯二酚(tert-butylhydroquinone,tBHQ)在延缓骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)复制性衰老进程中的作用,以期为细胞移植治疗提供数量充足的种子细胞。方法: 30 μmol/L tBHQ持续作用于体外传代晚期BMSCs 4周,化学发光法测量蛋白酶体活性; CCK-8法检测细胞活力; BrdU掺入实验检测细胞增殖能力;流式细胞术检测细胞周期分布;衰老相关β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal)染色检测衰老细胞百分比; Western blot检测衰老相关蛋白P53表达变化。结果: 30 μmol/L tBHQ持续作用于传代晚期BMSCs 4周后,蛋白酶体活性较DMSO溶剂对照组上调(21.96±1.98) % (P<0.05)。CCK-8法显示随tBHQ浓度增加,细胞活力逐渐升高,至40 μmol/L达到平台期,且至120 μmol/L未见明显细胞毒性。BrdU掺入实验显示tBHQ组阳性细胞率与DMSO溶剂对照组比较,细胞增殖能力显著提高(P<0.05) ; tBHQ组细胞增殖指数也显著高于DMSO组(P<0.05)。tBHQ组SA-β-Gal阳性率较DMSO溶剂对照组显著降低(P<0.01),且衰老相关蛋白P53表达量也较对照组下降(P<0.05)。结论: tBHQ能够通过提高蛋白酶体活性延缓因蛋白酶体功能障碍引起的BMSCs复制性衰老进程。
[关键词]叔丁基对苯二酚;骨髓间充质干细胞;复制性衰老
[修回日期]2015-04-07
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有易分离培养、扩增纯化、便于自体移植等特点,是医学组织工程理想的种子细胞[1-2]。分离获得的BMSCs数量有限,需体外扩增后用于移植治疗。然而,在扩增培养中BMSCs出现复制性衰老[3-4]。我们近期的研究结果提示,蛋白酶体功能障碍是诱发BMSCs复制性衰老的重要因素[5];过表达蛋白酶体功能亚单位PMSB5,提高蛋白酶体活性,能够延缓BMSCs衰老进程[6]。
叔丁基对苯二酚(tert-butylhydroquinone,tBHQ)是一种人工合成的酚类强抗氧化剂,常作为食品添加剂广泛应用于油脂食品中阻止食物油脂氧化变质。已有研究证明tBHQ可以通过激活Nrf2/ARE信号通路,促进蛋白酶体的组装与合成,提高蛋白酶体活性[7-9]。因此,本研究拟探讨tBHQ对BMSCs细胞活力的影响,寻求抑制细胞衰老进程的有效手段。
材料和方法
1 BMSCs的体外培养
BMSCs购于Science Cell Research Laboratory,用10% FBS-DMEM培养基(内含2 mmol/L L-谷氨酰胺,1×105U/L青霉素,1×105U/L链霉素)培养,细胞生长至90%融合时,0.25%胰酶(含0.02% EDTA)消化,1∶2传代。晚期BMSCs即体外扩增14代以上的细胞,已出现复制性衰老表型[5]。
2主要方法
2.1tBHQ干预实验30 μmol/L tBHQ持续作用于晚期BMSCs 4周,干预完成后即刻进行下游相关实验; DMSO组为同样浓度的溶剂对照组,持续作用4周。
2.2蛋白酶体活性测定Lysis buffer提取蛋白,BCA试剂盒测定蛋白浓度,APT280试剂盒(Millipore)测定20S蛋白酶体活性。具体实验步骤如下:避光96孔板中将30 μg蛋白与荧光底物混合至终体积100 μL,37℃避光孵育1.5 h,荧光光度计在380/460 nm处测定荧光强度反映蛋白酶体活性。
2.3CCK-8实验检测细胞增殖能力及细胞活力各组细胞以相同密度接种于96孔板(每孔2 000 个),细胞贴壁后按检测试剂盒操作,酶标仪检测450 nm处吸光度(A)值。
2.4BrdU掺入实验检测细胞增殖能力细胞贴壁后,用含有10 μmol/L BrdU的10% FBS-DMEM培养72 h,4%多聚甲醛室温固定20 min,2 mol/L盐酸37℃水浴作用10 min使DNA变性,而后小鼠抗BrdU I 抗(1∶100,ABtech) 4℃孵育过夜,山羊抗小鼠荧光II 抗(1∶100) 37℃避光孵育2 h,DAPI室温染核10 min,水溶性封片剂封片。Olympus荧光显微镜拍片、计数。
2.5碘化丙啶染色,流式细胞术观察BMSCs细胞周期分布和细胞增殖指数细胞生长至80%~90%融合时,0.25%胰酶消化,PBS清洗2次,弃上清,轻弹管壁使细胞团分散后,快速加入2 mL预冷的70%乙醇固定4 h,1 000 r/min室温离心5 min,PBS清洗1次,而后300目滤网过滤去除杂质,1 000 r/min室温离心5 min收集细胞,加入碘化丙啶工作液(50 mg/L碘化丙啶,10 mg/L RNase,1‰Triton X-100),室温避光孵育20 min,而后流式细胞仪检测G0/G1、S、G2/M各期细胞分布,计算细胞增殖指数(proliferative index,PI)。
2.6衰老相关β-半乳糖苷酶(senscence-associated β-galactosidase,SA-β-Gal)染色检测细胞衰老水平细胞接种于24孔板(每孔10 000),贴壁后按SA-β-Gal检测试剂盒流程操作,显微镜观察,计数,蓝色着色的细胞即为衰老细胞,计算衰老细胞阳性率反映细胞衰老水平。
2.7Western blotRIPA buffer提取蛋白,20 μg总蛋白经SDS电泳,转膜,封闭,杂交袋中I抗4℃孵育过夜,辣根过氧化物酶标记II抗37℃孵育2 h,按照ECL说明书显影曝光,ImageJ软件计算灰度值。
3统计学处理
采用SPSS 16.0统计软件进行分析,数值以均数±标准误(mean±SEM)表示,tBHQ干预组与DMSO溶剂对照组均数比较用两配对样本t检验,多组比较用单因素方差分析,组间两两比较用LSD法。以P<0.05为差异有统计学意义。
结果
1 tBHQ对晚期BMSCs蛋白酶体活性的影响
tBHQ 30 μmol/L持续作用于传代晚期的BMSCs 4周,化学发光法测量蛋白酶体活性结果显示,tBHQ组蛋白酶体活性上调21.96%±1.96%,与tBHQ溶剂对照组(DMSO组)比较,差异有统计学意义(P<0.05),提示tBHQ能够上调体外培养晚期骨髓间充质干细胞蛋白酶体活性,见图1。
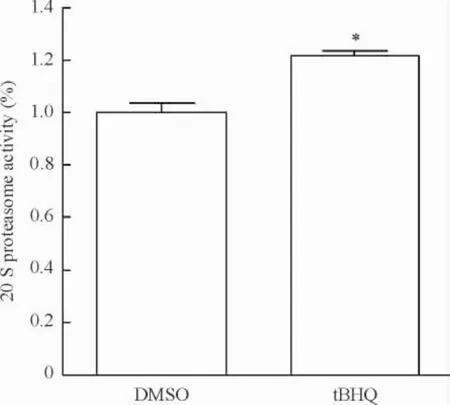
Figure 1.The effect of tBHQ on proteasome activity of the latestage BMSCs.Mean±SEM.n=4.*P<0.05 vs DMSO.图1 tBHQ对传代晚期BMSCs蛋白酶体活性的影响
2 tBHQ对传代晚期BMSCs细胞活力、增殖潜能及细胞周期分布的影响
2.1tBHQ对晚期BMSCs细胞活力的影响及其剂量依赖性CCK-8实验结果显示,随着tBHQ作用浓度增加(5 μmol/L~40 μmol/L),细胞活力和增殖能力逐渐增强,至40 μmol/L到达平台期并维持在较高水平。tBHQ浓度升高至120 μmol/L,仍未见细胞毒性反应,见图2。
2.2tBHQ对晚期BMSCs增殖能力的影响BrdU掺入实验显示,tBHQ作用于晚期BMSCs,其BrdU阳性率较DMSO溶剂对照组显著提高(P<0.05)。提示tBHQ可以增强晚期骨髓间充质干细胞的增殖能力,见图3。
2.3tBHQ对晚期BMSCs细胞周期的影响流式细胞术检测细胞周期分布,可见tBHQ组G0/G1期细胞较DMSO组减少,但S期和G2/M期细胞增多,细胞增殖指数较DMSO组显著提高9.93%±1.61% (P<0.05),见表1。
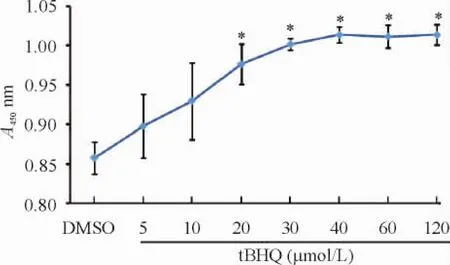
Figure 2.The CCK-8 assay indicated that tBHQ promoted the late-stage BMSCs viability in a concentration-dependent manner.Mean±SEM.n=3.*P<0.05 vs DMSO.图2 tBHQ对晚期BMSCs细胞活力的影响具有剂量依赖性
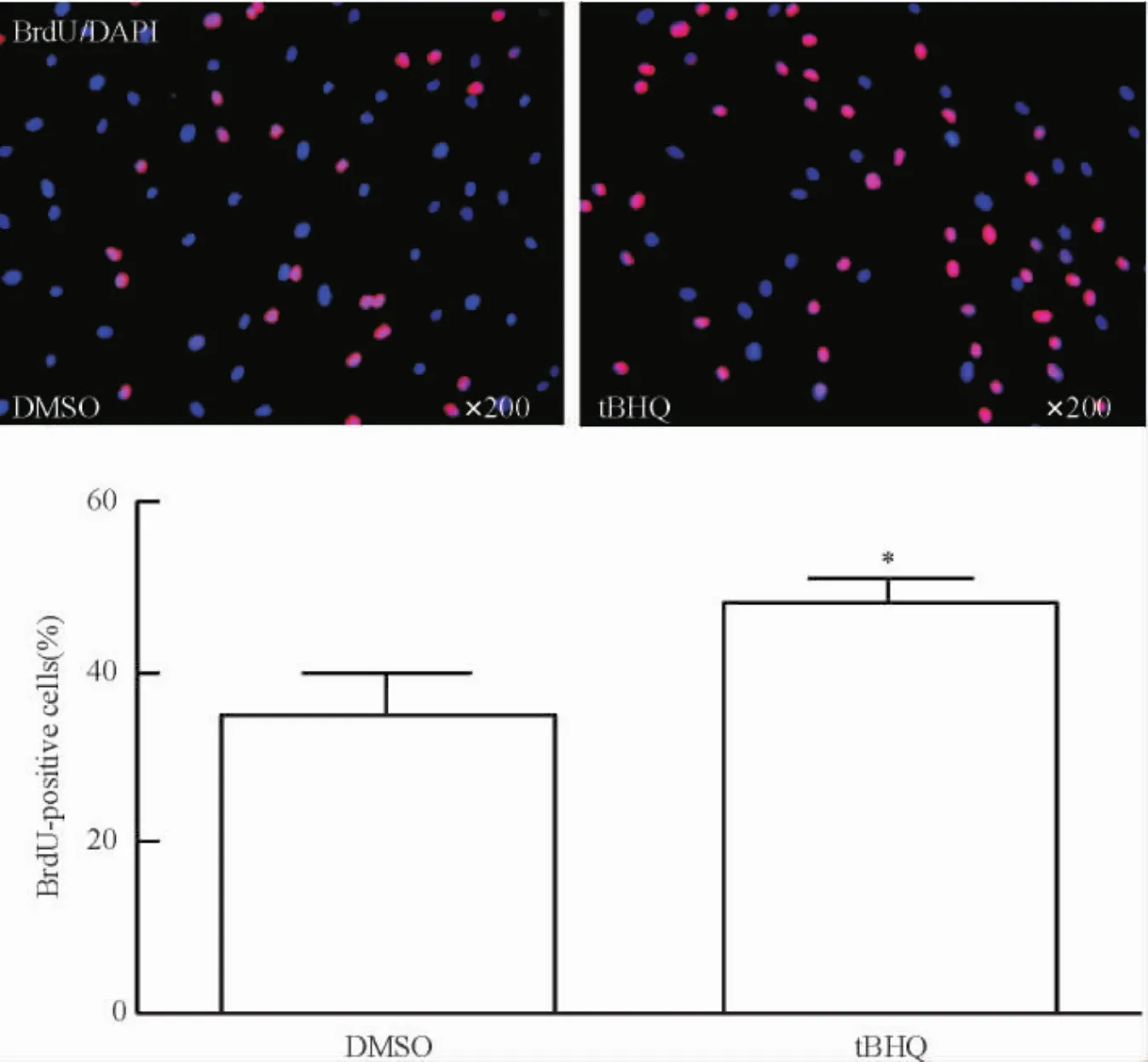
Figure 3.The effect of tBHQ on the proliferation of late-stage BMSCs by BrdU incorporation.Mean±SEM.n=15.*P<0.05 vs DMSO.图3 BrdU掺入法检测tBHQ对传代晚期hBMSCs增殖能力的影响

表1 流式细胞术检测晚期BMSCs细胞周期分布Table 1.Cell cycle distribution of late stage BMSCs tested by flow cytometry (%.Mean±SEM.n=3)
3 tBHQ对传代晚期BMSCs衰老表型的影响
3.1tBHQ对晚期BMSCs衰老相关β-半乳糖苷酶活性的影响SA-β-Gal染色结果显示,tBHQ作用于晚期BMSCs,其SA-β-Gal阳性率较DMSO溶剂对照组显著降低(P<0.01),见图4。
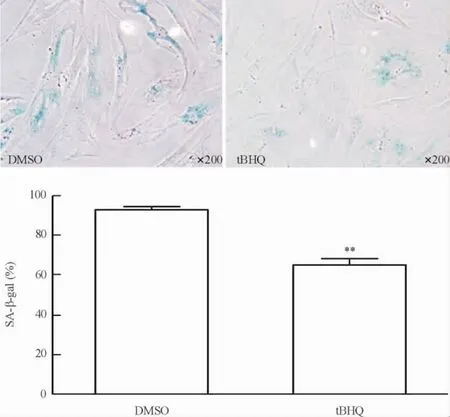
Figure 4.The effect of tBHQ on SA-β-Gal activity of the late-stage BMSCs.Mean±SEM.n=8.**P<0.01 vs DMSO.图4 tBHQ对晚期BMSCs衰老相关β-半乳糖苷酶活性的影响
3.2tBHQ对晚期BMSCs衰老相关蛋白P53表达的影响Western blot实验结果显示,tBHQ作用于晚期BMSCs,衰老相关蛋白P53的表达水平下降78.20%±8.18%,与DMSO溶剂对照组比较差异显著(P<0.05),见图5。
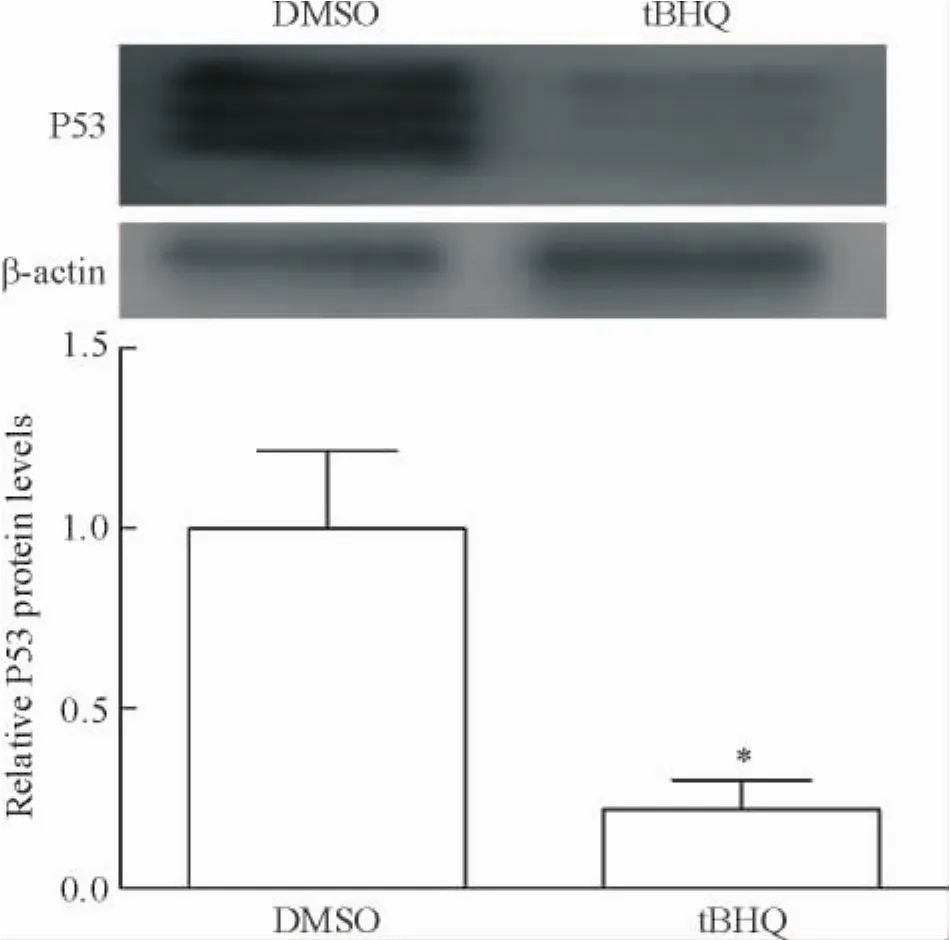
Figure 5.The effect of tBHQ on P53 expression in late-stage BMSCs.Mean±SEM.n=4.*P<0.05 vs DMSO.图5 tBHQ对晚期BMSCs P53表达的影响
讨论
干细胞具有修复受损组织、器官,重塑机体生物学功能的作用,因而在移植应用中具有广泛的前景。骨髓间充质干细胞是成体干细胞的一种,具有多向分化潜能,同时具有低免疫原性,易分离培养、扩增纯化,便于自体移植等优点,是细胞治疗和组织工程中理想的种子细胞,但其细胞数量的不足以及体外扩增中出现的复制性衰老及其伴随的干性下降是限制其临床应用的瓶颈[10-11],因而寻找有效的方法和靶点延缓骨髓间充质干细胞体外扩增中的复制性衰老进程是提高干细胞移植治疗疗效的关键,并可为其更广泛而有效的临床应用提供技术支撑。
已有研究显示,干细胞的复制性衰老可能与其在体外扩增过程中基因稳定性降低,端粒酶变短,氧化应激水平增高等多种因素有关,调节相应的ERK、MAPK、Akt等信号通路可以延缓干细胞复制性衰老进程[9,12-16]。本课题组前期研究结果显示,蛋白酶体功能障碍与BMSCs的复制性衰老过程密切相关,通过药物或转基因的方式提高蛋白酶体的表达量及其活性可能是延缓骨髓间充质干细胞复制性衰老的可能途径[5-6]。因而本文拟寻找提高蛋白酶体活性,同时又是比较安全的方式来达到延缓骨髓间充质干细胞复制性衰老。
tBHQ是一种人工合成的酚类强抗氧化剂,常作为食品添加剂广泛应用于油脂食品中以阻止食物油脂氧化变质。已有文献报道应用tBHQ能够通过激活Nrf2/ARE信号通路对抗氧化应激引起的神经干细胞死亡,对神经干细胞具有保护作用[8];而Nrf2/ARE信号通路的激活可以参与泛素-蛋白酶体通路的调节,促进蛋白酶体的组装与合成,提高蛋白酶体功能活性从而恢复成纤维细胞增殖活力[7]。我们将tBHQ作用于传代晚期的骨髓间充质干细胞,结果显示其可以通过提高蛋白酶体活性,进而提高细胞增殖能力和细胞活力;减少衰老细胞阳性率,降低P53蛋白的表达量。关于P53蛋白的表达,我们的前期实验结果[17]显示传代晚期BMSCs的P53表达水平较早期组显著增加,是复制性衰老的主要表型之一。可见tBHQ可以作用于体外培养传代晚期已出现复制性衰老的骨髓间充质干细胞,通过提高干细胞蛋白酶体活性,逆转或延缓骨髓间充质干细胞复制性衰老进程。这与Arlt等[9]在肿瘤细胞中观察到的应用tBHQ可通过激活Nrf2信号通路,提高蛋白酶体活性,从而起到抑制肿瘤细胞凋亡、提高其耐药性的研究结果一致。可见在多种不同类型的细胞中,tBHQ都具有细胞保护作用。同时我们观察到大剂量tBHQ干预下,骨髓间充质干细胞未出现毒性反应,而其又是一种常用的食品添加剂,提示tBHQ可以作为一种比较安全的干预手段,延缓因蛋白酶体功能障碍引起的晚期BMSCs复制性衰老进程,从而为细胞移植治疗和组织工程提供数量充足的种子细胞。
[参考文献]
[1]毕涌,洪娟,李力群,等.重组质粒pcDNA3-β-NGF的构建及其转染小鼠骨髓间充质干细胞生物学活性的研究[J].中国病理生理杂志,2013,29(11) : 2082-2087.
[2]华平,刘家良,杨淞然,等.慢病毒介导的caspase-3沉默对大鼠骨髓间充质干细胞增殖和凋亡的影响[J].中国病理生理杂志,2013,29(8) : 1502-1507.
[3]Chen D,Shen H,He Y,et al.Synergetic effects of hBMSCs and hPCs in osteogenic differentiation and their capacity in the repair of critical-sized femoral condyle defects[J].Mol Med Rep,2015,11(2) : 1111-1119.
[4]毛晨熙,陆地,孙成超.miR-193通过细胞周期相关蛋白调控大鼠骨髓间充质干细胞的增殖能力[J].中国病理生理杂志,2014,30(4) : 645-650.
[5]Lu L,Song HF,Zhang WG,et al.Potential role of 20S proteasome in maintaining stem cell integrity of human bone marrow stromal cells in prolonged culture expansion [J].Biochem Biophys Res Commun,2012,422 (1) : 121-127.
[6]Lu L,Song HF,Wei JL,et al.Ameliorating replicative senescence of human bone marrow stromal cells by PSMB5 overexpression[J].Biochem Biophys Res Commun,2014,443(4) : 1182-1188.
[7]Suzanne Kapeta,Niki Chondrogianni,Efstathios S.Gonos.Nuclear erythroid factor 2-mediated proteasome activation delays senescence in human fibroblasts[J].J Biol Chem,2010,285(11) : 8171-8184.
[8]Li J,Johnson D,Calkins M,et al.Stabilization of Nrf2 by tBHQ confers protection against oxidative stress-induced cell death in human neural stem cells[J].Toxicol Sci,2005,83(2) : 313-328.
[9]Arlt A,Sebens S,Krebs S,et al.Inhibition of the Nrf2 transcription factor by the alkaloid trigonelline renders pancreatic cancer cells more susceptible to apoptosis through decreased proteasomal gene expression and proteasome activity[J].Oncogene,2013,32(40) : 4825-4835.
[10]Yu KR,Lee JY,Kim HS,et al.A p38 MAPK-mediated alteration of COX-2/PGE2 regulates immunomodulatory properties in human mesenchymal stem cell aging[J].PLoS One,2014,9(8) : e102426.
[11]Jeoung JY,Nam HY,Kwak J,et al.A decline in Wnt3a signaling is necessary for mesenchymal stem cells to proceed to replicative senescence[J].Stem Cells Dev,2014,24(8) : 973-982.
[12]Ren J,Stroncek DF,Zhao Y,et al.Intra-subject variability in human bone marrow stromal cell (BMSC) replicative senescence: molecular changes associated with BMSC senescence[J].Stem Cell Res,2013,11(3) : 1060-1073.
[13]Tümpel S,Rudolph KL.The role of telomere shortening in somatic stem cells and tissue aging: lessons from telomerase model systems[J].Ann N Y Acad Sci,2012,1266: 28-39.
[14]Hao H,Chen G,Liu J,et al.Culturing on Wharton's jelly extract delays mesenchymal stem cell senescence through p53 and p16INK4a/pRb pathways[J].PLoS One,2013,8(3) : e58314.
[15]Estrada JC,Torres Y,Benguría A,et al.Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy[J].Cell Death Dis,2013,4: e691.
[16]Choi SH,Jung SY,Yoo SY,et al.Regulation of ROS-independent ERK signaling rescues replicative cellular senescence in ex vivo expanded human c-kit-positive cardiac progenitor cells[J].Int J Cardiol,2013,169(1) : 73-82.
[17]刘雪芹,宋慧芳,陆利.蛋白酶体功能障碍通过激活P53抑制人骨髓间充质干细胞增殖[J].中国病理生理杂志,2012,28(12) : 2250-2253.
(责任编辑:卢萍,余小慧)
tBHQ delayed replicative senescence by activating the proteasome system of BMSCs
SONG Hui-fang,YANG Jia-chao,NIU Xiao-jie,LU Li
(Department of Anatomy,Shanxi Medical University,Taiyuan 030001,China.E-mail: luli7300@126.com )
[ABSTRACT]AIM: To investigate the effect of tert-butylhydroquinone (tBHQ) on the replicative senescence of bone marrow mesenchymal stem cells (BMSCs).METHODS: Late stage BMSCs were continuously treated with tBHQ at concentration of 30 μmol/L for 4 weeks and the cells were used for the following assays immediately.The proteasomal activity was determined by chemiluminescence method.The samples were subjected to CCK-8 assay and BrdU incorporation as well as flow cytometry analysis for analyzing the cell vitality and proliferation.Percentage of senescent cells was detected by senescence-associated β-galactosidase (SA-β-Gal) staining.The expression of P53 was measured by Western blot.RESULTS: After the continuous treatment of tBHQ (30 μmol/L) for 4 weeks,the proteasomal activity of late stage BMSCs increased by 21.96%±1.98% (P<0.05).The cell vitality and survival were significantly increased with the increases in tBHQ doses till 40 μmol/L,and no cytotoxicity reaction with the increased dose of tBHQ till 120 μmol/L was observed.BrdU-positive cells,which represented the cell proliferation,were significantly increased (P<0.05).The proliferation index was also significantly increased by flow cytometry analysis (P<0.05).The SA-β-Gal positive cells and the expression of P53 were decreased (P<0.05).CONCLUSION: tBHQ delays the proteasome dysfunction associated senescence progress of BMSCs by increasing the proteasomal activity.
[KEY WORDS]Tert-butylhydroquinone; Bone marrow mesenchymal stem cells; Replicative senescence
通讯作者△Tel: 0351-4135787; E-mail: luli7300@126.com
*[基金项目]国家自然科学基金资助项目(No.81200254) ;山西省回国留学人员科研资助项目(No.2014-033)
[收稿日期]2015-02-09
[文章编号]1000-4718(2015)09-1647-05
[中图分类号]R339.3+8; R363.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.021

