儿童急性淋巴细胞白血病微小残留病的RQ-PCR检测分析
刘志强,柯江维,乐萍,段荣
(江西省儿童医院检验科,江西 南昌330006)
近几年,随着多药联合强化治疗的实施,儿童急性淋巴细胞白血病 (acute lymphoblastic leukaemia,ALL)的长期无病存活率明显提高,部分发达国家已达90%[1],但仍有患儿复发死亡。如何防止复发、避免不必要的过度化疗一直是儿科血液肿瘤研究者期待解决的问题。近年来大量相关研究提出,ALL复发的主要原因之一是白血病诱导化疗完全缓解后,在体内残留微量白血病细胞,即微小残留病变(minimal residual disease,MRD)[2]。 目前适合MRD检测的方法只有聚合酶链反应(polymerase chain reaction,PCR)和流式细胞术(flow cytometry,FCM)[3]。本研究应用实时定量PCR(realtime quantitative PCR,RQ-PCR),对 153例 ALL患儿化疗前、诱导化疗结束及强化治疗末期骨髓样本的MRD进行监测,以评估其在预测复发、指导个体化治疗方面的应用价值。
1 资料与方法
1.1 研究对象 收集2010年3月-2014年6月期间江西省儿童医院血液科病房收治的376例急性淋巴细胞白血病患儿资料,其中男151例,女225例,中位年龄5.4岁(1.6月~14岁)。所有患儿均经细胞形态学-免疫学-细胞遗传学-分子遗传学(MICM)进行诊断及分型。从诱导化疗结束为完全缓解后开始列入随访,平均随访时间28月(10~41月)。
1.2 治疗方案 按2006年中华医学会儿科学分会血液学组儿童ALL诊疗建议(第三次修订草案)[4]及2010年全国儿童ALL临床路径方案进行治疗。以诱导化疗结束骨髓涂片检查时原幼淋巴细胞<5%为骨髓完全缓解。化疗前均已征得患儿家属的知情同意。
1.3 标本采集 分别于治疗前、诱导化疗结束后、强化治疗后抽取骨髓肝素抗凝标本2ml。
1.4 融合基因检测
1.4.1 总RNA提取 将抽取的骨髓标本经Ficoll Hypaque淋巴细胞分离液密度梯度离心分离单个核细胞。用RNA Isolation Kit(Promega SV Total RNA Isolation System购自美国Promega公司)提取总RNA。
1.4.2 cDNA合成 反转录的反应体系(试剂购自大连宝生物有限责任公司):(1)5×Prime ScriptTMBuffer(for Real Time)2μl;(2)Prime ScriptTMRT Enzyme MixⅠ0.5μl;(3)Oligo(dT)Primer(50μmol·L-1)0.5μl;(4)Random 6 mers(100μmol·L-1)2μl;(5)Total RNA 1μg;(6)RNase Free双蒸水 (dH2O)补充至反应体系10μl。 反应条件:37℃ 15 min,85 ℃ 5s。cDNA 产物置于-70℃冰箱保存备用。
1.4.3 引物设计和合成 各融合基因及ABL内参基因的引物及探针均选用欧洲抗癌项目组公布的序列。引物及探针均由大连宝生物工程有限公司合成。各融合基因的引物序列见表1。
1.4.4 qRT-PCR反应实验采用TaqMan探针法,在荧光定量PCR仪(ABI PRISM 7500)上检测,同时扩增内参ABL,每个标本做2个复孔。定量PCR反应体系采用 “白血病相关融合基因检测试剂盒(ALL 9种)(核酸扩增荧光定量法)(上海源奇生物医药科技有限公司)。

表1 RQ-PCR引物序列
2 结果
2.1 TEL/AML1、BCR/ABL、E2A/PBX1、MLL/AF4 四种融合基因的检测 所有标本均经RQ-PCR检测,每例标本最多只存在1种异常融合基因。376例ALL患儿中融合基因阳性共153例,其中TEL/AML1阳性 91例 (24.2%),BCR/ABL阳性 26例(6.9%),E2A/PBX1 阳性 27(7.2%),MLL/AF4 阳性 9(2.4%)。
2.2 治疗反应及疗效观察 在不同时期对融合基因阳性儿童进行监测,详见表2。TEL/AML1阳性组诱导化疗结束有13(14.3%)例融合基因未转阴,强化治疗末仍有2(2.2%)例融合基因未转阴,随访期间无复发;BCR/ABL阳性组诱导化疗结束有19(73.1%)例融合基因未转阴,强化治疗末仍有9(34.6%)例融合基因未转阴,随访中有5例(19.2%)复发,2(7.7%)例死亡;E2A/PBX1阳性组诱导化疗结束有8(29.6%)例融合基因未转阴,强化治疗期末仍有4(14.8%)例融合基因未转阴,随访中1例(3.7%)复发;MLL/AF4阳性组诱导化疗结束有6(66.7%)例融合基因未转阴,强化治疗末仍有3(33.3%)例融合基因未转阴,随访中有2例(22.2%)复发,1(11.1%)例死亡。见表2。
3 讨论
MRD是指白血病患者经诱导缓解治疗达到临床缓解后,其体内残存的用形态学方法无法检出的微量白血病细胞,这些残存的白血病细胞是患者复发的根源[5]。MRD检测有较高的敏感性,为治疗效果的评估提供了更加直接、客观的依据。目前以MRD风险评估为基础的治疗方案的临床试验表明,以MRD为指导的治疗可能成为今后ALL的治疗标准[6]。
以PCR方法检测白血病融合基因是目前常用的MRD检测方法,敏感度可达10-6数量级。以融合基因作为标志物的优点是初发时所检测到的融合基因在治疗过程中不会发生进一步的改变,可以在不同时间点进行监测[7]。TEL/AML1、BCR/ABL、E2A/PBX1、MLL/AF4 是 ALL 中最常见的四种融合基因,已经成为儿童ALL从诊断到治疗的常用的检测项目。
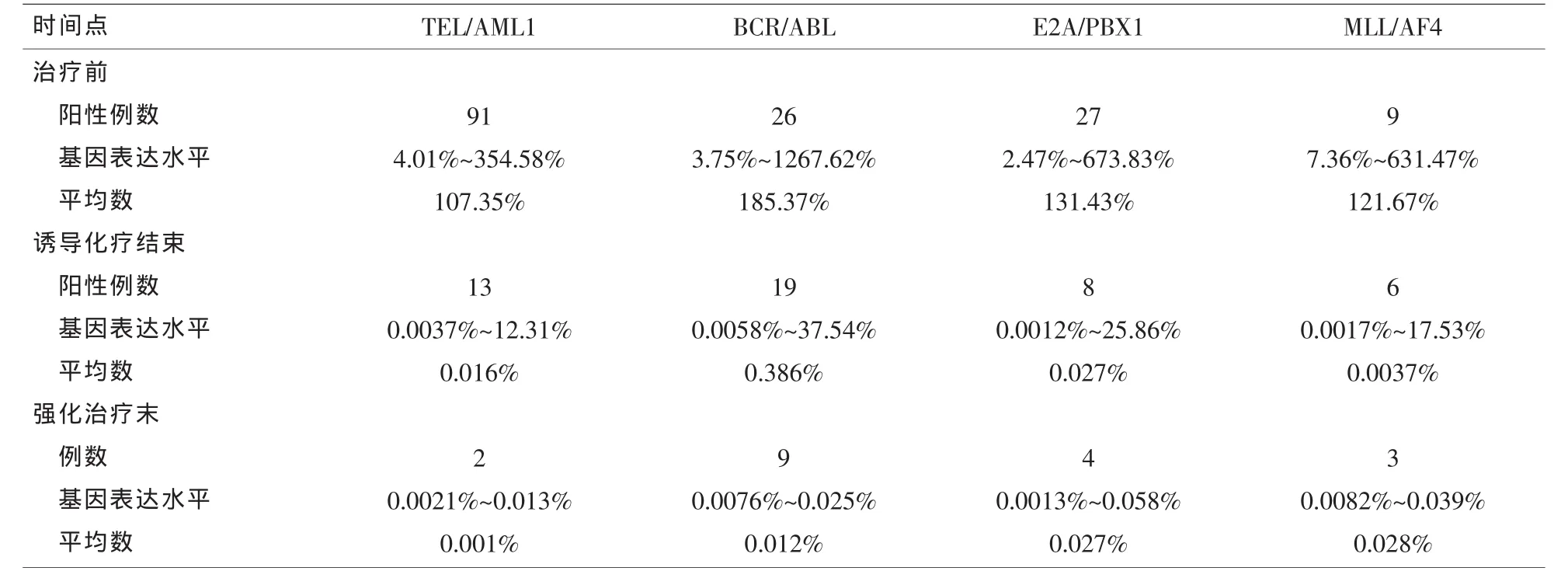
表2 各组患儿的治疗反应
急性淋巴细胞白血病患儿体内t(12;21)染色体结构异常,将导致12p12的TEL基因与21q22的AML基因发生融合,最终形成TEL-AML1融合基因。TEL-AML1是儿童ALL中最常见的融合基因。在我院儿童ALL的样本研究中,TEL-AML1融合基因阳性患儿占24.2%,这与其他研究中心的结果接近[8]。大多数研究认为,TEL/AML1阳性是儿童ALL预后好的标志[9],史利欢等[10]最近的研究指出,TEL/AML1阳性儿童ALL临床总有效率高于TEL/AML1阴性儿童ALL。本研究中发现大多数TEL/AML1阳性患儿对化疗敏感度高,CR期长,前期随访无复发。
9号染色体和22号染色体易位形成的BCR/ABL融合基因是慢性髓系白血病的特征性标志,在儿童ALL中的阳性仅有3%~5%[11],我院儿童ALL的样本研究中,BCR/ABL融合基因阳性患儿占6.9%,比例偏高,与Na等[12]相近。BCR/ABL融合基因阳性ALL是一类高度异质恶性疾病,该类疾病容易合并中枢神经系统白血病,缓解率低,复发率高,预后极差,BCR/ABL融合基因阳性的ALL患者中位生存期为6~10个月[13]。本研究中BCR/ABL融合基因阳性患儿在诱导化疗结束有73.1%未转阴,强化治疗末仍有34.6%未转阴,且随访中有19.2%的患儿复发,7.7%的患儿死亡,与文献报道相符。
儿童ALL中t(1;19)(q23;p13)易位,即19p13的E2A和1q23上的PBX1易位融合,形成E2A/PBX1融合基因,比例约为5%[14]。在我院儿童ALL的样本研究中,E2A/PBX1融合基因阳性患儿占7.1%,比文献偏高,可能是样本量偏少所致。已往认为,该融合基因阳性ALL患儿对化疗的反应差,且预后不佳,近年来通过对化疗强度的提高,预后得到了明显改善[15],本研究亦证实E2A/PBX1融合基因阳性患儿化疗敏感性较高,早期复发率低。
混合谱系白血病MLL基因位于11q23,MLL基因重排是造血系统恶性肿瘤中常见的遗传学改变,在儿童ALL中发生率约为 6%[16],目前发现MLL基因易位重排类型有60多种,其最常见的是MLL/AF4。过去研究发现此类ALL大多恶性程度高,常规化疗反应差,生存期短[17],孙豫兰等[18]研究发现,MLL-AF4融合基因阳性患儿完全缓解率和5年EFS都显著低于非MLL-AF4患儿。本研究亦证实MLL-AF4融合基因阳性患儿化疗敏感性低,早期复发率高22.2%。
遗传学异常在儿童ALL中有很强的预后因素。不同类型白血病可有不同的融合基因,同一种类型白血病具有不同的融合基因,其疗效和预后亦不相同。实时荧光定量PCR技术可以有效地检测出白血病常见融合基因并进行定量分析,为指导治疗、判断预后提供重要依据,尤其是检测MRD水平的应用,对临床白血病患者的个体化治疗发挥越来越重要的作用。随着全基因组扫描技术的广泛应用,将可能为MRD检测发现更多的遗传标志,服务于临床。此外,近十年提出残留的白血病干细胞(leukemia stem cells,LSCs)是疾病复发的根源[19],分子生物学技术在白血病化疗后监测中的运用将更为广泛,地位将更为突出。
[1]Irving J,Jesson J,Virgo P,et al.Establishment and validation of a standard protocol for the detection of minimal residual disease in B lineage childhood acute lymphoblastic leukemia by flow cytometryin a multicenter setting[J].Haematologica,2009,94(6):870-874.
[2]Campana D.Minimal residual disease monitoring in childhood acute lymphoblastic leukemia[J].Curr Opin Hematol,2012,19(4):313-318.
[3]Coustan-Smith E,Campana D.Immunologic minimal residual disease detection in acute lymphoblastic leukemia:a comparative approach to molecular testing[J].Best Pract Res Clin Haematol,2010,23(3):347-358.
[4]中华医学会儿科学分会血液组.中华儿科杂志编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J].中华儿科杂志,2006,44(5):392-395.
[5]徐翀,何妙侠,郑建明.儿童急性淋巴细胞白血病微小残留病检测及其进展[J].医学检验,2013,28(4):342-347.
[6]Pui CH,Campana D,Pei D,et al.Treating childhood acute lymphoblastic leukemia without cranial irradiation[J].N Engl J Med,2009,360(26):2730-2741.
[7]Hong D,Gupta R,Ancliff P,et al.Initiating and cancer-propagating cells in TEL-AML1-associated childhood leukemia[J].Science,2008,319(5861):336-339.
[8]Teachey DT,Hunger SP.Predicting relapse risk in childhood acute lymphoblastic leukemia[J].Br JHaematol,2013,162(5):606-620.
[9]Gao C,Zhao XX,Li WJ,et al.Clinical features,early treatment responses,and out-comes of pediatric acute lymphoblastic leukemia in china with or without specific fusion transcripts:A single institutional study of 1,004 patients[J].Am J Hematol,2012,87(11):1022-1027.
[10]史利欢,郭明发.儿童急性淋巴细胞白血病与TEL-AML1融合基因关联分析[J].中国实用医药,2014,9(17):78-79.
[11]Thomas D.Childhood Philadelphia chromosome-positive B lymphoblastic leukaemia[J].Lancet Oncol,2012,13(9):860-863.
[12]Na IK,Kreuzer KA,Lupberger J,et al.Quantitative RT-PCR of Wilms tumor gene transcripts(WT1)for the molecular monitoring of patients with accelerated phase bcr/abl+CML[J].Leuk Res,2005,29(3):343-345.
[13]鲍立,江滨,黄晓军,等.Ph阳性急性淋巴细胞白血病的临床研究[J].中华血液学杂志,2005,26(1):31-34.
[14]Kager L,Lion T,Attarbaschi A,et al.Incidence and out-come of TCF3-PBX1-positive acute lymphoblastic leukemia in Austrian children[J].Haematologica,2007,92(11):1561-1564.
[15]Pui CH,Sandlund JT,Pei D,et al.Results of therapy for acute lymphoblastic leuke-mia in black and white children[J].JAMA,2003,290(15):2001-2007.
[16]Chowdhury T,Brady HJ.Insights from clinical studies into the role of the MLL gene in infant and childhood leukemia[J].Blood Cells Mol Dis,2008,40(2):192-199.
[17]Smith E,Lin C,Shilatifard A.The super elongation complex(SEC)and MLL in development and disease[J].Genes Dev,2011,25(7):661-672.
[18]孙豫兰,何海龙,赵文理,等.58例MLL基因重排阳性儿童急性淋巴细胞性白血病临床分析 [J].中国小儿血液与肿瘤杂志,2013,18,(3):103-106.
[19]蔡壬辛,洪旭灿,张轩,等.血液肿瘤CD44基因检测及4亚型克隆原核表达[J].实验与检验医学,2015,33(1):7-10.

