共伴侣蛋白FKBP51在高脂诱导肥胖中的作用
张 曼,邱 彬,曹 勇,徐玉雪,邓 然,杨志伟,雍伟东
(北京协和医学院&中国医学科院医学实验动物研究所,基因与发育实验室,北京 100021)
共伴侣蛋白FKBP51在高脂诱导肥胖中的作用
张 曼,邱 彬,曹 勇,徐玉雪,邓 然,杨志伟,雍伟东
(北京协和医学院&中国医学科院医学实验动物研究所,基因与发育实验室,北京 100021)
目的通过FKBP51基因敲除小鼠模型和细胞脂肪分化模型,探究FKBP51在高脂诱导肥胖中的机制。方法 4周龄雄性野生型和FKBP51基因敲除小鼠以普通或高脂饲料单只单笼喂养6周,每周记录小鼠体重和饮食量,应用MM-100代谢笼系统,监测各组小鼠24 h内氧气消耗量、二氧化碳产生量、呼吸交换率和产热量的变化,对上述小鼠肝脏组织进行油红O染色,同时检测肝脏和脂肪组织代谢相关基因的表达情况。同时对取自野生型和FKBP51基因敲除小鼠的永生化成纤维细胞(MEF)进行脂肪诱导分化,观察FKBP51缺失对脂肪分化的影响。结果高脂饮食诱导后,两种基因型小鼠饮食量无明显变化,但与野生型小鼠相比,FKBP51基因敲除小鼠体重明显减轻,肝脏中脂滴减少。FKBP51基因敲除小鼠在基础和高脂诱导条件下,氧气消耗量、二氧化碳产生量、呼吸交换率以及产热量均高于野生型小鼠,肝脏中糖异生相关酶PEPCK、G6Pase等表达上调,脂肪中能量代谢相关基因UCP-1等表达上调。此外,FKBP51基因缺失的MEF诱导脂肪分化,细胞内脂滴明显少于野生型MEF细胞。结论 FKBP51基因在脂肪合成和能量代谢方面起着重要作用,因此FKBP51基因缺失小鼠能够抵制高脂诱导的肥胖。
FKBP51;能量代谢;脂肪分化;肥胖
糖皮质激素受体(GR)是甾体激素受体超家族中的一员,其为配体依赖性转录因子,可介导糖皮质激素的功能。GR功能的发挥需要与Hsp90等伴侣蛋白、以及共伴侣蛋白结合形成蛋白复合体[1],FKBP51作为TPR蛋白之一,对GR活性起着负调节的作用[2]。
在脂肪细胞中,GR活性是脂肪细胞分化所必需的,对脂肪的胰岛素敏感性发挥着重要作用,同时调节脂质的代谢[3-4]。有研究发现[5],在脂肪生成中,GR复合物的共伴侣分子FKBP51/FKBP52发挥重要作用。且研究表明,小鼠下丘脑中高表达的FKBP51能够抑制糖皮质激素受体的作用,促进肥胖的表型,即下丘脑中FKBP51通过对糖皮质激素受体的调节,在能量调节平衡中发挥作用[6]。以上证据表明FKBP51在肥胖形成和脂肪分化中可能具有重要的作用,本研究通过给予FKBP51基因敲除小鼠和野生对照小鼠高脂饮食,以及体外细胞脂肪诱导分化实验,从能量代谢和脂肪生成两个方面研究FKBP51基因在高脂诱导肥胖中的作用。
1 材料和方法
1.1 实验动物
FKBP51基因敲除小鼠为本实验室保存,清洁级C57BL/6J小鼠购自于北京华阜康生物科技有限公司【SCYK(京)2014-0004】,动物饲养于中国医学科学院医学实验动物研究所屏蔽环境【SYXK(京) 2013-0004】,温度(20~26)℃,饲养期间给予灭菌饲料及纯净水。实验共分为四组,每组约6~8只,正常饮食的雄性FKBP51基因敲除小鼠(RDKO,51-/-)、正常饮食的雄性C57BL/6J小鼠(RDWT,51+/+)、高脂饮食的雄性FKBP51基因敲除小鼠(HFKO,51-/-)、高脂饮食的雄性C57BL/6J小鼠(HFWT,51+/+)。
1.2 试剂与仪器
高脂 饲 料 (60 kcal% fat,D12492,美 国REASERCH DIETS)、SYBR Green PCR Master Mix (Takara)、地塞米松(DEX,sigma)、IBMX(sigma)、胰岛素(sigma)、完整的代谢监测设备(MM-100系统(CWE)、MMX扩张单元、气泵和计算机运行系统)、冰冻切片机(德国Leica)、Realtime PCR仪(A/B)。
1.3 体重和摄食的测量
对小鼠的体重和摄食量进行测量,在RDKO、RDWT、HFKO与HFWT小鼠4周龄时开始分别进行正常饮食和高脂诱导,单只分笼饲养,每周记录一次小鼠的体重和高脂诱导小鼠的饮食量,记录到10周龄。
1.4 小鼠能量代谢监测
调节MM-100代谢检测仪气道的通气量,待其达到平稳值,通道气量至约650 mL/min(小鼠)即可,300 s后即进入下一通道通气量的调节。动物称重、记录编号,放入代谢笼扩张单元盒中,确定动物盒盖密闭好,动物及仪器气流平衡约1~4 h。打开能量检测系统软件CWE-MMcomm,设置参数,录入各通道动物体重,点击开始即开始记录数据了。中途需要及时的观察小鼠的状态和数据的稳定性。对其进行24 h的检测,其中12 h照明/12 h黑暗,与其饲养环境保持一致。测量数据以标准ASCII格式保存在磁盘文件。
1.5 肝脏组织油红O染色
取高脂诱导的6周后的小鼠肝脏,并以正常饮食的同周龄的小鼠作为对照,即取四组小鼠的肝脏:正常饮食(RDWT/RDKO)和高脂饮食(HFWT/ HFKO)。取1×1×0.5cm肝脏进行常规冰冻切片,油红O染色。油红O染色由中国医学科学院医学实验动物研究所病理科完成。
1.6 MEF细胞诱导脂肪分化实验
将永生化的51 WT和KO MEF细胞接种于培养板中,待细胞长至80% ~90%时,继续接触抑制培养两天(记为第-2天)。2 d后(记为第0天)更换为含10%胎牛血清的DMEM,并加入终浓度为0.5 mmol/L的IBMX、1 μmol/L的DEX和10 μmol/ mL的Insulin。培养48 h后(记为第2天)更换为只含有10%胎牛血清和胰岛素(浓度同上)的DMEM培养基。之后每2天(分别记为第4和6天)再以10%胎牛血清的DMEM培养基换液一次。细胞诱导分化第8天即可有90%细胞呈成熟脂肪细胞表型,第8天的细胞进行油红O染色,在光学显微镜下观察其分化程度的不同。
1.7 Realtime PCR测定
分别提取RDKO、RDWT、HFKO与HFWT四组小鼠肝脏组织和脂肪组织的RNA,定量,逆转录为cDNA,采用半定量法检测相关基因mRNA的表达水平。
1.8 统计分析
资料数据以平均值±标准差表示,实验数据采用PRISM统计软件进行分析,组间比较采用单因素方差分析t检验。其中P<0.05,表明差异有统计学意义,用* 或#表示;P<0.01表明差异有显著统计学意义,用**或##表示。
2 结果
2.1 FKBP51基因敲除小鼠抵制高脂诱导的肥胖
小鼠体重测定结果如表1所示,在正常饮食6周后,野生型小鼠体重达到26.2±0.7g(RD WT),FKBP51基因敲除小鼠体重为23.5±1.8 g(RD KO);高脂诱导后,野生型小鼠体重达到39.03± 0.84g(HF WT),而FKBP51基因敲除小鼠体重仅为25.69±1.53g(HF KO),相差约10 g左右,有显著性差异(P<0.01)。从上述结果可以看出,在高脂喂养6周后,FKBP51基因敲除小鼠体重明显小于野生型小鼠,抵制高脂诱导的肥胖。
2.2 高脂诱导的FKBP51基因敲除小鼠体重变化与饮食量无关
体重的变化与摄食量有关,为排除食物摄入量对小鼠体重变化的影响,我们对HF WT和HF KO小鼠4~10周的摄食量进行了统计分析。结果如表2所示,两种基因型小鼠的摄食量总体上没有明显差异(P>0.99),说明FKBP51基因敲除小鼠出现抵制高脂诱导肥胖的表型与摄食量无关。
2.3 FKBP51基因敲除小鼠具有较高的能量代谢
(1)FKBP51基因敲除小鼠具有较高的基础能量代谢
对正常饮食小鼠的呼吸代谢测定结果如图1所示,FKBP51基因敲除小鼠氧气的平均消耗量为白天2.49±0.1(mL/h/g)、晚上2.79±0.1(m×/ h/g),均明显高于野生型小鼠白天(2.3 ±0.1 m ×/h/g,P值)和晚上(2.37±0.11 m×/h/g)的平均耗氧量(图 1.A),(P < 0.05,P < 0.01); FKBP51基因敲除小鼠白天二氧化碳产量(2.1± 0.1 mL/h/g)与野生型小鼠(2.0±0.1 mL/h/g)没有差别(P>0.05),而夜间二氧化碳产量(2.7± 0.1 mL/h/g)明显高于野生型小鼠(2.3±0.1 mL/ h/g)(P<0.01,图1.B);此外FKBP51基因敲除小鼠白天(12.1 ±0.3 cal/h/g)和夜间(13.7 ± 0.4 cal/h/g)热量的产生也高于野生型小鼠白天(11.1±0.5 cal/h/g,P <0.05)和夜间(11.6 ± 0.5 cal/h/g,P<0.01)的产热量(图1C)。这些结果表明,正常饮食条件下,FKBP51基因敲除小鼠具有较高基础能量代谢。
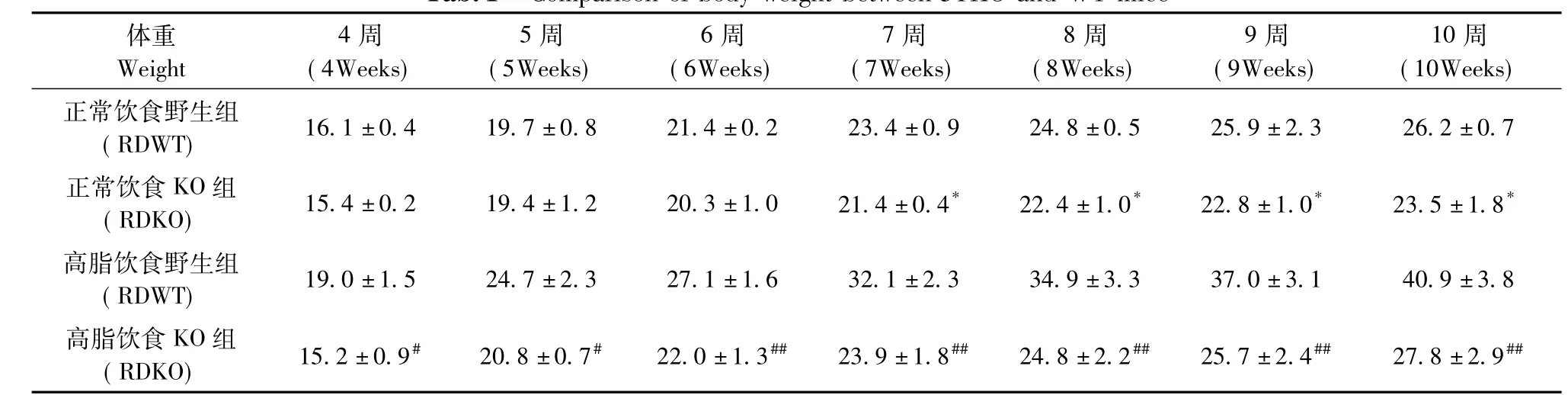
表1 FKBP51基因敲除小鼠和野生型小鼠高脂和正常饮食体重记录表Tab.1 Comparison of body weight between 51KO and WT mice

表2 FKBP51基因敲除小鼠和野生型小鼠高脂饮食量记录表Tab.2 Comparison of food intake between male 51 KO and WT mice
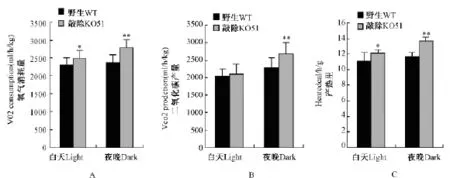
图1 正常饮食小鼠昼夜平均氧气消耗量、二氧化碳产量、产热量的比较Note:*P <0.05;**P <0.01,compared with control group.Fig.1 Comparison of O2consumption,CO2production and heated production during day and night
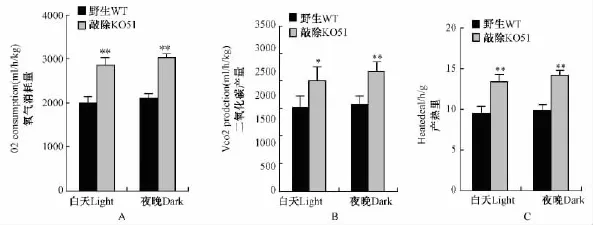
图2 高脂诱导小鼠昼夜平均氧气消耗量、二氧化碳产量、产热量的比较Note:*P <0.05;**P <0.01,compared with control group.Fig.2 Comparison of O2consumption,CO2production and heated production during day and night
(2)高脂诱导FKBP51基因敲除小鼠能量代谢较旺盛
对高脂饮食小鼠的呼吸代谢测定结果如图2所示,小鼠昼夜平均耗氧量(VO2)(图2A)、二氧化碳产生量(VCO2)(图2B)和产生的热量(图2C)。结果显示:高脂诱导后FKBP51基因敲除小鼠的O2消耗量、CO2的产量、产热量均明显高于对照组小鼠(P<0.01),表明FKBP51基因敲除小鼠在高脂诱导后呼吸代谢明显增强。
2.4 FKBP51基因敲除小鼠高脂饮食诱导后肝脏中脂质沉积较少
肝脏HE染色结果如彩插8图3所示,在正常饮食条件下,野生型(图3A)和FKBP51基因敲除(图3C)小鼠肝脏中均没有脂质的异位沉积。在高脂喂养后的野生型小鼠肝脏中(图3B),可见大量被染成红色的脂滴,说明肝脏中脂滴沉积数量较多,并已表现为脂肪肝;而高脂诱导的FKBP51基因敲除小鼠肝脏中(图3D),脂滴数量较少,脂肪肝症状也较野生型小鼠有所减轻。这一结果提示,FKBP51基因敲除小鼠对高脂诱导肥胖的抵抗效应可能是通过减少脂质生成或促进脂质分解来实现的。
2.5 FKBP51基因敲除小鼠MEF细胞脂肪诱导分化受阻
对野生型小鼠和FKBP51基因敲除小鼠的永生化MEF细胞诱导脂肪分化第8天时,油红O染色结果如彩插8图4所示,已有80%以上WT型MEF细胞分化为成熟的脂肪细胞,而FKBP51 KO中只有很少的细胞分化为成熟的脂肪细胞。这些结果显示FKBP51基因的缺失后脂肪细胞的分化将受到抑制。
2.6 小鼠肝脏和脂肪组织相关基因的检测
肝脏组织实时荧光定量PCR实验结果如图5所示,我们发现,高脂诱导后,野生型小鼠肝脏中糖异生相关酶PDK4、G6Pase、PEPCK表达受到抑制,mRNA水平下调(P<0.05)。糖异生作用减弱,表明非糖物质向葡萄糖转化方向受抑制。而高脂诱导后,与野生型小鼠(HFWT)相比,KO51小鼠(HFKO)中,糖异生的限速酶G6Pase、PEPCK表达均上调(P<0.05,P<0.05)。并且我们还发现,在肝脏糖脂代谢中发挥重要调节作用的转录辅助激活因子(PGC-1α),HFKO小鼠中表达上调(P<0.05)。
脂肪组织实时荧光定量PCR实验结果如图5所示,我们发现,在KO51小鼠中,与能量代谢相关的线粒体基因UCP-1表达显著上调(P <0.01)、UCP-2表达上调(P<0.05)、UCP-3表达显著上调(P <0.01)。
3 讨论
在近些年的研究中,围绕FKBP51基因与脂肪细胞分化关系的研究中,有两种不太一致的实验结果:有结果认为,FKBP51抑制3T3-L1前脂肪细胞的分化,Toneatto J等[7]发现,对诱导分化转染24 h后FLAG-FKBP51载体的3T3-L1细胞,进行油红O染色,脂质积累明显少于转染空载体的细胞,脂联素等表达也低于对照组;而有的结果却发现,脂肪的生成需要FKBP51的参与,在Stechschulte等[8]的研究中,在脂肪生成刺激因子的作用下,FKBP51KO的3T3-L1细胞脂质积累降低,且脂肪生成标志蛋白的表达也降低。当细胞中的FKBP51基因重新表达,上述的情况就恢复了正常。这证实了FKBP51在细胞脂质的积累中起到很重要的调节作用,脂肪生成过程中 FKBP51被高诱导表达[9-10]。我们取FKBP51基因敲除小鼠MEF细胞进行脂肪诱导分化实验,结果与Stechschulte等人的观点一致,这些实验结果,多是基于体外的细胞实验,缺乏对体内的研究与验证。因此,通过对FKBP51基因敲除小鼠模型的来探究FKBP51基因的作用显得尤为重要。
我们首次对FKBP51基因敲除小鼠进行高脂诱导,发现其出现抵制高脂诱导肥胖的表型。在肝脏组织基因分析中,发现高脂诱导后对照组糖异生相关酶PDK4、G6pase、PEPCK表达下调,摄入的脂质堆积在肝脏中,出现脂肪肝。PEPCK等是糖异生途径的限速酶,其转录的多少决定着糖异生的速度[11]。而在KO51小鼠肝脏中,PDK4、G6pase、PEPCK表达上调,糖异生途径增加,促进脂质向葡萄糖的转化,从而使得肝脏中脂滴的积累减少。上游的转录辅助激活因子PGC-1α表达也上调,PGC-1α可与肝细胞核因子结合形成复合物,使之活化,从而启动G6pase、PEPCK编码基因转录[12-13]。因此,FKBP51的缺失可能通过影响糖异生酶上游的调控因子来发挥作用,从而减少了脂质在肝脏中的积累。
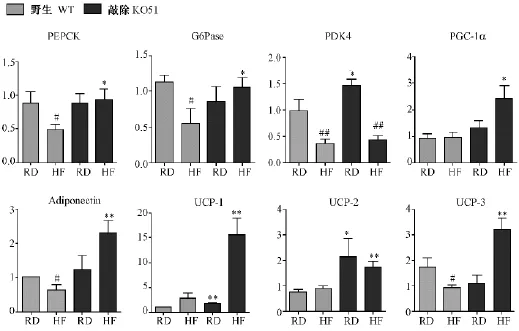
图5 肝脏组织和脂肪组织中代谢相关基因mRNA水平的检测Note:Compared with the RDWT,*P <0.05,**P <0.01;compared with the control group,#P<0.05,##P <0.01.Fig.5 The mRNA level of metabolism related genes in the liver and adipose
在基础代谢情况下,大多数组织依靠脂肪氧化作为主要能源。KO51小鼠脂肪组织中,我们发现解偶联蛋白、脂联素的表达上调。脂联素(adiponection)是一种内源的脂肪因子,可促进脂肪酸的氧化,在许多代谢通路中发挥作用[14]。解偶联蛋白是一类线粒体内膜上的载体,其中UCP-1、UCP-2、UCP-3在结构上十分相似。UCP1特异表达在棕色脂肪组织[15-16],嵌入细胞的线粒体膜内消除线粒体电位,驱动消耗脂肪,将其转化为热而非ATP。UCP-2与UCP-3也有产热功能,但目前被认为主要在控制脂肪酸氧化中起作用,且均与肥胖相关[17-19]。以上这些基因的表达增加,是FKBP51基因敲除小鼠呼吸代谢与产热量增加、脂肪积累减少的有力证据。
综上所述,我们发现FKBP51基因敲除小鼠抵制高脂诱导肥胖,其原因可能有两个方面,一方面是FKBP51基因的缺失阻碍脂肪分化和脂质积累;另一方面,通过上调组织中脂代谢和能量代谢相关基因PDK4、UCP-1,从而增加能量代谢。FKBP51在机体中的调控十分的复杂,还许多问题需要解决,例如FKBP51在机体的调控机制,其抑制剂是否能够抑制体重的增加、是否促进肥胖者减肥、是否能够防止糖尿病人的葡萄糖耐量继续恶化,以及进行激素处理等等问题还需要进行长远探究。
[1]E.R.Sanchez,D.O.Toft,M.J.Schlesinger,et al.Evidence that the 90-kDa phosphoprotein associated with the untransformedL-cell glucocorticoid receptor is a murine heat shock protein[J].J.Biol.Chem.1985,260(23):12398–12401.
[2]Reynolds PD,Ruan Y,Smith DF,et al.Glucocorticoid resistance in the squirrel monkey is associated with overexpression of the immunophilin FKBP51[J].J Clin Endocrinol Metab 1999,84(2):663-669.
[3]Gregoire FM.Adipocyte differentiation: from fibroblastto endocrine cell[J].Exp Biol Med.2001;226(11):997–1002.
[4]Gregoire FM,Smas CM,Sul HS.Understanding adipocyte differentiation[J].Physiol Rev.1998;78(3):783–809.
[5]Toneatto J1,Charó NL,Susperreguy S,et al.The dynamic mitochondria-nuclear redistribution of FKBP51 during the process of adipocyte differentiation is regulated by PKA[J].Medicina (B Aires).2013;73(5):401-405.
[6]Linda Yang,,Fumiko Isoda.Hypothalamic Fkbp51 is induced by fasting,and elevated hypothalamic expression promotes obese phenotypes[J].Am J Physiol Endocrinol.2012,302(8):E987–E991.
[7]Toneatto J,Guber S,Charó NL,et al.Dynamic mitochondrialnuclear redistribution of the immunophilin FKBP51 is regulated by the PKA signaling pathway to control gene expression during adipocyte differentiation[J].J Cell Sci.2013,126(23):5357-5368.
[8]Stechschulte LA,Hinds TD Jr,Khuder SS,et al..FKBP51 controlscellularadipogenesis through p38 kinase-mediated phosphorylation of GRα and PPARγ[J].Mol Endocrinol.2014,28(8):1265-1275.
[9]Yeh W C,Li T K,Bierer B E,et al.Identification and characterization of an immunophilin expressed during the clonal expansion phase of adipocyte differentiation[J].Proc Natl Acad Sei USA,1995,92(24):11081-11085.
[10]Yeh W C,Bierer B E,McKnight S L.Rapamycin inhibits clonal expansion and adipogenic differentiation of 3T3-L1 cells[J].Proc Natl Acad Sei USA,1995,92(24):11086-11090.
[11]Goto M,Yoshioka T,Battelino T,et al.TNF alpha decreases gluconeogenesis in hepatocytes isolated from 10-day-old rats[J].Pediatr Res,2001,49(4):552-557.
[12]Kurukulasuriya R,Link JT,Madar DJ,et al.Potential drug targets and progress towards pharmacologic inhibition of hepatic glucose production[J].Curr Med Chem 2003,10(2):123-153.
[13]NakaeJ, Kitamura T, SilverDL, etal. Theforkhead transcription factor Foxo1(Fkhr)confers insulin sensitivity onto glucose-6-phosphatase expression[J].J Clin Invest,2001,108 (9):1359-1367.
[14]Kakali Ghoshal,Maitree Bhattacharyya.Adiponectin:Probe of the molecular paradigm associating diabetes and obesity[J].World J Diabetes.2015,6(1):151–166.
[15]D.G.Nicholls,E.Rial.A history of the first uncoupling proteinUCP1[J].J Bioenerg Biomembr.,1999,31(5):399–406
[16]K.Fukuchi,M.Tatsumi,Y.Ishida,et al.Radionuclide imaging metabolic activity of brown adipose tissue in a patient with pheochromocytoma[J].Exp Clin Endocrinol Diabetes,2004,112(10):601–603
[17]Moore GB1,Himms-Hagen J,Harper ME,et al.Overexpression of UCP-3 in skeletal muscle of mice results in increased expression of mitochondrial thioesterase mRNA[J].Biochem Biophys Res Commun.2001,283(4):785-790.
[18]Diano S.,Horvath T.L.Mitochondrial uncoupling protein 2 (UCP2)in glucose and lipid metabolism[J].Trends Mol.Med.2012;18(1):52–58.
[19]Esterbauer H.A common polymorphism in the promoter of UCP2 is associated with decreased risk of obesity in middle-aged humans[J].Nat Genet,2001,28(2):178–183.
FKBP51 plays an important role in high fat diet-induced obesity
ZHANG Man,QIU Bin,CAO Yong,XU Yu-xue,DENG Ran,YANG Zhi-wei,YONG Wei-dong
(Institute of Laboratory Animal Science,Peking Union Medical College&Chinese Academy of Medical Sciences Laboratory of Gene and Development,Beijing 100021,China)
Objective The goal of this study is to understand the function of FKBP51 in resistant to high fat dietinduced obesity using FKBP51 knockout(KO)mice and in vitro adipocyte differentiation.Methods Four-week old male FKBP51 KO and wild type(WT)mice were fed separately with regular or high fat diet for 6 weeks.The body weight and food consumption were recorded weekly,the energy expenditure differences(O2consumption,CO2production,respiratory exchange ratio,and heat production)of each group were monitored using the MM-100 metabolism cages system for 24 hours,then the liver from the above animals were stained with the Oil red-O to detect the lipid accumulation and the expression of metabolic genes.In addition,induction of adipocyte differentiation of immortalized MEF cells from WT and FKBP51 KO mice were used to observe the effect of FKBP51 gene on lipogenesis.Results Compared to WT mice,FKBP51 KO mice has less weight increment,and less lipid accumulation in the liver,but with no difference on food consumption during high-fat diet fed.Moreover,FKBP51 KO mice exhibited more O2consumption,CO2production and heated production under both RD and HF diet conditions.The PEPCK,G6Pase and UCP-1 genes up-regulation.In addition,lipid content was reduced in FKBP51 gene deficient MEF cells after adipocyte differentiation.Conclusions TheFKBP51 gene plays an important role in high fat diet-induced obesity through the energy metabolism enhancement and lipogenesis inhibition.
FKBP51;Energy metabolism;Lipogenesis;Obesity
R-332
A
1671-7856(2015)07-0053-06
10.3969.j.issn.1671.7856.2015.007.011
863项目(2012AA02240);国家自然科学基金(81272273);协和学生创新项目(33320140151)。
张曼(1988-),女,硕士生,E-mail:M_zhang0607@163.com。
雍伟东,男,研究员,E-mail:wyong@cnilas.org。
2015-06-29
技术方法

