Skp2 表达对食管癌术后复发及预后的影响
费春明 叶劲军 周国仁 何飞 张小东 曾勇
Skp2 表达对食管癌术后复发及预后的影响
费春明 叶劲军 周国仁 何飞 张小东 曾勇
目的 研究Skp2表达对食管癌术后复发及预后的影响。 方法 对74例食管癌手术切除患者的病理标本进行Skp2免疫组化染色,并收集术后完整临床资料及随访资料,进行统计学分析。应用Cox比例风险模型对可能影响食管癌预后的因素进行分析,用Log-rank检验分析Skp2对总生存期(OS)、无肿瘤生存期(DFS)、局部无复发生存期(LRFS)及远处无复发生存期(DMFS)的影响。 结果 食管癌组织中Skp2的阳性表达率为47.3%。Skp2表达阴性患者的3年及5年生存率显著高于Skp2表达阳性患者,差异有统计学意义(P<0.01)。在食管癌组织中Skp2的表达与肿瘤的大小、淋巴结转移、浸润深度、TNM分期有关(P均<0.01)。Skp2高表达食管癌患者术后OS、DSF、DMSF及LRFS显著低于Skp2低表达患者(P<0.05)。Cox多因素回归分析表明, TNM分期、肿瘤浸润深度、有无淋巴结转移、Skp2表达是食管癌患者生存的独立预测因素。 结论 Skp2过表达是食管癌术后预后不良的重要因素。
食管癌; Skp2; 食管癌切除术; 免疫组化染色
我国是食管癌(esophageal cancer)高发地区,其发病人数占世界发病人口的1/2以上。临床对食管癌治疗的主要手段是手术,即使对患者实施有效的手术治疗,单纯手术治疗后5年生存率<25%;而术后复发率高达34%~79%[1-2]。Skp2是Skp2/SCF(Skp1-Cullin1-F-box)复合体的识别亚单位。与多种细胞周期相关蛋白如p27、p21等泛素化降解有关,其表达异常增高会导致细胞过度增殖。目前发现Skp2在多种肿瘤中出现过表达现象,并与肿瘤细胞异常增殖及不良预后有关[3]。本研究探讨Skp2对食管癌切除术后复发及预后的影响。
1 资料与方法
1.1 一般资料 选取南京医科大学附属南京市六合区人民医院病理科2004年1月至2009年12月均未行化疗、放疗、免疫治疗的食管癌患者手术标本74例,所有标本均为病理科存档蜡块。所有患者均有完整的病历资料、随访资料,随访时间为60月。其中男46例,女28例。年龄47~78 岁,平均61.3±5.7岁。纳入标准:(1)病理均为鳞癌;(2)均为根治性切除。肿瘤部位根据美国癌症联合会(AJCC)2009分段标准:胸上段14例,胸中段35例,胸下段25例。临床病理分期按食管癌国际TNM分期标准第7版(UICC, 2009版):临床分期0~Ⅰ 期22例,Ⅱ期26例,Ⅲ期26例。组织学分化程度:高分化鳞癌19例,中分化鳞癌26例,低分化鳞癌29例。
1.2 试剂 即用型兔抗人Skp2 p45(H-435):sc-7164多克隆抗体,购自美国Santa Cruz Biotechnology公司。通用型二抗、DAB试剂购自北京中杉生物技术有限公司。
1.3 方法 手术标本均经4%中性甲醛溶液固定,常规石蜡包埋。切片厚0.4 μm,常规HE染色,光镜下行细胞形态学观察,以确定病理诊断及分组。免疫组化染色采用二步法En vision系统,检测食管癌组织中的Skp2表达情况,按试剂盒说明操作。以TBS 代替一抗、二抗作阴性对照。
1.4 结果判定 Skp2蛋白免疫组化染色结果以细胞核出现浅黄色至深棕色颗粒为阳性反应。结果按阳性细胞百分比进行判断,参照Naoki法[4]。阳性细胞百分比≤10%,无棕黄色或与背景着色一致为(-);阳性细胞百分比10%~20%为(±),阳性细胞百分比21%~80%为(+),阳性细胞百分比>80%为(++)。以(-)和(±)为阴性,(+)和(++)定义为阳性。

2 结果
2.1 Skp2蛋白在食管癌组织中的表达情况 Skp2蛋白染色阳性主要定位于食管癌肿瘤细胞核,高分化食管癌组织的Skp2倾向于表达阴性,低分化食管癌组织Skp2倾向于表达阳性(图1)。Skp2蛋白免疫组化染色结果中阳性细胞百分比为26%~78.3%。Skp2蛋白在74例食管癌患者中阳性率为47.30%(35/74)。
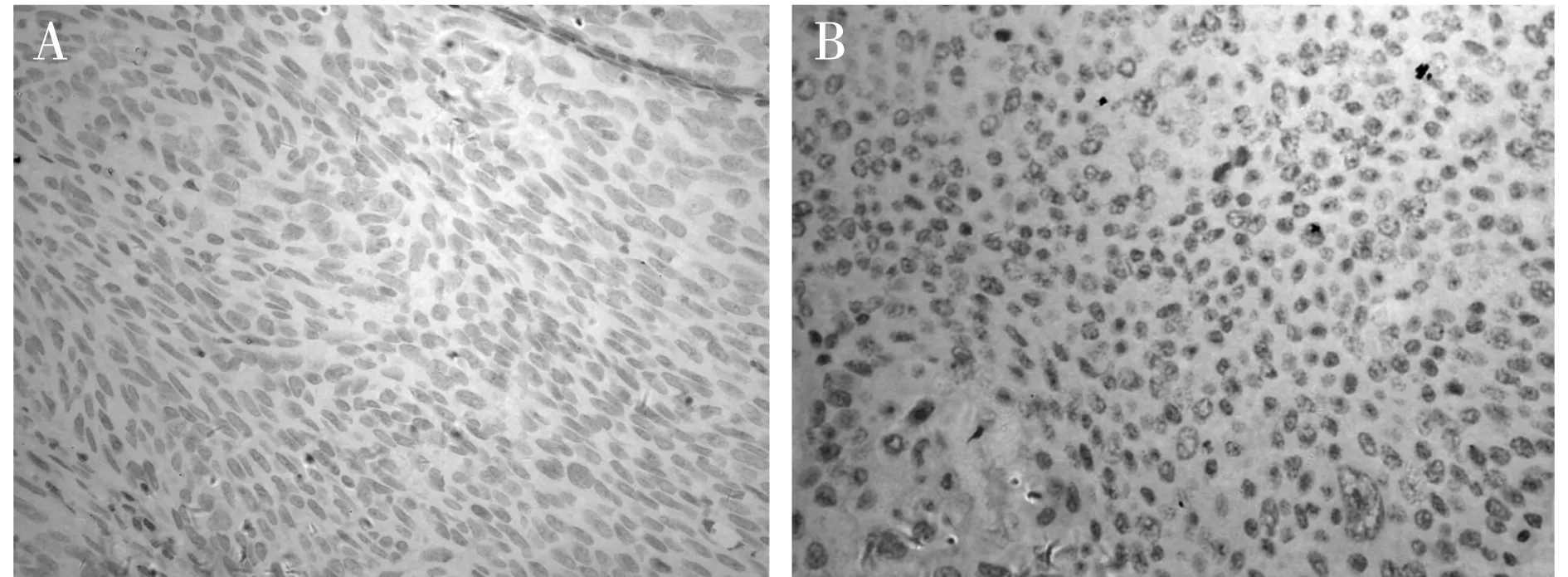
注:A为高分化食管鳞癌Skp2表达,B为低分化食管鳞癌Skp2表达。图1 Skp2在食管癌组织中的阳性表达
2.2 Skp2蛋白表达与食管癌患者临床病理特征的关系 Skp2的阳性表达强度与肿瘤浸润深度、淋巴结转移、临床TNM分期、组织学分化程度有关。组织学分化程度越低,其阳性率越高(P<0.001);肿瘤浸润深度越深,其阳性率越高(P<0.05);临床TNM分期越晚,其阳性率越高(P<0.001);有淋巴结侵入和转移的食管癌患者Skp2阳性率高于无淋巴结侵入和转移者(P<0.001)。但Skp2蛋白的表达与食管癌患者的性别、年龄、肿瘤部位无关,见表1。

表1 Skp2蛋白表达与食管癌临床病理特征的关系(n,%)
2.3 随访结果和生存状况 74例食管癌患者的1年总生存率为91.8%,3年生存率为56.0%,5年生存率为37.8%。中位生存期为41.37月。至随访截止日期,死亡45例,生存24例。Skp2蛋白表达阴性患者的3年生存率为76.5%,5年生存率为63.3%;而Skp2蛋白表达阳性患者的3年生存率为23.6%,5年生存率为8.85%。
2.4 Skp2与生存期关系 采用Log-rank分析方法进行生存统计分析,结果显示:Skp2阴性表达的病人总生存期(OS)(χ2=38.061,P<0.001)、无肿瘤生存期(DFS)(χ2=13.867,P<0.001),局部无复发生存期(LRFS)(χ2=9.487,P=0.002)及远处无复发生存期(DMFS)(χ2=26.900,P<0.001)显著高于Skp2阳性患者。
2.5 影响食管癌预后的因素分析 影响术后生存期的单因素分析表明:肿瘤的浸润深度、组织学分化程度、淋巴结是否转移、TNM分期、肿瘤组织中Skp2阳性表达是影响术后生存期的因素(表2)。进一步进行Cox多因素回归分析发现:仅有组织学分化程度、淋巴结是否转移、TNM分期、Skp2阳性表达与肿瘤患者的生存期有关。见表3。

表2 影响患者预后的单因素分析

表3 影响患者预后的多因素COX回归分析
3 讨论
手术是食管癌治疗的主要手段, 但目前手术治疗后5年生存率仍较低。食管癌的预后除了与TNM分期等临床指标有关外,分子病理学研究显示,多种基因和蛋白调控紊乱和表达异常如p27、HIF等均与食管癌的发生、增殖、浸润和转移密切相关,并且是影响预后的重要因素[5]。目前研究表明多种细胞周期相关蛋白与食管癌的增殖明显相关,如p21、p27、cyclinD1[6-7]。因此,研究食管癌这些基因及蛋白与手术后的预后关系,有助于发现术后复发的高危人群,对改善食管癌患者的预后,提高生存率具有重要的临床意义。
Skp2首先因其为S期Cdk2/Cyclin A相关蛋白被人们所发现[8]。Skp2是F-box家族成员,Skp2/SCF (Skp1-Cullin1-F-box) 复合体的识别亚单位,后者负责蛋白的泛素化连接并随之被26S蛋白酶体降解。多种与细胞周期负性相关蛋白通过Skp2介导泛素化降解,包括:p21、p57、p27、p130等[8-9]。 因而,Skp2过表达促进细胞从G1期向S期转化。在肺癌、头颈部癌、乳腺癌、黏液纤维肉瘤[10]等多种肿瘤中Skp2均出现过表达现象。研究证明除了促进细胞增殖,Skp2过表达还与多种肿瘤的侵袭性表型如细胞迁移、浸润、转移有关[11-12]。近来研究表明Skp2还与肿瘤的放化疗敏感性有关[13]。Skp2与ErbB家族诱导的Akt泛素化降解、有氧酵解、肿瘤发生有关。研究表明在多种肿瘤中,Skp2表达异常增高,并与肿瘤恶性程度及不良预后有关[14],Skp2是多种肿瘤不良预后的独立因素[15]。
本研究显示,Skp2表达与食管癌肿瘤大小、病理分级、TNM分期、肿瘤的浸润深度、淋巴结转移等因素明显相关,提示其与食管癌生物侵袭活性有关。74例食管癌患者的1年生存率为85%, 3年生存率为55%, 5年生存率为38%。患者的随访时间最短为5月,平均随访时间为41.37月。至随访截止日期, 死亡病例为45例,生存病例为24例。Skp2表达与食管癌术后生存期明显相关,Skp2阴性患者的3年、5年生存期显著高于Skp2阳性患者。我们通过对Skp2表达与患者OS、DSF、LRSF、DMFS进行Log-rank检验发现,Skp2表达与食管癌患者OS、DSF、LRSF、DMFS相关,其表达阳性患者的OS、DSF、DMSF及LRSF显著低于阴性患者,提示Skp2在食管癌发生进展过程中可能发挥重要作用,这一作用可能与Skp2具有促进肿瘤细胞增殖和侵袭有关。
单因素分析表明:病理组织学分化程度、TNM分期、肿瘤的浸润深度、淋巴结转移以及食管癌组织中Skp2表达是影响患者术后生存的因素。多因素分析显示,组织学分化程度、淋巴结转移、TNM分期、Skp2表达阳性是影响肿瘤患者生存的独立预后因素。我们的研究结果与Liang等[16]研究结果一致。因而我们认为Skp2是重要的食管癌手术治疗预后不良因素,可以作为术后评估预后的重要指标。
[1] Yang L,Parkin DM,Li L,et al.Time trends in cancer mortality in China: 1987-1999[J]. Int J Cancer,2003,106(5):771-783.
[2] Lee SJ,Lee KS,Yim YJ,et al.Recurrence of squamous cell carcinoma of the oesophagus after curative surgery: rates and patterns on imaging studies correlated with tumour location and pathological stage[J]. Clin Radiol,2005,60(5):547-554.
[3] Hershko DD.Oncogenic properties and prognostic implications of the ubiquitin ligase Skp2 in cancer[J]. Cancer,2008,112(7):1415-1424.
[4] 罗四维,彭先兵,张群,等.Skp2结构与肿瘤关系研究进展[J].中华实用诊断与治疗杂志,2010,24(2):110-112.
[5] Ping W,Sun W,Zu Y,et al. Clinicopathological and prognostic significance of hypoxia-inducible factor-1α in esophageal squamous cell carcinoma: a meta-analysis[J]. Tumour Biol,2014,35(5):4401-4409.
[6] Shiozaki A,Nakashima S,Ichikawa D,et al.Prognostic significance of p21 expression in patients with esophageal squamous cell carcinoma[J].Anticancer Res,2013,33(10):4329-4335.
[7] Tong Q,Zhang W,Jin S,et al.The relationship between p27(kip1) expression and the change of radiosensitivity of esophageal carcinoma cells[J]. Scand J Gastroenterol,2011,46(2):173-176.
[8] Bhattacharya S,Garriga J,Calbó J,et al.SKP2 associates with p130 and accelerates p130 ubiquitylation and degradation in human cells[J].Oncogene,2003,22(16):2443-2451.
[10]Huang HY,Kang HY,Li CF,et al.Skp2 overexpression is highly representative of intrinsic biological aggressiveness and independently associated with poor prognosis in primary localized myxofibrosarcomas[J].Clin Cancer Res,2006,12(2):487-498.
[11]Chan CH,Lee SW,Li CF,et al.Deciphering the transcriptional complex critical for RhoA gene expression and cancer metastasis[J].Nat Cell Biol,2010,12(5):457-467.
[12]Li CF,Wang JM,Kang HY,et al.Characterization of gene amplification-driven skp2 overexpression in myxofibrosarcoma: potential implications in tumor progression and therapeutics[J].Clin Cancer Res,2012,18(6):1598-1610.
[13]Wang XC,Tian LL,Tian J,et al.Overexpression of SKP2 promotes the radiation resistance of esophageal squamous cell carcinoma[J].Radiat Res,2012,177(1):52-58.
[14]Tian YF,Chen TJ,Lin CY,et al.SKP2 overexpression is associated with a poor prognosis of rectal cancer treated with chemoradiotherapy and represents a therapeutic target with high potential[J].Tumour Biol,2013,34(2):1107-1117.
[15]Oliveira AM,Okuno SH,Nascimento AG,et al.Skp2 protein expression in soft tissue sarcomas[J].J Clin Oncol,2003,21(4):722-727.
[16]Liang Y,Hou X,Cui Q, et al.Skp2 expression unfavorably impacts survival in resectable esophageal squamous cell carcinoma[J].J Transl Med, 2012,10:73.
Effects of Skp2 overexpression on postoperative recurrence and prognosis in patients with esophageal cancer
FEIChun-ming,HEFei,ZHANGXiao-dong,ZENGYong.DepartmentofGastroenterology,theAffiliatedNanjingLuheDistrictPeople’sHospital,NanjingMedicalUniversity,Nanjing211500,China;YEJin-jun,ZHOUGuo-ren.DepartmentofRadiotherapy,AffiliatedJiangsuCancerHospital,NanjingMedicalUniversity,Nanjing210009,China
Objective To study the effects of Skp2 overexpression on the postoperative recurrence and prognosis of esophageal cancer. Methods The pathological specimens of 74 patients with surgical resection of esophageal cancer were used for Skp2 immunohistochemical staining. In addition, complete postoperative clinical information and follow-up data were collected for statistical analysis. The parameters that might influence the prognosis results of esophageal cancer were analyzed using the Cox proportional hazards model. The effects of Skp2 on overall survival (OS), disease-free survival (DFS), local recurrence-free survival (LRFS), and distant metastasis-free survival (DMFS) were analyzed using the Log-rank test. Results The positive Skp2 expression rate in esophageal cancer tissues was 47.3%. The 3-year and 5-year survival rate of the patients with negative Skp2 expression were significantly higher than those in patients with positive Skp2 expression. Skp2 expression was associated with lymph node metastasis, infiltration depth, and TNM staging of esophageal cancer (P<0.01).The results of the multivariate Cox regression analysis showed that TNM staging, tumor infiltration depth, lymph node metastasis, and Skp2 expression were independent predictors for the survival of esophageal cancer patients. The postoperative OS, DSF, DMSF, and LRFS rates of the patients with high levels of Skp2 expression were significantly worse than those with low levels of Skp2 expression. Conclusions Skp2 overexpression is an important factor of a poor postoperative prognosis of esophageal cancer.
esophageal cancer; Skp2; esophagectomy for esophageal cancer; immunohistochemical staining
南京市医学科技发展项目(YKK11183)
211500江苏省南京市,南京医科大学附属南京市六合区人民医院消化科(费春明,何飞,张小东,曾勇);210009江苏省南京市,南京医科大学附属江苏省肿瘤医院放疗科(叶劲军,周国仁)
曾勇,Email:Zengyong@whhyyy.com
R 735.1
A
10.3969/j.issn.1003-9198.2015.11.020
2015-09-08)

