小麦重组自交系群体抽穗期QTL分析
小麦重组自交系群体抽穗期QTL分析
抽穗期决定小麦品种的种植地区和季节适应性,是小麦育种重要目标性状之一。影响小麦抽穗期的基因主要有3类:光周期基因、春化基因和早熟基因,其中光周期基因和春化基因都会与环境发生互作,而早熟基因并不受环境的影响,它独立于环境[1-2]。一系列光周期基因以及其同源基因被分别定位在2D染色体(Ppd-D1)、2B染色体(Ppd-B1)和2A染色体(Ppd-A1)上,这些基因通过对日照长短的不同反应来决定小麦的抽穗期,而且都是控制短抽穗期的显性基因[3-4]。前人研究发现基因Ppd-D1、Ppd-B1、Ppd-A1能分别缩短小麦抽穗期8 d、3 d和5 d[5]。在小麦其他染色体上也存在与抽穗期相关的QTL,例如在3D和4B染色体上存在能缩短抽穗期的基因[6]。春化反应是指小麦必须通过一定低温才能抽穗开花。通过对冬小麦的遗传分析发现,控制小麦春化的基因主要有Vrn-1、Vrn-2、Vrn-3和Vrn-44种基因,它们通过不同显隐性组合以及相互作用共同调控小麦的春化习性[7-12]。前3个春化基因已经被分别克隆,它们各自的突变表型也被深入研究[13-17]。目前已在六倍体普通小麦所有染色体组中发现Vrn-1、Vrn-2和Vrn-3的同源基因,但是Vrn-4基因位点的自然变异仅在D基因组中被发现,且还没有被克隆的报道。Kippes等[18]在基因Vrn-4位点区段构建了一个高密度遗传图谱,并将其精细定位在5D染色体着丝粒的0.09 cM区间内。早熟基因决定了小麦花原基的数量,从而最终决定了小麦的产量[19]。与春化基因和光周期基因相比,早熟基因的研究定位报道较少,更没有见到早熟基因被克隆的报道。研究发现在小麦染色体2B、3A、3D、4A、4D、5A和6B上存在早熟基因或与之相关的QTL[20]。Bullrich等[21]在一粒小麦(Triticum monococcum)的1Am染色体上发现一个控制抽穗期的主效QTL。Laurie等[22]研究发现在大麦几乎所有染色体上都含有与早熟相关的QTL。扬麦9号具有矮秆抗倒、早熟、籽粒较大等较好农艺性状,适合种植在长江中下游流域[23],在育种中广泛被用来配置杂交组合,具有重大的利用价值。因此,深入了解扬麦9号抽穗期的遗传特性对以后商业育种具有重要的价值。
1 材料与方法
1.1 试验材料
所选亲本是扬麦9号和CI12633,其中扬麦9号是由江苏里下河地区农业科学研究所选育而成,其特点是千粒质量较高,抽穗期较早,从播种到抽穗只需166 d左右;CI12633是提莫菲维小麦(T.timopheevii,2n=4x=28,AAGG)六倍体小麦的衍生系,其特点是抗小麦纹枯病,千粒质量较低,抽穗期较长(达到183 d左右)。本研究室于2003年利用这2个亲本杂交得到F1代,后经连续多年“一粒传法”获得F13代重组自交系(RIL),共184个株系作为本试验的材料。
1.2 田间种植
184个重组自交系群体及其双亲在2012—2015年度种植于江苏里下河地区农业科学研究所万福试验基地,每年播种的时间都定于10月25日。试验采用随机区组设计,每隔50个株系插入种植对照亲本扬麦9号和CI12633。试验3年,每年3次重复,小区为双行区,行长2.3 m,行距0.3 m,每行均匀播种35粒,出苗后保证每行密度相同,田间管理同大田。
1.3 DNA提取及分子标记检测
双亲及RIL群体基因组DNA提取参照Sharp等方法[24]。所用 SSR 标记序列及扩增条件参考Röder等[25]和 Somers等[26]的报道以及 http://wheat.pw.usda.gov上的信息。所有引物由上海生工生物工程技术服务有限公司合成,共计合成了2 834对SSR引物。利用这些引物对双亲间的多态进行筛选,共筛选出 212对引物,扩增条件分别参照Paux等[27]、Ellis等[28]和Fu等[29]的报道。
1.4 田间性状的测定和数据分析
抽穗日期以50%以上植株的顶端第1小穗露出叶鞘的日期为准,从播种到抽穗的日数为抽穗期。数据分析采用Excel和SPSS软件。
1.5 遗传图谱构建和QTL分析
根据SSR引物扩增结果,将与扬麦9号带型一致的标记为A,与CI12633一致的标记为B,缺失或者模糊的带型记为“-”。利用软件JoinMap4构建遗传连锁图谱。3年9次试验的抽穗期值作为QTL定位分析。根据构建的连锁图谱利用WinQTL Cartograph2.5软件采用复合区间作图方法,检测所有可能存在的QTL。当阈值(LOD)大于2.5时,就认为可能存在一个QTL,同时计算每个QTL的贡献率和加性效应值。采用McCouch等[30]的方法命名QTL,即Q+性状名称缩写+染色体编号+编号(如有多个QTL)。作图群体的标记均遍及小麦21条染色体,可用于QTL定位。
2 结果与分析
2.1 小麦遗传连锁图谱
利用JoinMap4软件,分析212个SSR标记之间的连锁关系,根据已报道的作图位置,最终将其中的191个SSR标记定位在小麦21条染色体上。本图谱全长1 567.2 cM,标记间平均距离8.2 cM,每个连锁群上的标记数为2(7D)~17(2A)个,平均每个连锁群含有约9.1个标记。标记数在3个染色体组间分布不均匀,A和B两组的标记数分别是D组的2倍,单个染色体上的标记数目相差也很明显,2A染色体上标记数最多,达到17个,而7D上只有2个(表1)。
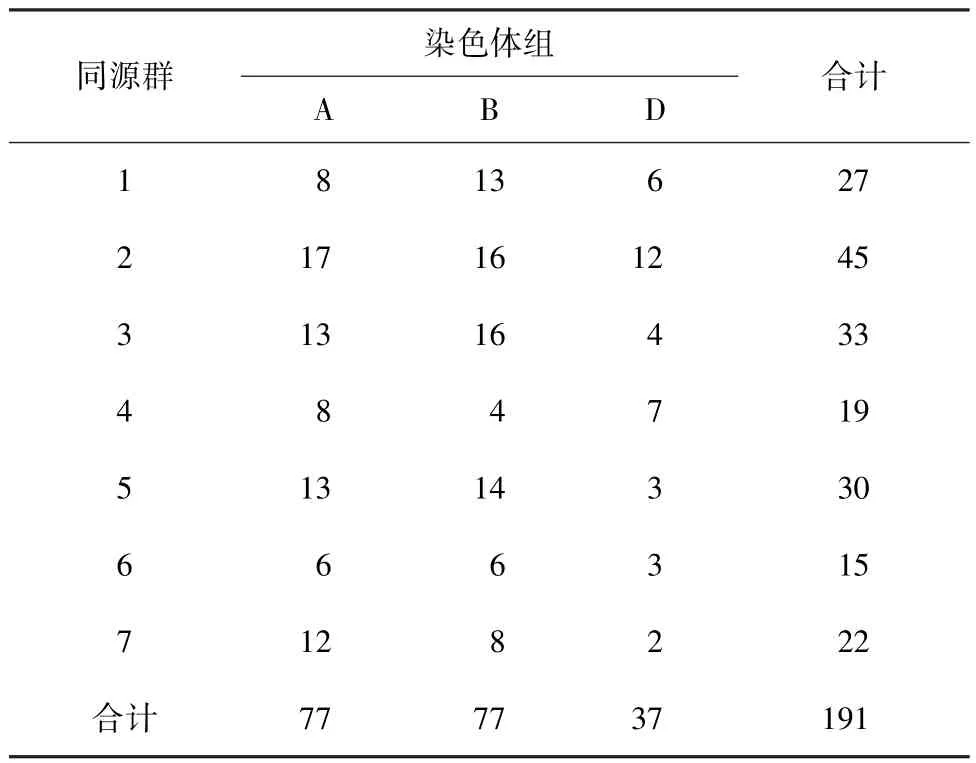
表1 SSR标记位点在小麦全染色体上的数量分布Table 1 The distribution of SSRmarker number on wheat chromosomes
2.2 RIL群体及其亲本间的表型变异
在3年试验中,扬麦9号的抽穗期显著早于CI12633,差异达极显著水平。从表 2可以看出2012—2013年度和2014—2015年度试验中,同一亲本的抽穗期相差不大,但在2013—2014年度试验中,两亲本的生育期都延长了2~3 d,这是由于在该年度中春季气温较低、雨水偏多等环境影响下其抽穗期变长。说明环境对抽穗期的影响较大。如图1所示,RIL群体的抽穗期表现为连续变异,这是典型数量性状的遗传特点。3年试验中,抽穗期的偏度系数的绝对值均大于0,峰度的绝对值大于3,表现连续变异,但频率分布略偏正态分布,其表型值偏向扬麦9号,变异系数变化范围为23.7%~25.4%。
2.3 小麦抽穗期性状的方差分析
方差分析结果(表3)表明,小麦抽穗期在RIL群体中遗传分离存在差异性,符合QTL分析的基本条件。在分析群体中每年的RIL个体之间差异非常显著(F>20,P<0.000 1),区组间达到显著水平但没有达到极显著水平,这表明同年重复间存在差异,这可能是由于微环境对表型产生了一定影响。年度重复之间并没有差异,说明每个重组自交系的抽穗期在年度之间表现稳定。
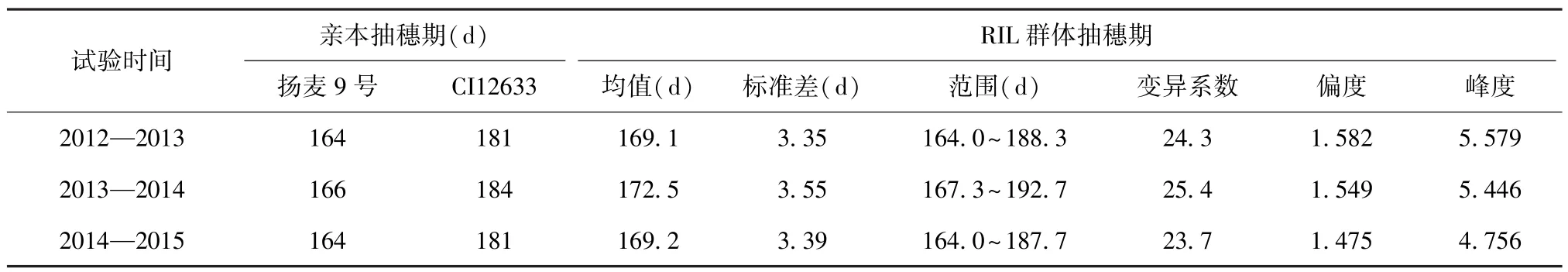
表2 小麦亲本及其RIL群体在3年试验中的抽穗期表现Table 2 Heading date of two parents and their recombinant inbred line(RIL)population of wheat in three years

图1 扬麦9号与CI12633组合的重组自交系群体抽穗期频率分布Fig.1 Frequency distributions of heading date in RIL of Yangmai9#and CI12633
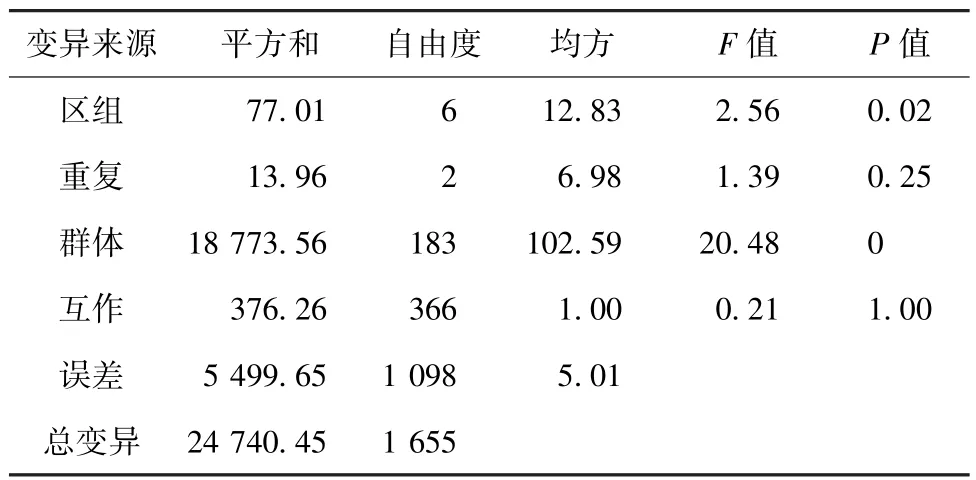
表3 CI12633与扬麦9号组合重组自交系群体的抽穗期方差分析结果Table 3 Analysis of variance of the heading date of the wheat RIL population of CI12633/Yangmai9#
2.4 小麦抽穗期的QTL分析
用复合区间作图法对184个重组自交系群体在3年试验条件下的抽穗期进行QTL定位分析,抽穗期QTL分析结果见表4和图2。从表4可以看出,在3年试验中,共检测到7个与抽穗期相关的QTL,各QTL中控制早抽穗的等位基因均来自亲本扬麦9号。在2012—2013年度到2014—2015年度9次重复试验中分别检测到5个、4个、5个、6个、3个、5个、4个、5个、2个QTL,在各自的试验条件和环境影响下单个QTL分别可解释抽穗期表型变异的7.6%~10.11%、6.36%~12.32%、7.65%~11.31%、6.57%~10.38%、8.25%~9.94%、5.76%~12.48%、8.35%~15.26%、5.86%~10.59%和 7.93%~13.83%。其中能在3年9次试验中都能稳定被检测到的抽穗期相关位点是位于4D染色体上的Qhd-4D,可解释抽穗期表型变异的9.94%~15.26%。位于分子标记barc148至gwm135之间的抽穗期相关位点Qhd-1A-1在3年9次试验中,能被检测到7次,表型贡献率为6.36%~10.83%。位于分子标记Xgpw5191-1至Xmag1163之间的Qhd-4D在本试验中都能被稳定检测到,其表型贡献率最高,为9.94%~15.26%。在分子标记wmc728至gwm371之间的Qhd-5B在本试验中被检测到7次,表型贡献率为5.76%~9.68%。位于 6B染色体分子标记barc178至barc248之间的Qhd-6B位点,在9次试验中被检测到5次,表型贡献率为5.86%~8.47%。在7A染色体中,与抽穗期相关的QTL被检测到2个,分别位于分子标记Xmag794至Xpsp3094之间和gwm282至wmc633之间,在9次试验中分别被检测到3次和4次,表型贡献率分别为7.26%~8.48%和8.25%~9.56%。本试验中检测到的与抽穗期相关的QTL贡献率都比较小,在20%以下,因此在小麦中抽穗期性状是由微效基因共同控制的,并没有检测到主效QTL。
3 讨论
在对某一性状进行研究时,通常会选择在该性状上具有巨大差异的亲本配制遗传群体,这样的群体后代才能在该性状上发生较大分离,便于对该目标性状进行遗传定位研究[31]。本试验中,扬麦9号与CI12633在抽穗期上相差17 d左右。在遗传群体中,抽穗期性状分离较大,这表明两亲本中控制抽穗期的基因相差较大。目标性状在后代中发生分离的主要原因是由于两者之间的基因发生了分离、纯合和重组,不是因为仅仅目标性状上的差异。本研究RIL群体中抽穗期性状偏向扬麦9号,这是由于在历年一粒传的过程中,抽穗期非常迟的单株在成熟前遇到高温或梅雨季节,其生活率发生了改变,使得大多数迟熟单株丢失,导致遗传群体里出现了大量偏向扬麦9号的株系,该问题目前已通过温室栽培等手段进行补救。
关于小麦抽穗期的QTL定位研究报道很多,到目前为止,至少有133个相关QTL被定位在普通小麦的所有染色体组上,其中B基因组被定位到的QTL数量最多,有55个以上。本试验定位在4D染色体上效应最大的QTL(Qhd-4D)位于分子标记Xgpw5191-1与Xmag1163之间,Griffiths等[32]、Zhang等[33]、Sourdille等[34]和 Shindo等[35]都在 4D 染色体上定位到与抽穗期相关的基因(3个抽穗期基因和1个春化基因),Qhd-4D很可能与其中之一为同一位点,这需要进一步验证。位于5B染色体上的Qhd-5B与春化基因同在一染色体上,但它位于分子标记wmc728和gwm371之间,而春化基因并不在其内。Hanocq等[36]和宋彦霞等[37]在5B染色体上分子标记gwm371附近定位到一个早熟基因IEQTL_5B,该基因位置与本研究结果相似,推测很有可能为同一QTL。位于6B染色体上的分子标记barc178和barc248之间的相关位点Qhd-6B,与 Griffiths等[32]在 6B染色体上定位到的抽穗期基因Meta-QTL.B的位置相近,根据Somers等[26]构建的连锁图谱发现分子标记wmc152和barc78之间的遗传距离只有1 cM左右。通过查阅前人报道发现在染色体1A
上存在4个与抽穗期相关的QTL,其中有2个是早熟基因,本研究中所定位到的2个1A染色体上的QTL与其关系还有待于进一步深入研究。前人曾报道在7A上存在多个与抽穗期相关的 QTL[32,35,38],其中早熟基因就有4个,根据遗传图可以确定Qhd-7A-2与Meta-QTL.7A.1为不同位点。其他QTL之间的相关性还需继续研究。

表4 9次试验中抽穗期QTL检测结果Table 4 QTLs for heading date detected in 9 trials
小麦抽穗期属于典型的数量性状,由多个基因位点共同控制,因此其定位结果容易受环境的影响。本试验中每年检测到的QTL数量和数目都不相同,同样同一年的3次重复检测到的QTL数量和数目也不尽相同,这有可能是由于不同小环境的影响所造成的,同一田块中可能有部分地区温度、肥力和光照等条件不均衡。因此本试验重复了3年9次试验,以增加该群体里与抽穗期相关的QTL检测的准确性和精确度。
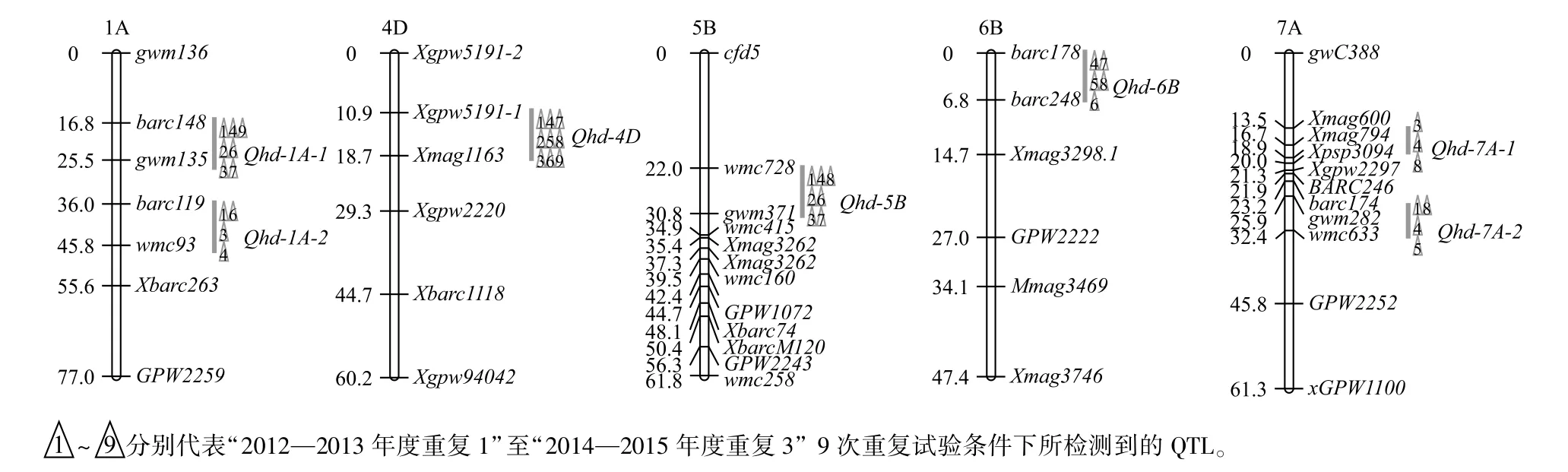
图2 复合区间作图法定位的小麦抽穗期QTLFig.2 QTLs detected by com posite intervalmapping(CIM)for heading date
[1] SNAPE J W,BUTTERWORTH K,WHITECHURCH E,et al.Waiting for fine times:genetics of flowering time in wheat[J].Euphytica,2001,119(1-2):185-190.
[2] BULLRICH L,APPENDINO M,TRANQUILLIG,et al.Mapping of a thermo-sensitive earliness per se gene onTriticum monococcumchromosome 1Am[J].Theoretical and Applied Genetics,2002,105(4):585-593.
[3] LAW C N,SUTKA J,WORLAND A J.A Genetic study of daylength response in wheat[J].Heredity,1978,41:185-191.
[4] SCARTH R,LAW C N.The control of the day-length response in wheat by the group 2 chromosomes[J].Heredity,1984,92(2):140-150.
[5] SCARTH R,LAW C N.A genetic study of daylength in wheat by the group 2 chromosome 2B of wheat[J].Heredity,1983,51: 607-619.
[6] WORLAND A J,BÖRNER A,KORZUN V,et al.The influence of photoperiod genes on the adaptability of European winter wheats[J].Euphytica,1994,100(1-3):385-394.
[7] DANYLUK J,KANE N A,BRETON G,et al.TaVRT-1,a putative transcription factor associated with vegetative to reproductive transition in cereals[J].Plant Physiology,2003,132(4):1849-1860.
[8] TREVASKISB,BAGNALL D J,ELLISM H,et al.MADS box genes control vernalization-induced flowering in cereals[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(22):13099-13104.
[9] YAN L,LOUKOIANOV A,TRANQUILLI G,et al.Positional cloning of the wheat vernalization gene VRN1[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(10):6263-6268.
[10]LIULING Y,ARTEM L,ANN B,et al.The wheat VRN2 gene is a flowering repressor down-regulated by vernalization[J].Science,2004,303(5664):1640-1644.
[11]YAN L,FU D,LIC,etal.Thewheatand barley vernalization gene VRN3 is an orthologue of FT[J].Proceedings of the National A-cademy of Sciences of the United States of America,2006,103(51):19581-19586.
[12]YOSHIDA T,NISHIDA H,ZHU J,et al.Vrn-D4 is a vernalization gene located on the centromeric region of chromosome 5D in hexaploid wheat[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2010,120(3):543-552.
[13]YAN L,HELGUERA M,KATO K,et al.Allelic variation at the VRN-1 promoter region in polyploid wheat[J].Theoretical and Applied Genetics,2004,109(8):1677-1686.
[14]FU D,SZÜCSP,YAN L,et al.Large deletions within the first intron in VRN-1 are associated with spring growth habit in barley and wheat[J].Molecular Genetics and Genomics,2005,274(4):442-443.
[15]VON ZITZEWITZ J,SZUCS P,DUBCOVSKY J,et al.Molecular and structural characterization of barley vernalization genes[J].Plant Molecular Biology,2005,59(3):449-467.
[16]DISTELFELD A,TRANQUILLIG,LIC,et al.Genetic and molecular characterization of the VRN2 loci in tetraploid wheat[J].Plant Physiology,2009,149(1):245-257.
[17]NITCHER R,DISTELFELD A,TAN C,etal.Increased copy number at the HvFT1 locus is associated with accelerated flowering time in barley[J].Molecular Genetics and Genomics:MGG,2013,288(5-6):261-275.
[18]KIPPESN,ZHU J,CHEN A,et al.Finemapping and epistatic interactions of the vernalization gene VRN-D4 in hexaploid wheat[J].Molecular Genetics andGenomics:MGG,2014,289(1):47-62.
[19]HOOGENDOORN J.A reciprocal F1monosomic analysis of the genetic control of time of ear emergence,number of leaves and number of spikelets in wheat(Triticum aestivumL.)[J].Euphytica,1985,34(2):545-558.
[20]王丽辉,张立平,赵昌平,等.小麦挑旗期和抽穗期的QTL分析[J].分子植物育种,2008,6(4):689-694.
[21]BULLRICH L,APPENDINO L,TRANQUILLIG,etal.Mapping of a thermo-sensitive earliness per se gene onTriticum monococcumchromosome 1A(m)[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2002,105(4):585-593.
[22]LAURIE D A,PRATCHETTN,SNAPE JW,et al.RFLPmapping of fivemajor genes and eight quantitative trait loci controlling flowering time in a winter x spring barley(Hordeum vulgareL.)cross[J].Genome/National Research Council Canada=Genome/Conseil National de Recherches Canada,1995,38(3):575-585.
[23]姜宗庆,封超年,刘 萍,等.施磷量对不同类型专用小麦产量及剑叶相关生理特性的影响[J].江苏农业科学,2013,41(1):76-80.
[24]SHARP P J,CHAO S,DESAI S,et al.The isolation,characterization and application in theTriticeaeof a set of wheat RFLP probes identifying each homoeologous chromosome arm[J].Theoretical and Applied Genetics,1989,78(3):342-348.
[25]RODER M S,KORZUN V,WENDEHAKE K,et al.A microsatellite map of wheat[J].Genetics,1998,149(4):2007-2023.
[26]SOMERSD J,ISAACP,EDWARDSK.A high-densitymicrosatellite consensusmap for bread wheat(Triticum aestivumL.)[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2004,109(6):1105-1114.
[27]PAUX E,SOURDILLE P,SALSE J,etal.A physicalmap of the1-gigabase bread wheat chromosome 3B[J].Science,2008,322(5898):101-104.
[28]ELLISH,SPIELMEYERW,GALE R,etal.‘Perfect’markers for the Rht-B1b and Rht-D1b dwarfing genes in wheat[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2002,105(6-7):1038-1042.
[29]FU D,SZÜCSP,YAN L,etal.Large deletionswithin the first intron in VRN-1 are associated with spring growth habit in barley and wheat[J].Molecular Genetics and Genomics,2005,273(1):54-65.
[30]MCCOUCH SR,CHO Y G,YANO M,et al.Report on QTL nomenclature[J].Rice Genet Newsl,1997,14:11-14.
[31]蒋彦婕,朱芳芳,蔡士宾,等.小麦纹枯病抗性QTL遗传分析[J].江苏农业学报,2014,30(6):1222-1226.
[32]GRIFFITHSS,SIMMONDS J,LEVERINGTON M,et al.Meta-QTL analysis of the genetic control of ear emergence in elite European winterwheat germplasm[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2009,119(3):383-395.
[33]ZHANG K,TIAN J,ZHAO L,et al.Detection of quantitative trait loci for heading date based on the doubled haploid progeny of two elite Chinese wheat cultivars[J].Genetica,2009,135(3):257-265.
[34]SOURDILLE P,CADALEN T,GUYOMARCH H,et al.An update of the Courtot x Chinese Spring intervarietalmolecularmarker linkagemap for the QTL detection of agronomic traits in wheat[J].TAG Theoretical and Applied Genetics Theoretische and Gngewandte Genetik,2003,106(3):530-538.
[35]SHINDO C,TSUJIMOTO H,SASAKUMA T.Segregation analysis of heading traits in hexaploid wheat utilizing recombinant inbred lines[J].Heredity,2003,90(1):56-63.
[36]HANOCQ E,NIARQUIN M,HEUMEZ E,et al.Detection and mapping of QTL for earliness components in a bread wheat recombinant inbred lines population[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2004,110(1):106-115.
[37]宋彦霞,景蕊莲,霍纳新,等.普通小麦(T.aestivnmL.)不用作图群体抽穗期QTL分析[J].中国农业科学,2006,39(11):2186-2193.
[38]BENNETTD,IZANLOO A,EDWARDS J,et al.Identification of novel quantitative trait loci for days to ear emergence and flag leaf glaucousness in a bread wheat(Triticum aestivumL.)population adapted to southern Australian conditions[J].TAG Theoretical and Applied Genetics Theoretische and Angewandte Genetik,2012,124(4):697-711.
(责任编辑:张震林)
吴旭江1,2, 臧淑江1, 程 凯1, 张伯桥1, 张 勇1
(1.江苏里下河地区农业科学研究所/农业部长江中下游小麦生物学与遗传育种重点实验室,江苏 扬州 225007;2.扬州大学粮食作物现代产业技术协同创新中心,江苏 扬州 225009)
为了对小麦抽穗期进行QTL初步定位,并进行遗传分析,以CI12633×扬麦9号重组自交系(RIL)为材料,在3年9次试验中,记载小麦抽穗期,采用复合区间作图法进行小麦抽穗期QTL分析。共检测到7个QTL,分别位于1A、4D、5B、6B和7A 5条染色体上,贡献率为5.76%~15.26%。其中位于4D染色体上分子标记Xgpw5191至Xmag1163之间的Qhd-4D基因在3年9次试验中都被检测到,是一个稳定表达的与抽穗期相关的基因。同时,不同环境条件下检测到不同的抽穗期QTL,说明环境对小麦抽穗期影响较大。
小麦;抽穗期;QTL
QTL mapping of heading date of wheat recombinant inbred line population
WU Xu-jiang1,2, ZANG Shu-jiang1, CHENG Kai1, ZHANG Bo-qiao1, ZHANG Yong1
(1.Institute of Agricultural Sciences of the Lixiahe District in Jiangsu Province/Key Laboratory ofWheat Biology and Genetic Breeding in the Middle and Lower Yangtze River,Ministry of Agriculture,Yangzhou225007,China;2.Co-Innovation Center for Modern Production Technology of Grain Crops,Yangzhou University,Yangzhou225009,China)
A recombinant inbred line(RIL)population derived from a cross between two common wheat cultivars CI12633/Yangmai9#was used for QTLmapping of heading date.Data was collected from 9 repeated trials in three years.Seven QTLs located on chromosomes 1A,4D,5B,6B and 7A were detected,contributing 5.76%to 15.26%to the total phenotypic variation by composite interval mapping(CIM).The geneQhd-4Don 4D,between markerXgpw5191andXmag1163,detected in all nine trials,was a stable expression gene related to heading date.Various QTLswere detected in different environments,suggesting that heading date is sensitive to environment.
wheat(Triticum aestivumL.);heading date;QTL
S512.103.2
A
1000-4440(2015)06-1199-07
吴旭江,臧淑江,程 凯,等.小麦重组自交系群体抽穗期QTL分析[J].江苏农业学报,2015,31(6):1199-1205.
10.3969/j.issn.1000-4440.2015.06.002
2015-07-29
江苏省自然科学基金青年基金项目(BK20130457);扬州市2014自然科学基金面上项目(YZ2014067);江苏省农业科技自主创新基金项目[CX(13)2022];现代农业产业技术体系建设专项基金项目(CARS-3-1-1);国家科技支撑计划项目(2011BAD35B03)
吴旭江(1982-),男,江苏盐城人,博士,助理研究员,主要从事小麦遗传育种研究。
张 勇,(E-mail)wheat@wheat.org.cn

