用自然13C丰度法区分人工林根源呼吸的原理与应用
宋文琛,同小娟†,张劲松,孟平,李俊
(1.北京林业大学林学院,100083,北京;2.中国林业科学研究院林业研究所国家林业局林木培育重点实验室,100091,北京;3.中国科学院地理科学与资源研究所陆地水循环及地表过程重点实验室,100101,北京)
用自然13C丰度法区分人工林根源呼吸的原理与应用
宋文琛1,同小娟1†,张劲松2,孟平2,李俊3
(1.北京林业大学林学院,100083,北京;2.中国林业科学研究院林业研究所国家林业局林木培育重点实验室,100091,北京;3.中国科学院地理科学与资源研究所陆地水循环及地表过程重点实验室,100101,北京)
将土壤呼吸分为土壤微生物呼吸、纯根呼吸和根际微生物呼吸的研究对定量评价陆地生态系统地下碳平衡具有重要的意义。理论上,自然13C丰度法是区分林木根源呼吸组分的最佳方法,但目前却难以将其应用于野外实践。本研究以黄河小浪底刺槐人工林为研究对象,利用自然13C丰度法对该人工林纯根呼吸和根际微生物呼吸进行区分,分析不同月份纯根呼吸和根际微生物呼吸在土壤呼吸中所占比例的变化,讨论环境因子对区分纯根呼吸和根际微生物呼吸研究的影响。结果表明:7、8和9月植物旺盛生长季,纯根呼吸占根源呼吸的比例分别为43%、52%和27%;根际微生物呼吸占根源呼吸的比例分别为57%、48%和73%;土壤温度和电导率对纯根呼吸和根际微生物呼吸占土壤呼吸比例及其标准偏差(SD)有一定影响。
自然13C丰度法;刺槐人工林;纯根呼吸;根际微生物呼吸
土壤呼吸是陆地生态系统最大的碳源[1]。土壤呼吸主要由根呼吸和土壤微生物呼吸组成,二者对环境因子的响应存在一定的差异;因此,在估算土壤碳存储潜力及建立土壤呼吸模型时必须对根呼吸和土壤微生物呼吸加以区分[2]。根呼吸(既根源呼吸)可分成纯根呼吸和根际微生物呼吸。区分纯根呼吸和根际微生物呼吸的意义主要体现在:土壤和植物中碳平衡的评估、对有机物质中根际土壤微生物量的评估、腐殖质的完全统计等[3]。
森林土壤呼吸组分的细微变化会引起全球碳平衡的明显改变[4]。定量区分森林土壤呼吸成分的构成是评价陆地生态系统碳平衡的重要基础[5-6]。中国人工林面积超过4 000万hm2,占林分净增面积的75%和林分总碳汇的47.8%,拥有巨大的增汇潜力[7-8]。中国主要的森林土壤碳库都集中在华北人工林[8-9]。对于碳库增加还是减少的问题,不同土壤呼吸模型所得出的结论存在很大差异[10];因此,研究华北人工林土壤呼吸组成成分变化对准确评估土壤呼吸在全球碳循环中的作用具有重要意义,土壤呼吸组分区分方法的准确可靠十分必要[11]。近年来,尽管区分纯根呼吸和土壤微生物呼吸的研究取得了大量的研究进展,但对林木根呼吸的区分,尤其是对纯根呼吸和根际微生物呼吸的区分研究比较缓慢。此外,大部分研究还只停留在室内实验水平上。D.L.Kelting等[12]开展了区分木本植物根源呼吸的野外研究,但该研究由于实验过程对土壤和林木根系干扰强烈,于是造成所得结果误差和不确定性过大[13]。目前,利用同位素法区分木本植物根源呼吸的野外实验则极少涉及[13]。与草本植物相比,木本植物不仅难以对其进行控制实验,而且破坏生境和扰动所造成的误差也不可忽略。大部分同位素方法都需要外来同位素标记[5]。人为同位素标记不但昂贵而且标记范围有限,对于植物个体小、根系短的生态系统可以应用该方法[14],对于森林则不适用[15]。尽管自然13C丰度法在应用上存在 δ13C扩散分馏、微生物活性限制以及需要C3与C4植物不同分馏途径导致的δ13C差异等问题[11],但目前该方法仍是森林生态系统区分根源呼吸最有的效途径之一[16]。
华北人工林是华北平原的重要生态屏障,一直是我国林业生态建设的重点。对该地区人工林生态系统土壤呼吸组分的区分研究,将有助于评估退耕还林等林业生态工程的生态效益。笔者以黄河小浪底刺槐(Robinia pseudoacacia)人工林为研究对象,利用自然13C丰度法区分该人工林纯根呼吸和根际微生物呼吸,分析不同月份环境因子对土壤呼吸各组分占总呼吸比例的影响,为解决自然13C丰度法在野外研究中存在的困难提供理论基础,并为未来土壤碳循环研究提供参考。
1 研究地概况
本研究在国家林业局黄河小浪底森林生态系统定位研究站(E 112°28′,N 35°01′;海拔410 m)开展。站区属暖温带大陆性季风气候,年平均气温为12.4~14.3℃,年降水量为641.7 mm,其中6—9月的降水量占全年降水量的68.3%。本研究所选取的林分以刺槐人工林为主。刺槐人工林位于半阳坡中部的退耕还林地,林龄为43 a。样地土壤类型为褐土,平均土层厚度1.2 m。
2 研究方法
2.1 样品采样与分析
2013年3月在刺槐人工林内建立1个林窗:移除地面植物,清理出1个直径10 m的圆形区域,以后保持这个圆形区域不生长植物[17]。林窗离主要采样区较近,面积足够大,采样深度较深,气象因子的影响可以忽略;土壤微生物不挑剔它们的有机营养来源[18];林窗保持一段时间的无根状态后,土壤微生物因驯化而保持了原来的活性并且通过新陈代谢使自身的δ13C值与土壤有机质(SOM)的δ13C值接近[19]:因此,基本排除了可能引起土壤碳同位素分馏的环境因子,认为林窗样地中心的土壤样品可以反映无根条件下森林土壤有机质的δ13C值。
2013年6月在挖好的土壤截面中将3个50 cm长的不绣钢钢管随机水平插入土壤50 cm处,在出气口一端用塑料封口膜密封好后将土壤填回。钢管插入土壤的一端安装有孔纱网。有孔纱网能使土壤气体扩散进来,同时阻止了土壤颗粒进入钢管内。待钢管内外气体达到平衡状态后(约1个月),取样时将管内气体抽出。管内气体经过1个月的扩散平衡,抽出的气样中的δ13C可以代表这一段时间土壤气体的平均状况。对照组气体样品用GVP土壤气体采集套装(Pelican,Torrance,Ca.,USA)在同一深度(50 cm)采集。
取样时应先抽气,以避免取土和取根时对气样产生影响。抽气前,气袋应确保真空且不漏气。抽气时,电动气泵以≤200 mL/min的速率将土壤气体抽入500 mL气袋中。抽气结束后,在抽气处原地用土钻取土并挖取根系样品。无根土壤样品在林窗的正中心取样,取样深度为50 cm。所采土样先进行酸化处理以去除土壤中所含的碳酸盐。根系样品取回实验室后烘干并研磨成粉状。气体、土壤和根系样品的δ13C值均由DELTA V Advantage同位素比率质谱仪、Flash EA1112 HT元素分析仪(Thermo Fisher Scientific,Inc.,USA)测得,测定精度为δ13C<±0.1‰。
2.2 数据处理
稳定同位素法利用C3和C4植物呼吸途径不同造成的δ13C值差异区分出根呼吸[20-21]。 根据二端元混合模型,根源呼吸占总呼吸的比例frhiz和有机质呼吸占总呼吸的比例fBR分别用下式得出:

式中CG、CS和CR分别为土壤气体、土壤有机质和植物根组织的δ13C值,‰。
根据稳定同位素法的原理,关联微生物生物量的自然13C丰度法的理论[22],此方法只需测量4个变量就能计算出纯根呼吸和根际微生物呼吸占总呼吸比例。本文参照M.Werth等[13]的推算方法,根际微生物呼吸占总呼吸的比例
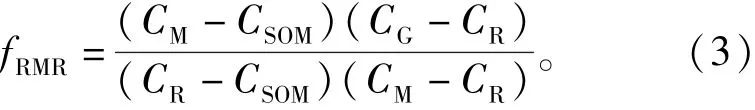
式中:CM为有植物生长的土壤有机质呼吸产生CO2的δ13C,‰;CSOM为无根土壤中有机质呼吸产生CO2的δ13C,‰。
纯根呼吸占总呼吸的比例

对于从不锈钢管中抽取的样品,由于管外的气体是通过扩散作用进入管内,12CO2的扩散系数是13CO2的1.004 4倍[23];因此,管内气体δ13C值因这种分馏效应而与管外不同。管内CO2气体δ13C值应与CO2刚产生时存在差值(CO2气体扩散分馏值),将这一差值设为k/‰[24],则CG与管内气体δ13C值CT的关系为

3 结果与分析
3.1 野外应用自然13C丰度法原理的论证
根据林窗法区分土壤呼吸的原理,在林窗正中心所取的土壤样品可以代表该林地无根土壤的情况[25]。由图1可得,林窗正中心土壤有机质的δ13C值随深度的变化:较深层(≥35 cm)土壤有机质δ13C值与深度之间存在显著的正相关关系(R2=0.970, P<0.001);浅层土壤(<35 cm)有机质δ13C值与较深层(≥35 cm)的差异较大。通常情况下,土壤有机质δ13C值会随深度的增加而增大[26];但浅层土壤(<35 cm)的有机质δ13C值显著比深层(≥35 cm)的小。浅层土壤(<35 cm)显著不符合规律的现象可能是因为深度较浅的土壤受到如凋落物、水文、气象条件等不可忽略的影响:因此,在研究土壤SOM的δ13C值随深度变化时须舍去浅层土壤(<35 cm)有机质δ13C值。
自然13C丰度法是利用C3、C4植物与土壤因不同呼吸途径导致的同位素差异而区分出根源呼吸;然而,该方法不能用于只有C3植物的森林生态系统,因为纯C3生态系统根系与土壤有机质呼出CO2的δ13C几乎没有差异[27]。此外,如果二者差异过小也会使二端元混合模型的误差过大而失效[28]。纯C3人工林存在环境因子导致的同位素分馏和人工林种植前后土地利用不同导致的同位素差异,这2种自然同位素差异或许可以解决纯C3人工林没有C3和C4同位素分馏的问题。
在C3系统中,无根土壤有机质呼吸产生CO2的δ13C(CSOM)与根源呼吸产生CO2的δ13C(Crhiz)由于扩散、淋溶、分解率不同等原因而存在2‰~4‰的差异[29]。这种小差异可以满足稳定同位素法的前提条件[30]。理论上,这种效应随深度的增加而加强,即在无根情况下,土壤有机质δ13C会随土壤深度增加而逐渐增大[26];因此,如果土壤有机质随深度变化能导致2‰~4‰的δ13C差异,则说明该途径能够应用于自然13C丰度法。在土壤深度100 cm之内,无根土壤有机质 δ13C的变化范围不足1‰(图1),并不能满足自然13C丰度法的前提条件。人工林种植前后土地利用不同导致的同位素差异来源于深层土壤缓慢的更新速度[31]。虽然土壤表层更新一次仅需数年,但在较深层,以30 cm土深为例,更新1次则需超过4 000年[32-33]。本研究的人工林样地在退耕还林前曾种植过玉米(Zea mays L.),距今已超过40年。C3植物δ13C约为-24‰~-29‰,C4植物约为-12‰~-14‰[21]。笔者采集到的土壤有机质的δ13C值范围在-19‰~-23‰之间,属于C3和C4的混合土。这说明由于土壤有机物的循环周期较长,退耕前种植玉米遗留下的土壤同位素的影响还未彻底消褪,土壤与植物根组织平均约7‰的差异足以满足稳定同位素法的前提条件[26]。
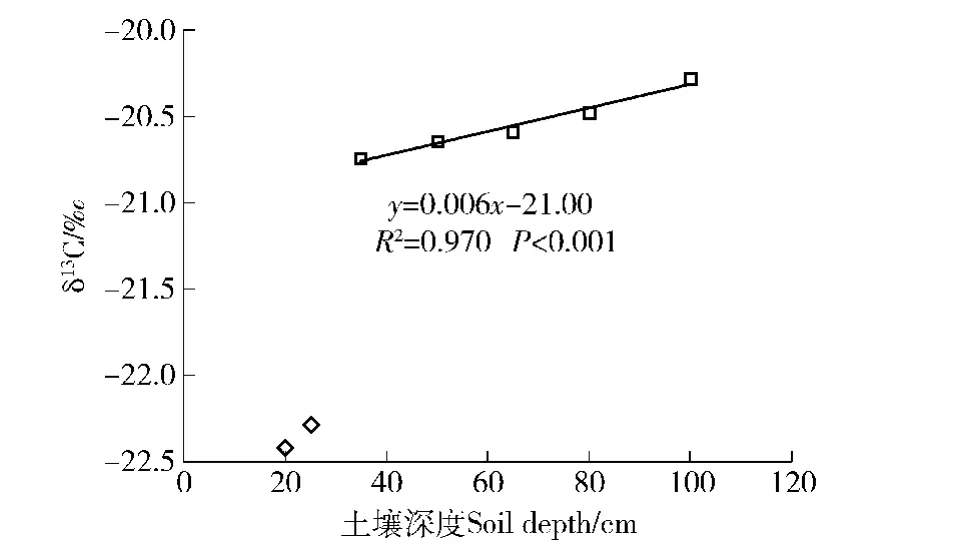
图1 林窗≥35 cm土壤有机质δ13C值随深度的变化Fig.1 Variation of the δ13C value of soil organic matters with soil depth(≥35 cm)in the forest gap
自然13C丰度法区分根源呼吸的一个前提条件是土壤微生物必须有足够的活性。M.Werth等[34]对自然13C丰度法区分根源呼吸的研究指出,由于实验室的土壤微生物对C4玉米(植物)有机质分解能力不强,微生物活性不高导致实验失败。与室内实验研究相比,野外实验中土壤微生物活性比较高[13];取样点在土壤较深处,树木根系能有效地将营养物质输送到这一深度[35];由于土壤深度所造成的隔离,土壤13C丰度受其他环境因子影响较小。然而,随着土壤深度的增加,土壤有机质质量分数也随之下降,土壤微生物活性也由此而降低[36];因此,取样深度不能太深。考虑到植物有效根深为60~78 cm[37],同时测定深度也不能太浅,以免因不能满足实验所需植物与土壤δ13C差异而失败;因此,本研究的取样深度选在土壤50 cm处。
采气管外的气体通过扩散作用进入管内,因此,管内CO2气体δ13C值因这种分馏效应而与管外不同。研究表明,管内CO2气体δ13C值应与其刚产生时的差值(CO2气体扩散分馏值)为13C达到最大扩散分馏时的值-4.4‰[24]。理论上,GVP土壤气体采集套装抽取的气体未经扩散,采气管中的气体则经过扩散而分馏。对比2种抽气方法在50 cm处随机抽取的土壤气体的δ13C值发现,野外条件下的CO2气体扩散分馏值k达不到理论上最大扩散时的-4.4‰(图2)。最终测得k约为-2.0‰(图2)。
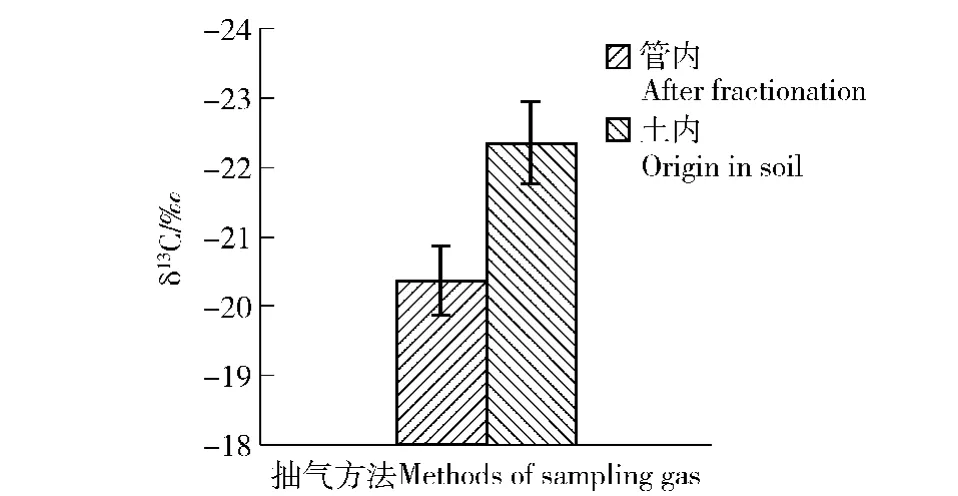
图2 土壤50 cm处用采气管(管内)和用GVP土壤气体采集套装(土内)所得土壤气体δ13C值的对比(n=5)Fig.2 Comparison of δ13C value of forest soil gas obtained by the soil gas sampling tube and the GVP gas sampling instrument at the 50 cm soil depth(n=5)
3.2 土壤环境因子对根源呼吸组分的影响
由表1可得,3种呼吸组分占总呼吸比例随季节变化而有所不同。与9月相比,7、8月土壤温度较高且变化不大。7月和8月的纯根和根际微生物呼吸组分比例接近。与7、8月相比,9月根际微生物呼吸占土壤呼吸比例上升约7%,纯根呼吸占土壤呼吸比例下降约6%。这说明纯根和根际微生物呼吸组分占总呼吸比例受土壤温度影响。土壤微生物呼吸占土壤呼吸的比例与温度的关系不显著(P>0.05),而该地区土壤呼吸速率与土壤温度显著相关[38-39]。这表明土壤呼吸速率的变化主要是由根源呼吸的变化引起的。7—9月土壤含水量差异并不显著(P>0.05)。土壤水分含量对根源呼吸的变化量并无显著影响(表1)。实验地属于土壤有机质变化甚微的成年林,且根生物量仅有17.3 kg/ m3,不足以影响根源呼吸[39]。植物根系与土壤间的相互作用会造成根源呼吸的变化[40],7—9月纯根与根际微生物呼吸占总呼吸比例变化明显,说明土壤呼吸变化的主要来源是根系及其衍生的微生物呼吸的变化。本研究表明定量区分纯根和根际微生物呼吸组分对研究引起土壤呼吸变化的机制十分重要。
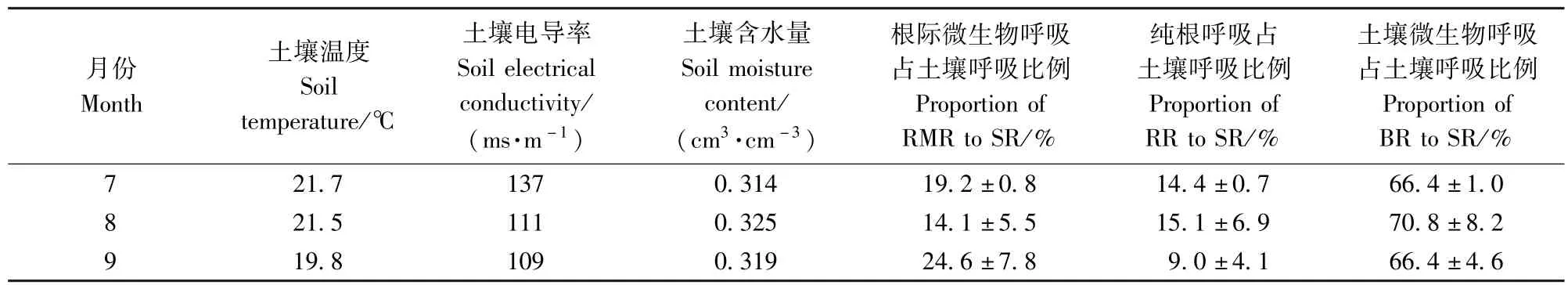
表1 刺槐人工林3种呼吸组分的区分结果(n=3)Tab.1 Partitioning of soil respiration of the Robinia pseudoacacia plantation(n=3)
8月和9月3种呼吸组分占总呼吸比例的标准偏差(SD)显著高于7月。土壤电导率反映了土壤水分、盐分、微生物等的综合状况。土壤电导率的变化会对土壤微生物产生胁迫[41]。这可能是低电导率的环境胁迫促使土壤微生物群落分化,导致土壤异质性增强[41],从而使3种呼吸组分占总呼吸比例的SD增大。
4 结论与讨论
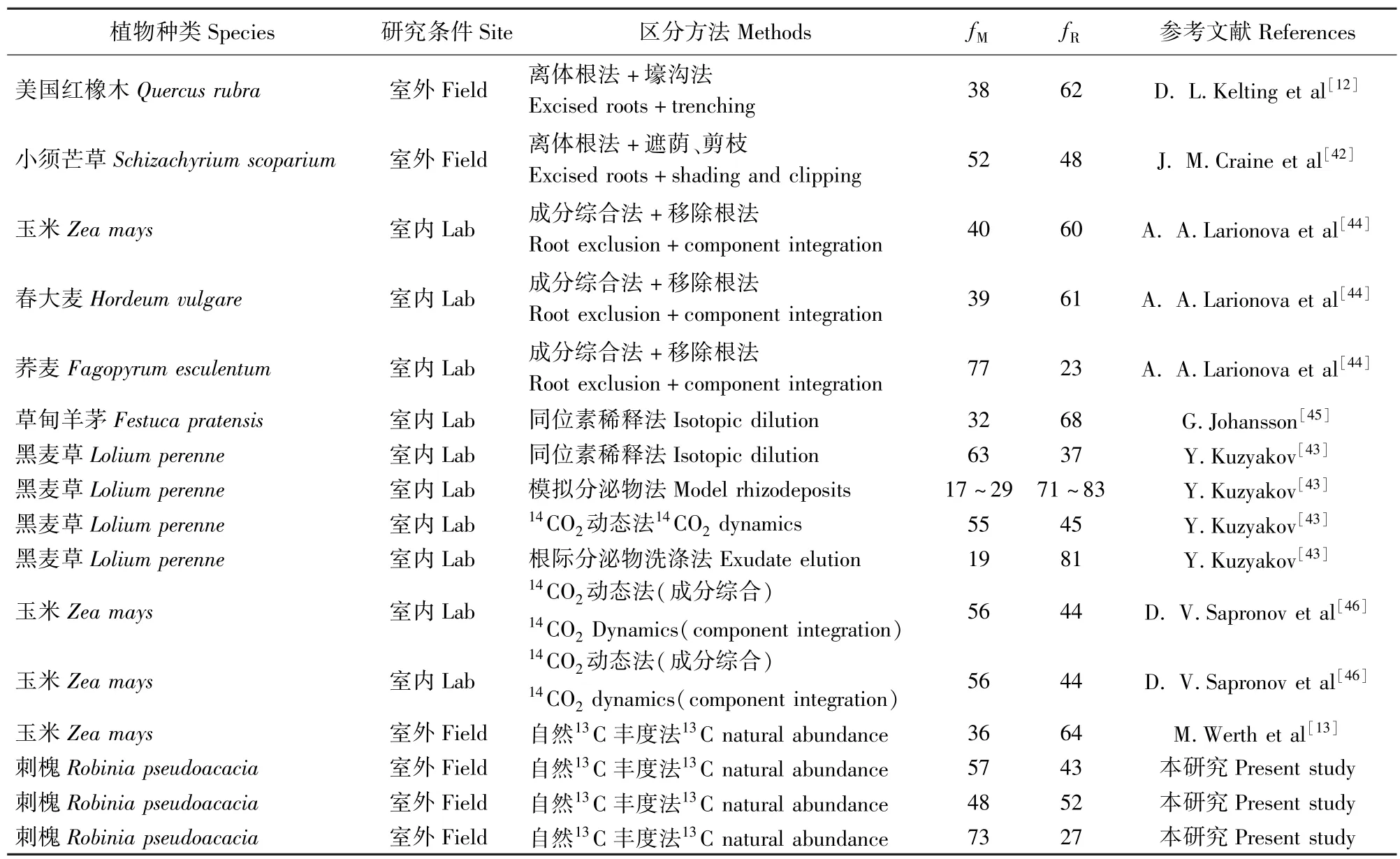
表2 不同方法区分纯根呼吸和土壤微生物呼吸所得结果的比较Tab.2 Root and rhizomicrobial respiration obtained by different methods
前人研究发现,草本植物的纯根和根际微生物呼吸占根源呼吸比例均分别约为50%,其中野外条件下分别约为56%和44%[13]。本研究在7月和8月得出3种呼吸组分占总呼吸比例的结论与J.M. Craine等[42]和Y.Kuzyakov[43]在水分、温度、光照等环境因子相似的草本植物生长的土壤所得结果接近。这表明植物物种对区分纯根和根际微生物呼吸的结果影响比较小(表2)。在植物生长季(9月),根际微生物呼吸占根源呼吸比例高达73%(表2),这与M.Werth等[34]所得出活性低的土壤微生物容易导致自然13C丰度法高估纯根呼吸的结论不一致。这可能是因为大型木本植物根际微生物远比小型草本植物活跃,从而避免了因微生物活性所导致的误差。本研究与D.L.Kelting等[12]用离体根法+壕沟法所得出的结论差异较大(表2)。其原因可能与非同位素法对环境的扰动与破坏有关[13]。
本研究利用自然13C丰度法对人工林纯根呼吸进行了区分,发现:根际微生物呼吸、纯根呼吸和土壤微生物呼吸平均占土壤呼吸比例分别为19.2%、14.4%、66.4%(7月),14.1%、15.1%、70.8%(8月)和24.6%、9.0%、66.4%(9月)。较高的土壤温度有利于提高纯根呼吸占土壤呼吸比例;根际微生物呼吸占土壤呼吸比例则在温度较高时出现下降。土壤电导率会影响3种呼吸组分占总呼吸比例的SD。本研究表明自然13C丰度法适用于林木区分纯根呼吸和根际微生物呼吸的研究,未出现M. Werth等[34]发现的高估纯根呼吸现象。本研究在不同时段区分3种呼吸组分的结果存在一定差异,表明纯根呼吸和根际微生物呼吸随环境的变化而变化。
[1] Raich J W,Potter C S,Bhagawati D.Interannual variability in global soil respiration[J].Global Change Biology,2002,8(8):800- 812
[2] 金钊,董云社,齐玉春.综论土壤呼吸各组分区分方法[J].地理科学进展,2006,25(4):22- 33
[3] Kuzyakov Y,Larionova A A.Contribution of rhizomicrobialand root respiration to the CO2emission from soil(areview)[J].Eurasian Soil Science,2006,39(7):753-764
[4] Atarashi-Andoh M,Koarashi J,Ishizuka S,et al.Seasonal patterns and control factors of CO2effluxes from surface litter,soil organic carbon,and root-derived carbon estimated using radiocarbon signatures[J].Agricultural and Forest Meteorology,2012,152:149- 158
[5] 金钊,董云社,齐玉春.区分纯根呼吸和根际微生物呼吸的争议[J].土壤,2008,40(4):517- 522
[6] Hanson P J,Edwards N T,Garten C T,et al.Separating root and soil microbial contributions to soil respiration:A review of methods and observations[J].Biogeochemistry, 2000,48:115- 146
[7] 方精云,郭兆迪,朴世龙,等.1981—2000年中国陆地植被碳汇的估算[J].中国科学:D辑 地球科学, 2007,37(6):804- 812
[8] 郭兆迪,胡会峰,李品,等.1977—2008年中国森林生物量碳汇的时空变化[J].中国科学:生命科学,2013, 43(5):421- 431
[9] Pan Y D,Birdsey R A,Fang Jingyun,et al.A large and persistent carbon sink in the world's forests[J].Science,2011,333:988- 993
[10]黄耀,孙文娟,张稳,等.中国陆地生态系统土壤有机碳变化研究进展[J].中国科学:生命科学,2010, 40:577- 586
[11]杨玉盛,董彬,谢锦升,等.林木根呼吸及测定方法进展[J].植物生态学报,2004,28(3):426- 434
[12]Kelting D L,James A B,Gerry S E.Estimating root respiration,microbial respiration in the rhizosphere,and root-free soil respiration in forest soils[J].Soil Biology and Biochemistry,1998,30(7):961- 968
[13]Werth M,Kuzyakov Y.Three-source partitioning of CO2efflux from maize field soil by13C natural abundance[J]. Journal of Plant Nutrition and Soil Science,2009,172: 487- 499
[14]耿元波,史晶晶.碳同位素在草地土壤呼吸区分中的应用[J].中国农业科学,2012,45(17):3541- 3550
[15]魏书精,罗碧珍,魏书威,等.森林生态系统土壤呼吸测定方法研究进展[J].生态环境学报,2014,23(3): 504- 514
[16]Kuzyakov Y.Sources of CO2efflux from soil and review of partitioning methods[J].Soil Biology and Biochemistry, 2006,38(3):425- 448
[17]Nakane K,Kohno T,Horikoshi T.Root respiration before and just after clear-felling in a mature deciduous, broad-leaved forest[J].Ecology Research,1996,11:111-119
[18]Kuzyakov Y,Xu Xingliang.Competition between roots and microorganisms for nitrogen:mechanisms and ecological relevance[J].New Phytologist,2013,198:656- 669
[19]Santruckova H,Bird M I,Lloyd J.Microbial processes and carbon-isotope fractionation in tropical and temperate grassland soils[J].Function Ecology,2000,14:108- 114
[20]王兵,姜艳,郭浩,等.土壤呼吸及其三个生物学过程研究[J].土壤通报,2011,42(2):483- 490
[21]O'Leary M H.Carbon isotopes in photosynthesis[J].Bioscience,1988,38:328- 336
[22] Kuzyakov Y.Theoretical background for partitioning of root and rhizomicrobial respiration by13C of microbial biomass[J].European Journal of Soil Biology,2005,41 (1/2):1- 9
[23]Cerling T E.The stable isotopic composition of modern soil carbonate and its relationship to climate[J].Earth and Planetary Science Letters,1984,71:229- 240
[24]丁平,沈承德,王宁,等.鼎湖山季风常绿阔叶林土壤CO2气体碳同位素组成、更新特征及来源比例[J].科学通报,2010,55(9):779- 787
[25]Brumme R.Mechanisms of carbon and nutrient release and retention in beech forest gaps[J].Plant and Soil, 1995,168/169:593- 600
[26]Kramer C,Gleixner G.Soil organic matter in soil depth profiles:Distinct carbon preferences of microbial groups during carbon transformation[J].Soil Biology and Biochemistry,2008,40:425- 433
[27]Susfalk R B,Cheng W X,Johnson D W,et al.Lateral diffusion and atmospheric CO2mixing compromise estimates of rhizosphere respiration in a forest soil[J].Canadian Journal of Forest Research,2002,32:1005- 1015.
[28]Parnell A C,Inger R,Bearhop S,et al.Source partitioningusing stable isotopes:coping with too much variation [J/OL].2010,Plos One,5(3):e9672
[29]Bowling D R,Pataki D E,Randerson J T.Carbon isotopes in terrestrial ecosystem pools and CO2fluxes[J]. New Phytologist,2008,178:24- 40
[30]Millard P,Midwood A J,Hunt J E,et al.Quantifying the contribution of soil organic matter turnover to forest soil respiration,using natural abundance δ13C[J].Soil Biology and Biochemistry,2010,42:935- 943
[31]于贵瑞,王绍强,陈泮勤,等.碳同位素技术在土壤碳循环研究中的应用[J].地理科学进展,2005,20(5): 568- 577
[32]陶贞,沈承德,易惟熙,等.土壤碳动力学同位素示踪研究进展[J].地球科学进展,2004,19(5):793- 801
[33]Wang Y,Hsieh Y P.Uncertainties and novel prospects in the study of the soil carbon dynamics[J].Chemosphere, 2002,49:791- 804
[34]Werth M,Subbotina I,Kuzyakov Y.Three-source partitioning of CO2efflux from soil planted with maize by13C natural abundance fails due to inactive microbial biomass [J].Soil Biology and Biochemistry,2006,38:2772-2781
[35]Tefs C,Gleixner G.Importance of root derived carbon for soil organic matter storage in a temperate old-growth beech forest:Evidence from C,N and14C content[J]. Forest Ecology and Management,2012,263:131- 137
[36]Wynn J G,Harden J W,Fries T L.Stable carbon isotope depth profiles and soil organic carbon dynamics in the lower Mississippi Basin[J].Geoderma,2006,131:89-109
[37]Pinheiro E A R,Costa C A G,de Araujo J C.Effective root depth of the Caatinga biome[J].Journal of Arid Environments,2013,89:1- 4
[38]张劲松,孟平,王鹤松,等.华北石质山区刺槐人工林的土壤呼吸[J].林业科学,2008,44(2):8- 14
[39]赵娜,孟平,张劲松,等.华北低丘山地不同土地利用条件下的土壤呼吸比较[J].林业科学,2014,50(2): 1- 7
[40]孙悦,徐兴良,Kuzyakov Yakov.根际激发效应的发生机制及其生态重要性[J].植物生态学报,2014,38(1): 62- 75
[41]孙波,赵其国.红壤退化中的土壤质量评价指标与评价方法[J].地球科学进展,1999,18(2):118- 128
[42]Craine J M,Wedin D A,Chapin F S.Predominance of ecophysiological controls on soil CO2flux in a Minnesota grassland[J].Plant and Soil,1999,207:77- 86
[43]Kuzyakov Y.Separating microbial respiration of exudates from root respiration in non-sterile soils:A comparison of four methods[J].Soil Biology and Biochemistry,2002, 34:1621- 1631
[44]Larionova A A,Sapronov D V,Lopes de Gerenyu V O, et al.The contribution of root respiration of grasses and trees to the CO2emission from the soil[J].Eurasian Soil Science,2006,39(10):1248- 1257
[45]Johansson G.Release of organic C from growing roots of meadow fescue(Festuca pratensis L.)[J].Soil Biology and Biochemistry,1992,24:427- 433
[46]Sapronov D V,Kuzyakov Y.Separation of root and microbial respiration:comparison of three methods[J].Eurasian Soil Science,2007,40(7):775- 784
(责任编辑:程 云)
Partitioning of root respiration and rhizomicrobial respiration in a Robinia pseudoacacia plantation based on13C natural abundance
Song Wenchen1,Tong Xiaojuan1,Zhang Jinsong2,Meng Ping2,Li Jun3
(1.School of Forestry,Beijing Forestry University,100083,Beijing,China;2.Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration,Research Institute of Forestry,Chinese Academy of Forestry,100091,Beijing,China;3.Key Laboratory of Water Cycle and Related Land Surface Processes,Institute of Geographic Sciences and Natural Resources Research,Chinese Academy of Sciences,100101,Beijing,China)
Partitioning soil respiration into root respiration,rhizomicrobial respiration and basal microorganism respiration is of important significance in ecological and pedological studies.The method of δ13C natural abundance is an ideal way in microbial biomass research to partition rhizosphere respiration into root respiration and rhizomicrobial respiration;however,it is difficult to be applied under field conditions.In this study,the method of nature δ13C abundance was used to partition soil respiration into root respiration,rhizomicrobial respiration and basal micro-organism respiration in a Robinia pseudoacacia plantation in the Yellow River Xiaolangdi Ecology Research Station.The difficulties of separating root respiration and rhizomicrobial respiration by δ13C natural abundance in the plantation have been solved in this study,which include:1)the error caused by damage and disturbance,2)ruling out δ13C difference caused by C3and C4photosynthetic pathways between soil and plant,and 3)the problem of soil CO2diffusion fractionation.The δ13C value of the soil ranged from -19‰ to-23‰.It is suggested that carbon isotopic composition of soil organic matters in the deeper soil requires a long time to cycle so that the influence of returning maize cropland to plantation on soil carbon isotope would not vanish completely.The δ13C values of soil organic matters did not change significantly with soil depth,while the δ13C values of rootless soil organic matters had a significantly positive correlation with soil depth.The δ13C fractionation of CO2diffusion in the soil was about 2.0‰,suggesting that the root respiration and rhizomicrobial respiration of the R.pseudoacacia plantation has been successfully separated by13C natural abundance in this study.The results showed that the proportions of root respiration(fR) and rhizomicrobial respiration(fM)were about 43%and 57%in July,52%and 48%in August,and 27% and 73%in September,respectively.fRand fMwere influenced by soil temperature and their standard deviation(SD)was higher under a lower soil conductivity.The method of13C natural abundance is proved to be a suitable approach for partitioning plantation soil respiration into root respiration, rhizomicrobial respiration and basal microorganism respiration.
13C natural abundance method; Pobinia pseudoacacia plantation; root respiration;rhizomicrobial respiration
P461+.4
A
1672-3007(2015)04-0037-07
2014- 09- 28
2015- 05- 01
项目名称:国家自然科学基金“华北低丘山地人工林碳收支和水碳耦合关系对干旱的响应”(31100322);国家林业局公益性行业项目“华北低丘山地人工林水/碳耦合模拟过程研究”(GYHY201104009 -04);北京林业大学科技创新计划项目“季节性干旱对华北低丘山地人工林碳收支和水碳耦合关系的影响”(YX2011 -19,TD2011 -07)
宋文琛(1988—),男,硕士研究生。主要研究方向:森林生态系统与全球变化。E-mail:chenge2412@126.com
†通信作者简介:同小娟(1975—),女,博士,副教授。主要研究方向:气候变化与生态过程。E-mail:tongxjsxbs@sina.com

