猪膝关节软骨全层缺损、软骨下骨损伤后滑液中炎性因子水平变化
刘宪民,杜明昌,柳 椰,邬 波,刘松波,王 琪,项良碧
1.沈阳军区总医院骨科全军重症战创伤救治中心,辽宁沈阳110016;2.沈阳市骨科医院,辽宁沈阳 110044
骨性关节炎是累及关节软骨、软骨下骨及滑膜等组织结构的慢性疾病,是生物学、生物化学、分子生物学及酶的反馈作用等复杂的多种机制相互作用的结果。软骨细胞、骨细胞、滑膜细胞在骨性关节炎的病理进程中,代谢平衡被打乱,代谢产物相互影响,具有能够促进软骨降解、促进滑膜炎症或促进软骨合成等多种作用。炎症因子水平一定程度上反映了骨性关节炎的病理变化。本研究通过建立膝关节软骨全层缺损、软骨下骨外露动物模型,应用自体脂肪来源干细胞(adipose-derived stem cells,ADSCs)移植修复软骨缺损,观察ADSCs移植后不同时间点软骨缺损修复与关节滑液中反应骨、软骨代谢的相关炎性细胞因子,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleakin-1β,IL-1β)和基质金属蛋白酶-13(MMP-13)水平的变化[1-3],以评估 ADSCs移植对关节软骨的修复作用。
1 材料与方法
1.1 材料和仪器 低糖-培养基LG-DMEM(英杰生命科技有限公司);胎牛血清(FBS,GE Healthcare公司);L-谷氨酰胺(广州赛业生物科技有限公司);青霉素、链霉素、胰蛋白酶(广州赛业生物科技有限公司);Ⅰ型胶原海绵(无锡贝迪生物有限公司);Ⅰ型胶原酶(美国 Sigma公司)。IL-1β、TNF-α、MMP-13用酶联免疫吸附法(ELISA)试剂盒(上海蓝基生物科技有限公司)。
1.2 实验分组及猪原代ADSCs的获取 选用6个月龄的巴马小型猪12只,体质量20~25 kg,雌雄不限(由黑龙江省双鸭山市科技小型猪养殖场提供)。采用自体左、右后肢对照,造模后分别采用自体ADSCs移植治疗(A组)及微骨折治疗(B组)。全麻后气管插管辅助通气(沈阳军区总医院动物实验中心),取仰卧位,剃毛、消毒、铺无菌单,采用真空负压吸脂法吸取皮下脂肪约50 g。采用密度梯度离心法分离ADSCs,加入DMEM基础培养液10 ml(含LG-DMEM,10%FBS,L-谷氨酰胺 300 μg/ml,抗坏血酸 50 μg/ml,青霉素、链霉素各 100 U/ml),制成单细胞悬液,采用血球计数板计数法计数获取细胞的数量(获取的细胞用于动物实验)。
1.3 细胞支架的制备 (1)用无菌剪刀将Ⅰ型胶原海绵剪成7 mm×7 mm×3 mm大小的方块,分别放入24孔板中,备用;(2)向软骨分化诱导因子的溶液制备:以转化生长因子β2(TGF-β2)及胰岛素样生长因子-1(IGF-1)为软骨分化诱导因子,利用两种因子的水溶性,配制浓度为20 ng/ml TGF-β2和400 ng/ml IGF-1的溶液;(3)将诱导液加入24孔板中,其中每孔加入诱导液1 ml,利用胶原海绵的吸水性,使胶原海绵支架与诱导液充分接触均匀。混合30 min后,将24孔板放入-80℃冰箱进行预冻8 h。最后将24孔板放入LGJ-冷冻干燥机。冻干后按照不同浓度将Ⅰ型胶原海绵和诱导因子复合支架密封包装,进行60Co照射后备用。
1.4 ADSCs支架复合体细胞的体外复合 取12孔培养板,取6孔,放入支架材料。将Ⅰ期获取的细胞密度调整为5×105个/ml。滴加在海绵支架上,放入培养箱孵育2 h。
1.5 猪关节软骨缺损的制备及修复 全麻状态下,仰卧,取膝关节正中切口,由髌骨内侧进入关节腔,显露关节软骨,分别在内、外髁用7 mm扁凿制备边长为7 mm的正方形软骨全层缺损,涉及软骨下骨。将支架细胞复合物放入软骨缺损部位。每组各3例,以吸收线缝合固定,分层关闭关节腔。术后不固定患肢,动物圈中自由活动,术后3 d给予肌注青霉素240 万 U,肌注2次/d[4-5]。
1.6 术后取材与检测 实验动物分别于术后2、4个月取材,大体观察软骨缺损区修复的形态,与正常组织界面等情况。收集关节内滑液约0.3~0.5 ml,标本送检后,立即 4℃,14 000 r/min,离心20 min,留取上清液待测。ELISA检测 IL-1β、TNF-α、MMP-13 的表达。
2 结果
2.1 软骨缺损修复的大体观察 术后2个月观察:A组:关节面平整,白色膜状物覆盖缺损部位。缺损区由损伤边缘开始出现新生软骨组织,色泽与周围软骨组织相近,质实、有一定的弹性。B组:缺损部位明显凹陷,边缘有类软骨样组织出现,整个缺损部位,颜色深红,与周围软骨组织区别明显。见图1。
术后4个月观察:A组:肉眼观察缺损处关节面平整,可见模糊边界。缺损区覆盖新生软骨组织,色泽与周围软骨组织相近,质实、有一定的弹性。B组:肉眼观察缺损处修复组织表面不整,呈不规则凹陷。缺损边缘修复为类软骨组织,由边缘向缺损中心逐步凹陷,缺损边缘与周围组织边界仔细辨认可区分,修复组织颜色由边缘向中心逐渐变深。见图2。

图1 术后2个月软骨缺损修复大体观察
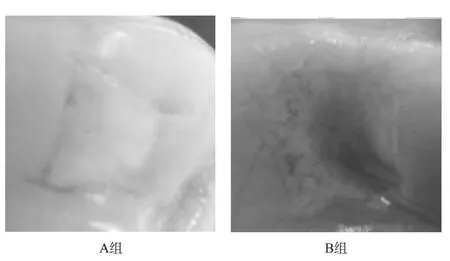
图2 术后4个月软骨缺损修复大体观察
2.2 关节滑液中炎症因子的变化 两组关节滑液术后炎症因子变化见表1。
表1 两组术后炎症因子变化(±s)

表1 两组术后炎症因子变化(±s)
注:A、B 组术后2、4 个月的 IL-1β、TNF-α、MMP-13 表达水平比较,P <0.05;A、B 组自身前后 IL-1β、TNF-α、MMP-13 表达水平比较,P <0.05。
组别 术后时间TNF-α(pg/ml)(月) n IL-1β(pg/ml)MMP-13(ng/ml)个月A 组 2 6 80.46 ±8.92 47.38 ±10.54 69.18 ±9.24 30.55 ±2个月 4个月2个月 4个月2个月 4 11.18 120.74 ±15.92 73.16 ±16.25 B 组 4 6 109.58 ±9.37 92.35 ±11.29 93.82 ±12.56 78.74 ±10.28 189.24 ±17.63 140.38 ±14.82
3 讨论
目前研究认为,骨性关节炎病因学主要有3个方面:一是关节软骨破坏后软骨细胞之间的代谢平衡丧失,二是炎性的滑膜组织释放炎症介质,三是软骨下骨骨细胞代谢平衡丧失。正常情况下,软骨、软骨下骨通过对合成代谢与分解代谢进行调节,维持细胞外基质的平衡。一旦退变或外伤等因素导致了软骨细胞、骨细胞代谢异常,则会引起滑膜的代谢异常。炎性因子的出现会进一步引起软骨的代谢,分解代谢的强度逐渐超过合成代谢,造成软骨基质的丢失,最初造成软骨的粗糙不平以及细小的裂隙,最终致软骨下骨显露[6]。
研究表明,多种细胞因子和生长因子参与了骨性关节炎发生发展的过程,如转移生长因子(transforming growth factor,TGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样因子(insulin-like growth factor,IGF)、胰岛素样因子结合蛋白(insulin-like growth factor binding protein,IGFBP)、IL-1家族、TNF、成纤维生长因子(fibroblast growth factor,FGF)、黏附分子及整合素、基质金属蛋白酶家族(MMPs)、组织金属蛋白酶抑制剂(tissue inhibitor of matrixmetallopreinase,TIMP)以及低氧诱导因子(hypoxia-inducible factor,HIF)。炎症介质大部分均为炎性的滑膜组织分泌,其中IL-l的浸润能够增强关节软骨MMP族中MMP-3、MMP-13的表达,促进软骨基质的降解,刺激软骨细胞和滑膜产生NO,抑制软骨细胞增殖,诱导关节软骨细胞的凋亡[7],加速软骨细胞的退变,从而加剧退行性骨关节病,引起临床上的一系列症状。TNF-α是由激活的巨噬细胞、滑膜细胞产生,有抑制成骨细胞和刺激破骨细胞的作用,是人体内作用最广泛的致炎因子之一。TNF-α一方面可激活MMPs导致关节软骨基质的降解,另一方面,还可作为炎症反应的始动因子,扩大并加重炎症反应,导致关节软骨生存环境的改变,软骨无法获得足够的营养而导致退变[8]。
从治疗上讲,由于软骨的自身能力有限,一般认为直径超过4 mm的软骨缺损不能自行修复。随着医学的发展,多种治疗手段已运用于关节软骨缺损的修复,如关节内清理和灌洗术、关节刨削成形术、软骨下骨钻孔术、微骨折、截骨术等传统治疗方法,但因修复组织以纤维软骨为主,缺少正常透明软骨的力学性能及耐用性,不可避免地会出现退行性变。所以,软骨缺损修复的目标是透明软骨修复,与周围组织的高度整合,提供长期关节表面光整以及一致的机械负载性能。近年来,组织工程的迅速发展,特别是种子细胞体外培养的成熟,可降解生物材料的应用,细胞生长因子的发现,为骨软骨的修复提供了一个合乎生物学原则的思路[9-10]。
本研究利用ADSCs为种子细胞,复合在可缓释诱导因子Ⅰ型胶原海绵支架上,移植修复软骨缺损。通过大体观察可发现,术后2个月ADSCs移植修复组(A组)已经有类软骨组织形成,术后4个月的软骨缺损部位完全修复,并形成透明软骨组织。而且通过检测关节滑液中炎性因子水平的变化,发现脂肪干细胞移植修复组(A组)术后2、4个月后关节滑液中的 IL-1β、TNF-α、MMP-13表达水平均低于微骨折治疗组(B组),且术后4个月的表达水平低于术后2个月的表达水平。根据这一结果,可以推断应用自体ADSCs移植修复软骨缺损,不但可以从结构上重建软骨组织,而且可以改善滑膜、软骨、软骨下骨等组织的异常代谢,从而减轻软骨缺损导致的不适症状。
[1]Constanze B,Parviz S,Bharat BA,et al.Evidence that TNF-β (lymphotoxin α)can activate the inflammatory environment in human chondrocytes[J].Arthritis Res Ther,2013,15(6):R202.
[2]McNulty AL,Rothfusz NE,Leddy HA,et al.Synovial fluid concentrations and relative potency of interleukin-1 alpha and beta in cartilage and meniscus degradation[J].J Orthop Res,2013,31(7):1039-1045.
[3]Goldring MB,Otero M,Plumb DA,et al.Roles of inflammatory and anabolic cytokines in cartilage metabolism:signals and multiple effectors converge uponMMP-13 regulation in osteoarthritis[J].Eur Cell Mater,2011,21:202-220.
[4]杜明昌,刘宪民,祖启明,等.自体脂肪干细胞复合不同初始浓度诱导支架修复猪膝关节软骨缺损的初步观察[J].中华临床医师杂志,2013,6:2523-2527.
[5]刘宪民,杜明昌,刘松波,等.一期获取自体脂肪干细胞复合可缓释诱导因子支架修复猪膝关节软骨缺损的初步研究[J].中华创伤骨科杂志,2012,14(7):608-613.
[6]任红革,崔逢德.细胞因子在骨性关节炎中的表达与应用[J].中国组织工程研究,2012,16(52):9828-9835.
[7]刘健,赵文海.对骨性关节炎发病机制的研究概况[J].辽宁中医药大学学报,2008,10(2):80-82.
[8]Malemud CJ,Islam N,Haqqi TM.Pathophysiological mechanisms in osteoarthritis lead to novel therapeutic strategies[J].Cells Tissues Organs,2003,174(12):34-48.
[9]Buckwalter JA,Brown TD.Joint injury,repair,and remodeling:roles in post-traumatic osteoarthritis[J].Clin Orthop,2004,423:7-16.
[10]ShiehA C,Athanasiou KA.Principles of cell mechanic for cartilage tissue engineering[J].Ann Biomed Eng,2003,31(1):1-11.

