二株鸭源H11N9亚型禽流感病毒的遗传进化及致病性分析
谭 丹,黄建龙,王昌建,何世成,王卫国,唐小明,朱春霞,范仲鑫,汪洪冰,刘道新*,邓国华
(1.中国农业科学院哈尔滨兽医研究所农业部动物流感重点开放实验室/兽医生物技术国家重点实验室,黑龙江哈尔滨 150001;2.长沙市动物疫病预防控制中心,湖南长沙 410006;3.湖南省动物疫病预防控制中心,湖南长沙 410129)
禽流感是由正黏病毒科A型流感病毒属禽流感病毒引起的一种禽类(家禽和野禽)传染病[1],禽流感病毒在野生水鸟、大多数家养水禽、海鸥中广泛存在[2-3]。由于其基因组的分节段性及复制过程中RNA聚合酶缺乏矫正功能,导致AIV变异频繁[4]。一直以来高致病性禽流感对养禽业的严重危害性和公共卫生意义倍受关注。而低致病性禽流感病毒感染家禽后表现温和,但仍存在潜在的临床危险,有可能为高致病性禽流感病毒形成提供基因片段,间接地导致禽流感的暴发流行[5]。
禽流感毒株基因的频繁变异给禽流感的防控带来非常大的难度。本研究对近年来由湖南省洞庭湖区的正常监测样品中分离的2株H11N9亚型禽流感毒株进行HA、NA基因序列比较分析和对SPF鸡致病性的研究,旨在从分子生物学角度了解H11N9亚型禽流感在湖南省洞庭湖区的变异特点、进化规律及致病性特征,为该地区禽流感的防控提供一些理论依据,从而有效预防和控制禽流感,保护人类健康和公共卫生安全。
1 材料与方法
1.1 材料
1.1.1 毒株 2株H11N9亚型禽流感病毒均来自湖南省洞庭湖区正常监测样品,由哈尔滨兽医研究所国家禽流感参考实验室分离保存,病毒命名为:A/DK/HuN/S4013/2011 (H11N9) (简 写 为HuN20114013); A /DK/HuN/ S4443/2011(H11N9)(简写为 HuN20114443)。
1.1.2 实验动物 11日龄SPF鸡胚和4周龄SPF鸡由哈尔滨兽医研究所SPF实验动物中心提供。
1.2 方法
1.2.1 病毒增殖 病毒经血凝抑制试验及PCR扩增鉴定为H11N9亚型,按104~109有限稀释度接种10日龄SPF接胚,每次收取有血凝价且最高稀释度的鸡胚尿囊液作为下一次纯化种毒,如此纯化3次后,以最适合的稀释度接种11日龄SPF鸡胚,48h后收取鸡胚尿囊液,收集的尿囊液经过HA-HI试验验证及无菌检测后,分装,置-70℃保存备用。
1.2.2 PCR扩增及产物的回收 根据GenBank中H11N9亚型禽流感病毒各基因片段序列选择同源性最高的区域设计引物。PCR扩增HA、NA基因片段后,PCR产物在10g/L琼脂糖凝胶上电泳,凝胶成像系统分析鉴定结果,然后按照试剂盒说明书进行PCR产物回收。
1.2.3 HA基因序列的测定 紫外透射仪测定PCR产物的浓度并按测序要求计算所需DNA量,PCR反应结束后加入2.0μL终止液。测序反应产物在终止反应后加入60μL 950mL/L冰乙醇,混匀于-20 ℃ 15min后,12 000r/min 4 ℃ 下 离 心20min,小心弃去上清,加70μL 700mL/L冰乙醇,12 000r/min 4℃下离心10min洗脱残留的盐,重复1次,倒于纸上室温晾干,加入15μL甲酰胺,使DNA沉淀充分溶解,最后全部加入测序板内,并进行高温变性,采用ABI测序仪进行测序。
1.2.4 序列的拼接和分析 病毒各基因片段序列采用DNA Star软件中Seqman程序对测定各个基因的原始序列进行拼接,采用MegAlign程序对各个基因片段进行核苷酸及氨基酸的同源性比较;应用Mega 5软件包对病毒各个基因进行多序列比对和进化树的绘制与分析。
1.2.5 SPF鸡感染试验 按每只106EID50/100μL的病毒悬液鼻腔接种11只SPF鸡,同时放入2只SPF鸡作为同居感染对照,于负压隔离器中饲养。感染后每隔24h采集泄殖腔和喉头拭子放入1mL的含有双抗的PBS中,置-80℃保存,连续采集14 d,拭子接种鸡胚进行病毒滴度测定,以分析其排毒规律。鸡感染后第3天,每个病毒感染鸡群随机处死3只鸡,取组织脏器(脑、胸腺、气管、心、肝、脾、肺、肾、胰脏、盲肠扁桃体、法氏囊)用于病毒分离滴定。
2 结果
病毒的核苷酸序列分析表明,湖南分离的2株H11N9病毒HA基因开放性阅读框为1 698bp,共编码565个氨基酸,其NA开放阅读框为1 713bp,共编码470个氨基酸。
2.1 基因裂解位点、糖基化位点、受体结合位点变异情况
分离的2株H11N9病毒HA裂解位点都为PAIASR/GLF,没有多个碱性氨基酸的插入。2株病毒HA基因均有7个潜在糖基化位点,即26(NNS)、27(NST)、39(NVT)、181NNT)、305(NKS)、496(NGT)和556(NGS)。NA基因上均有7个潜在的糖基化位点,分别为42、52、63、66、87、147、202。HA基因上受体结合位点(以人H3计)T98、T136、A138、S144、W153、H156、Q157、Y161、H183、K189、E190、L194、G225、Q226、A227、G228基本都保守,除HuN20114443受体结合位点144(S)发生改变为N,所有这些位点均不具备人受体结合位点。NA基因上的HB受体结合位点均没发生突变(表1和表2)。
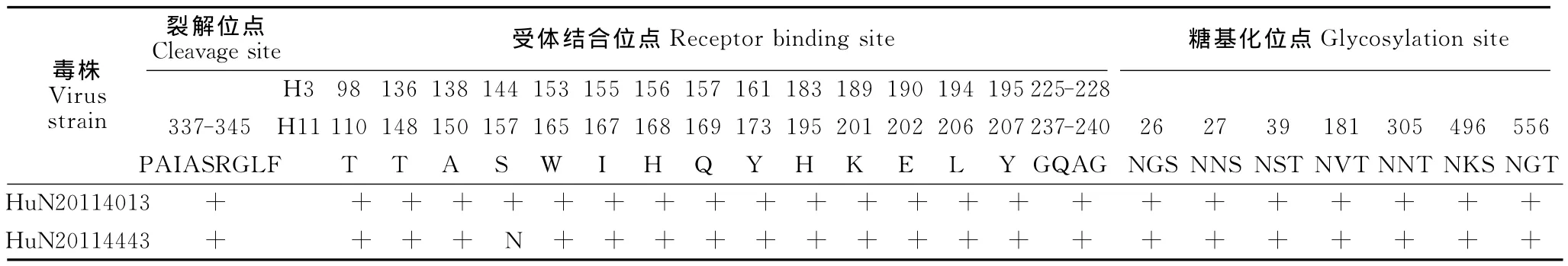
表1 HA基因特征位点氨基酸序列分析Table 1 The analysis of special sites of amino acids in HA gene

表2 NA基因特征位点氨基酸序列分析Table 2 The analysis of special sites of amino acids in NA gene
2.2 HA和NA基因的同源性及遗传进化关系
对2株H11N9病毒HA序列进行遗传演化分析,2株核苷酸同源性为87.0%之间,与参考毒株HA基因序列同源性在88.0%~96.7%,主要分为2大分支,Ⅰ与Ⅱ分支核苷酸同源性较低,同源性在88.0%~89.5%之间,与日本、澳大利亚、越南、荷兰等国家H11参考毒株关系比较密切,可能有共同的祖先来源(图1)。将与其同源性相近的毒株进行进化树分析,这2株NA基因同源性在96.4%之间,处于同一分支株,均与在周边国家野鸟中分离的H11N9亚型毒株关系密切,与其核苷酸同源性在95.9%~98.2%(图2)。

图1 HA基因进化树Fig.1 Phylogenetic tree of HA gene

图2 NA基因进化树分析Fig.2 Phylogenetic tree of NA gene
2.3 感染鸡临床症状及排毒情况
2株H11N9亚型禽流感毒株鼻腔接种SPF鸡后,HuN20114443毒株能使鸡感染并通过喉头和泄殖腔排毒,但HuN20114013毒株不引起鸡泄殖腔排毒,只能在喉头样品中检测到H11N9亚型禽流感病毒,感染的鸡均不表现明显的临床症状。对感染鸡的排毒情况进行连续观察,排毒期主要集中在1d~4d。对同居鸡的喉头和泄殖腔样品也进行了检测,均不能检测到H11N9亚型禽流感病毒,可判断这2株H11N9亚型禽流感毒株均不能使同居鸡感染排毒,说明这些毒株在鸡群中不具有水平传播能力。从感染鸡脏器中病毒的复制情况看,在2个毒株感染鸡的脑、肺脏、肝脏、心脏、肾脏、脾脏、胰腺、法氏囊等组织脏器中均未检到病毒复制。
3 讨论
HA是AIV毒力和宿主特异性的主要决定因素[6],大多数高致病力毒株的HA在其裂解位点附近有多个碱性氨基酸插入,在无类胰蛋白酶的情况下就能发生裂解,造成感染禽全身系统衰竭,导致死亡。分离的2株H11N9亚型禽流感毒株的HA裂解位点为PAIASR/GLF,均没有多个连续的碱性氨基酸插入,属于低致病性病毒。因此,在这2株H11N9亚型禽流感毒对SPF鸡致病性的试验中,只引起SPF鸡短暂的排毒,而感染的鸡均不表现明显的临床症状。
有研究表明流感病毒HA受体特异性及NA唾液酸酶活性剂特异性与病毒感染的宿主范围、组织嗜性及致病力的强弱有关[7-8]。HuN20114443株毒株能使鸡感染并通过喉头和泄殖腔排毒,但HuN20114013毒株不引起鸡泄殖腔排毒,只能在喉头样品检测到H11N9亚型禽流感病毒。本研究2株H11N9毒株其HA的受体结合位点均非常保守,HuN20114443受体结合位点144(S)发生改变为N,是否是由于该位点基因发生突变而导致这2株毒株引起SPF鸡排毒差异还有待研究。
湖南洞庭湖地区作为“东亚-澳大利亚迁徙线”上候鸟和我国候鸟迁徙主要停歇地,候鸟在禽流感跨地域传播中起着很重要的作用[9]。有许多研究表明,在候鸟迁徙地分离的毒株均被发现有不同亚型或同亚型不同基因之间的重组现象[10-11]。本研究中NA基因组序列进行遗传演化分析来看,这2株H11N9亚型禽流感毒株与在周边国家野鸟中分离的H11N9亚型毒株关系密切,与其核苷酸同源性在95.7%~98.2%,说明这些不同亚型毒株之间可能发生了NA基因的重排。提示该地区长期的野鸟迁徙对家鸭AIV的感染影响很大,同时这些毒株在家禽中相互循环使得其内部基因有所变异。因此,继续加强对该地区流感病毒的监测显然具有重要的公共卫生意义。
[1]甘孟侯.禽流感[M].北京:北京农业大学出版社,2002:74-78.
[2]Rachelle R,Webster R G.The influenza virus enigma[J].Cell,2009,136(3):402-410.
[3]Ducatez M F,Webster R G,Webby R J.Animal influenza epidemiology[J].Vaccine,2008,26(4):67-69.
[4]崔尚金.我国禽流感的流行病学调查[D].黑龙江哈尔滨:中国农业科学院哈尔滨兽医研究所,2005.
[5]Cheng C L,Vijaykrishna D,Smith G J,et al.Establishment of influenza virus(H6N1)in minor poultry species in sourthern China[J].J Virol,2007,10:10402-10412.
[6]贾红玲,苏 艳,吴 润,等.禽流感病毒血凝素保守氨基酸对其受体结合位点的影响[J].中国预防兽医学报,2008,30(7):500-504.
[7]Weis W,Brown J H,Cusack S,et al.Structure of the influenza virus haemagglutinin complexed with its receptor,sialic acid[J].Nature,1988,333(6172):426-431.
[8]李井春,赵凤菊,于学成,等.野鸟在禽流感流行病学中的作用研究进展[J].中国畜牧兽医,2010,37(7):178-180.
[9]Ward M J,Lycett S J,Avila D,et al.Evolutionary interac-tions between haemagglutinin and neuraminidase in avian influenza[J].BMC Evol Biol,2013,13:222.
[10]Zhu Y,Hu S,Bai T,et al.Phylogenetic and antigenic characterization of reassortant H9N2avian influenza viruses isolated from wild waterfowl in the East Dongting Lake wetland in 2011-2012[J].Virol J,2014,11(1):77.
[11]Deng G,Tan D,Shi J,et al.Complex reassortment of multiple subtypes of avian influenza viruses in domestic ducks at the Dongting Lake Region of China[J].J Virol,2013,87(17):9452-9462.

