氯化盐溶液中氢化燃烧合成MgH2的水解制氢性能
刘虎,赵泽伦,李姝,朱云峰,李李泉
(南京工业大学材料科学与工程学院,江苏南京210009)
氯化盐溶液中氢化燃烧合成MgH2的水解制氢性能
刘虎,赵泽伦,李姝,朱云峰,李李泉
(南京工业大学材料科学与工程学院,江苏南京210009)
利用氢化燃烧合成(Hydriding Combustion Synthesis,HCS)制备的镁基氢化物(MgH2)与氯化盐溶液反应制取氢气。分别比较了NiCl2、MgCl2、CuCl2及CaCl2溶液中HCS MgH2的水解制氢量和转化率,着重研究了MgCl2溶液的浓度、温度及球磨预处理时间对HCS MgH2水解制氢性能的影响规律。研究表明:60 min球磨预处理的HCS MgH2,在30℃的0.5 mol/L MgCl2溶液中,反应30 min制氢量可达1 635 mL/g,转化率可达96%。
氢化燃烧合成;氢化镁;氯化盐溶液;水解制氢
氢能因其资源丰富、燃烧热值高、产物无污染等优点,被认为是理想的绿色能源[1]。氢燃料电池的迅速发展,对氢源技术尤其是移动氢源技术提出了更高的要求。开发高效、安全、响应迅速的移动氢源(水解制氢)技术是目前发展氢燃料电池经济亟需突破的瓶颈技术之一。
基于硼氢化物、活性金属及氢化物的水解制氢技术迅速发展,目前研究较多的是NaBH4、Al、Mg及MgH2[2-6]。其中MgH2理论储氢量7.6%(质量分数)水解释放每个氢原子的同时会从水中提取另外一个氢原子,使得理论制氢量提升至15.2%(反应生成水循环利用),从而备受关注。然而,MgH2水解副产物Mg(OH)2易包覆在未反应的颗粒表面形成致密钝化膜[7-8],阻碍反应持续进行,难以获得满足氢燃料电池实用要求的制氢速率及转化率。
将MgH2与活性金属、氢化物或氯化盐等混合球磨[9],可提高水解制氢性能,但制氢转化率仍不超过85%,距实用要求还有较大差距。将MgH2与醋酸[8]、柠檬酸[6]或丙二酸[10]等有机酸反应,可获得较高的制氢速率及转化率,但酸性溶液会腐蚀设备且是一次消耗品。此外,文献研究表明氯化盐溶液对Mg水解制氢具有促进作用,球磨30 min的Mg在1.0 mol/L KCl溶液中反应60 min制氢量为830 mL/g,制氢转化率达89%[11]。然而,氯化盐溶液对MgH2水解制氢性能的影响规律却鲜有报道。因此,本研究将氢化燃烧合成法(Hydriding Combustion Synthesis,HCS)制备的氢化镁与氯化盐溶液反应,研究氯化盐溶液种类、浓度、温度及球磨预处理时间对MgH2水解制氢性能的影响。
1 实验
1.1 样品制备
氢化镁样品通过氢化燃烧合成炉制备。根据HCS工艺[12],将市售雾化镁粉[纯度逸99.7%(质量分数),粒度臆74μm]和镍粉(纯度逸99.9%,粒度2~3μm)按原子比99∶1称量配料,在丙酮中超声混匀,干燥箱中53℃干燥3 h,置入氢化燃烧合成炉,抽真空后通入0.1 MPa Ar洗涤,再抽真空,反复3次直至反应器中空气基本被排出,最后通入2.0 MPa高纯H2(99.999%)。将反应器从室温加热到580℃,保温1 h,然后降温至340℃,保温10 h,使金属镁氢化完全,关闭电源,自然冷却至室温。
将HCS产物置于QM1SP2型行星式球磨机中进行球磨预处理。球磨罐为50 mL真空密封不锈钢罐,磨球材质与钢罐相同。球磨制度为:球磨转速400 r/min,球料质量比20∶1,保护气氛为0.1 MPa Ar。预处理时间为10、30、60 min。
1.2 水解制氢性能测试
将无水氯化盐(NiCl2,MgCl2,CuCl2及CaCl2)溶于蒸馏水,配成一定浓度的氯化盐溶液。取1.0 g样品置于三口烧瓶中,通过注射器注入20 mL上述溶液,生成的气体经无水氯化钙及变色硅胶干燥剂后通入ADM2000E流量计。若未做说明,则水解反应温度为30℃。每次实验重复3次,误差范围在±3%以内。制氢转化率(%)定义为反应物实际制氢量(mL/g)与理论制氢量(mL/g)的比值。
1.3 微结构表征
对样品的相成分采用X射线粉末衍射法(XRD)表征。ARL X'TRA型X射线粉末衍射仪,Cu靶Kα谱线,步长为0.02°,扫描速率5(°)/min。利用MDI Jade 6.5软件结合标准PDF卡片库进行物相的定性分析,并利用Rietica软件对样品XRD图谱进行全谱拟合,估算物相含量。采用JSM-6360LV型扫描电子显微镜(SEM)观察样品表面形貌及颗粒大小。
2 结果与讨论
2.1 HCS制备镁基氢化物成分及形貌分析
图1为HCS制备镁基氢化物的XRD图谱。由图可知,HCS制备的样品主相为MgH2,含有少量的合金氢化物Mg2NiH4及未氢化的单质Mg。其中,MgH2与PDF卡片12-0697(空间群P42/mnm)标准图谱一致。根据全谱拟合估算MgH2、Mg、Mg2NiH4相含量分别为93%、4%、3%(质量分数)。因此,用上述HCS样品做水解制氢性能研究。
图2为HCS制备镁基氢化物的SEM图。由图2(a)可知,多数颗粒呈鹅卵石形,颗粒细小且平均颗粒粒径约为30μm。图2(b)表明颗粒表面粗糙且具有鱼鳞状突起状结构,这种形貌增大了颗粒与水的接触面,有利于水解制氢反应的进行[12]。
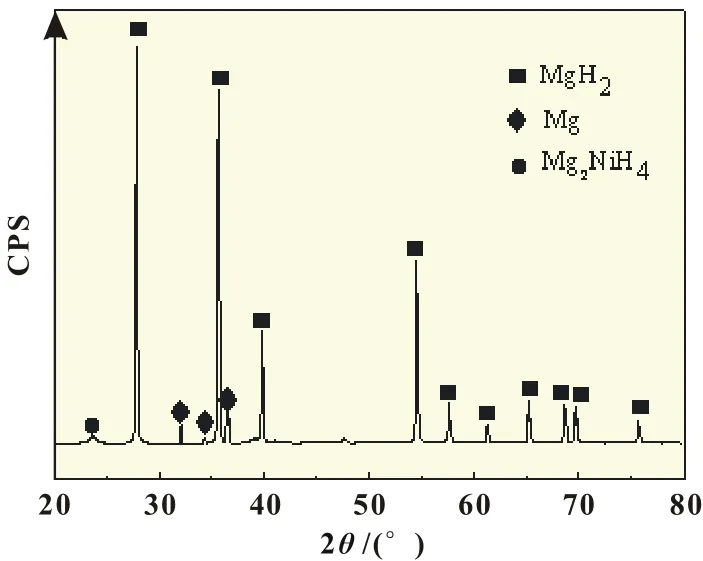
图1 HCS法制备镁基氢化物的XRD图谱

图2 HCS制备镁基氢化物SEM图
2.2 溶液种类对水解制氢性能的影响
为研究不同氯化盐溶液对HCS MgH2水解制氢性能的影响,并确定综合制氢性能最优的氯化盐溶液,将MgH2与浓度为1.0 mol/L NiCl2、MgCl2、CuCl2及CaCl2溶液反应,水解制氢性能曲线如图3所示。由图3可知,起始1 min内,MgH2水解反应制氢速率均较快;随着反应进行,在CuCl2溶液及CaCl2溶液中制氢速率急剧下降。HCS MgH2在上述氯化盐溶液中水解反应120 min制氢量分别为1 635、1 370、589和102 mL/g,均远高于在蒸馏水中的水解制氢量33 mL/g。

图3 不同氯化盐溶液(1.0 mol/L,30℃)中HCS MgH2水解制氢性能曲线
水溶液pH值对MgH2的水解制氢反应具有显著影响[10]。通过计算得,上述1.0 mol/L NiCl2、MgCl2、CuCl2、CaCl2溶液的pH值分别为6.37、8.38、4.17、11.37。除CaCl2溶液外,其余溶液pH值均小于Mg(OH)2饱和溶液pH值(pH=10.44),故能溶解Mg(OH)2钝化层,促使制氢反应持续进行。此外,CuCl2溶液pH值(pH=4.17)虽然远低于Mg(OH)2饱和溶液pH值,但制氢量却不高。实验时观察到溶液中有红色物质生成,推测可能是具有较强还原性的MgH2将Cu2+还原成难溶固体覆盖在反应物表面,阻止反应持续发生。
MgCl2溶液中MgH2反应120 min制氢量达1 370 mL/g,制氢转化率为81%。尽管MgH2在MgCl2溶液中的制氢性能不如在NiCl2溶液中优异,但MgCl2溶液中MgH2完全反应后仅有固体沉淀Mg(OH)2生成(如图4所示,由于配料时添加的Ni含量仅为1%,低于XRD分辨范围,故在图4中未见Ni峰,此外副产物中微量的Ni并不影响回收再生),且未引入其他阳离子,便于副产物再利用,有利于发展“镁-氢”循环经济。因此,本研究着重讨论了MgCl2溶液中HCS MgH2的水解制氢性能。

图4 氯化镁溶液(1.0 mol/L,30℃)中HCS MgH2完全水解后副产物XRD图谱
2.3 氯化镁溶液浓度对水解制氢性能的影响
图5为MgCl2溶液浓度对HCS MgH2水解制氢性能影响曲线。由图5可知,当MgCl2溶液浓度由0.5 mol/L增大至4.0 mol/L时,反应30 min的制氢量由270 mL/g提高到1 045 mL/g,制氢转化率由16%增加至61%。可见,增大MgCl2溶液浓度能显著提高镁基氢化物水解制氢性能,原因可能是MgCl2溶液浓度增大,溶液pH值降低,Mg(OH)2钝化层被溶解速率加快,更多的反应物新鲜表面参与反应,从而改善制氢性能,与文献[6]报道的柠檬酸溶液pH对MgH2制氢性能影响规律一致。
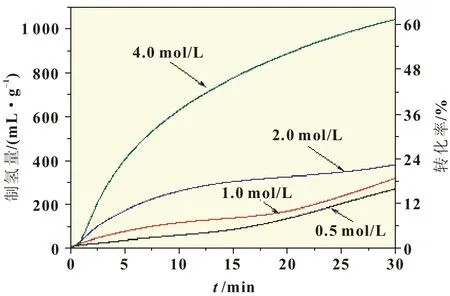
图5 30℃下不同MgCl2溶液浓度对HCS MgH2水解制氢性能的影响
2.4 氯化镁溶液初始温度对水解制氢性能的影响
文献[13-14]报道升高温度能改善金属铝或镁的水解制氢性能。然而,温度对HCS MgH2在氯化镁溶液中水解制氢性能的影响规律却未见报道。图6为不同MgCl2溶液初始温度对HCS MgH2水解制氢性能的影响曲线。由图6可见,所有制氢曲线均出现一段反应速率较低的诱导期,这可能是由于副产物氢氧化镁包覆所致。随着溶液初始温度的升高,制氢反应加快,诱导期缩短。其原因可能是温度升高,固液反应界面富集的氢气压力增大足以破坏表面Mg(OH)2钝化层,使得更多的新鲜活性表面与水接触,从而提高水解反应制氢速率及转化率。数据表明,当温度由30℃升高至70℃时,反应30 min制氢量由270 mL/g大幅提高到1 635 mL/g,制氢转化率由16%提高至96%。可见,初始温度对HCS MgH2在MgCl2溶液中的水解制氢性能具有显著影响,且初始温度越高,影响效果越显著。
2.5 球磨预处理时间对水解制氢性能的影响
本课题组研究表明,经球磨预处理5 h的HCS MgH2常温下与蒸馏水反应40 min可制氢680 mL/g,高于HCS MgH2与蒸馏水反应时的制氢量。因此,本研究将球磨预处理后的HCS MgH2与0.5 mol/L MgCl2溶液反应制取氢气,并考察了预处理时间对制氢性能的影响,曲线如图7所示。由图7可知,MgCl2溶液对球磨预处理后HCS MgH2的水解制氢性能具有更显著的促进作用。球磨预处理仅10 min,MgH2水解反应30 min制氢量已达1 219 mL/g,制氢转化率达72%,远优于文献报道结果[7]。随着球磨时间的延长,脆性MgH2颗粒细化,活性位增多且与MgCl2溶液接触的反应面积增大,反应加快。当预处理时间延长至60 min时,MgH2反应30 min制氢量可达1 635 mL/g,制氢转化率达96%,制氢性能优越。

图7 MgCl2溶液(0.5 mol/L,30℃)中不同球磨预处理时间的HCS MgH2水解制氢性能曲线
3 结论
(1)氢化燃烧合成法制备的氢化镁(MgH2)与NiCl2、MgCl2、CuCl2及CaCl2四种氯化盐溶液反应120 min,制氢量大小顺序为NiCl2>MgCl2>CuCl2>CaCl2,均优于在蒸馏水中的制氢量。因此,氯化盐溶液对氢化燃烧合成法制备的氢化镁水解制氢反应具有显著影响。
(2)MgH2在氯化镁溶液中具有较好的水解制氢性能,且完全反应后仅有Mg(OH)2固体沉淀生成,不引入杂质离子,便于副产物回收再生,有利于发展“镁-氢”循环经济。
(3)氯化镁溶液的浓度及初始温度对氢化镁水解制氢性影响显著,升高溶液浓度及初始温度均能有效改善氢化镁的水解制氢性能。
(4)球磨预处理后的HCS MgH2在氯化镁溶液中具有更优异的水解制氢性能。球磨预处理60 min的HCS MgH2,在30℃的0.5 mol/L MgCl2溶液中,反应30 min制氢量可达1 635 mL/g,转化率可达96%,水解制氢性能优异。
[1]刘春娜.氢能——绿色能源的未来[J].电源技术,2010,34(6):535-538.
[2]方朝君,闫常峰,郭常青.硼氢化钠制氢的技术路线与发展前景[J].电源技术,2011,35(1):116-120.
[3]DAI H B,MA G L,WANG P,et al.Reaction of aluminum with alkaline sodium stannite solution as a controlled source of hydrogen[J]. Energy Environ Sci,2011,4(6):2206-2212.
[4]刘姝,范美强,李璐基,等.基于便携式制氢-储氢体系的铝水解技术研究进展[J].电源技术,2011,35(3):334-337.
[5]沈品,朱云峰,李李泉.镁基氢化物水解制氢研究进展[J].电源技术,2011,35(7):876-879.
[6]HIRAKI T,HIRIROI S,AKIYAMA T,et al.Chemical equilibrium analysis for hydrolysis of magnesium hydride to generate hydrogen [J].Int J Hydrogen Energy,2012,37:12114-12119.
[7]HUOT J,LIANG G,SCHULZ R.Magnesium-based nanocomposites chemical hydrides[J].J Alloys Comp,2003,353(1/2):L12-L15.
[8]KOJIMA Y,SUZUKI K I.Hydrogen generation by hydrolysis reaction of magnesium hydride[J].J Mater Sci,2004,39(6):2227-2229.
[9]WANG H,ZHANG J,ZHU M,et al.Catalysis and hydrolysis properties of perovskite hydride NaMgH3[J].J Alloys Comp,2012,580 (S1):S197-S201.
[10]KUSHCH S D,KUYUNKO N S,NAZAROV R S,et al.Hydrogen-generating compositions based on magnesium[J].Int J Hydrogen Energy,2011,36(1):1321-1325.
[11]GROSJEAN M H,ZIDOUNE M,ROUE L,et al.Hydrogen production via hydrolysis reaction from ball-milled Mg-based materials [J].Int J Hydrogen Energy,2006,31(1):109-119.
[12]李李泉,沈品,朱云峰.一种水解制氢用镁基氢化物复合体系及其制备方法和应用:中国,ZL201010147696.2[P].2012-04-25.
[13]MAHMOODI K,ALINEJAD B.Enhancement of hydrogen generation rate in reaction of aluminum with water[J].Int J Hydrogen Energy,2010,35(11):5227-5232.
[14]LIU Y G,WANG X H,DONG Z H,et al.Hydrogen generation from the hydrolysis of Mg powder ball-milled with AlCl3[J].Energy,2013,53:147-152.
Hydrogen generation properties from hydrolysis of magnesium hydride in chloride salt solution
LIU Hu,ZHAO Ze-lun,LI Shu,ZHU Yun-feng,LI Li-quan
Magnesium hydride prepared by hydriding combustion synthesis(HCS)was used to generate hydrogen via hydrolysis in chloride salt solutions.The hydrogen yields and conversion rates in NiCl2,MgCl2,CuCl2and CaCl2solutions were compared.The effects of the concentration of MgCl2solution,the initial temperature of solution and the time of ball milling on the hydrogen generation performance were studied in detail.A hydrogen yield of 1 635 mL/g and a conversion rate of 96%were obtained in 0.5 mol/L MgCl2solution at 30℃by HCSed magnesium hydride ball milled for 60 min.
hydriding combustion synthesis;magnesium hydride;chloride salt solution;hydrogen generation
TM 911
A
1002-087 X(2015)03-0488-03

2014-08-19
国家自然科学基金(5117109);江苏高校优势学科建设工程资助
刘虎(1988—),男,四川省人,硕士研究生,主要研究方向为镁基材料水解制氢技术。
李李泉,E-mail:lilq@njtech.edu.cn

