黑曲霉固体发酵三七药材的皂苷变化研究
闫炳雄,许文迪,贺 帅,邱智东,王伟楠*
(长春中医药大学药学院,吉林 长春 130117)
三七(Panax notoginseng)又名田七,为五加科人参属多年生草本植物的根茎,是传统名贵中药材之一,具有化瘀止痛,活血定痛的功效,对出血症,跌打损伤,瘀血肿痛,虚损劳伤等病症疗效显著。现代研究表明三七的主要活性物质为皂苷类成分。其药理作用主要包括对心脑血管的影响、对中枢神经系统的影响、对血液的影响、对免疫系统的影响和抗肿瘤等方面[1-8]。三七中皂苷含量为6%,远高于其他五加科植物的总皂苷含量[9],但活性和生物利用度较好的稀有皂苷类成分如人参皂苷Rd,Rh1,Rh2,Rg3,CK等含量极少,甚至不可检出,因此如何提高稀有皂苷含量成为了三七深度开发利用的关键问题。
应用微生物发酵技术提高中药活性成分含量,改变物质基础组成是中药研究领域的热点内容,因其效率高、无污染,具有较好的应用前景。中药材经过微生物发酵之后,化学成分发生了明显的变化,某些大分子降解成小分子,易于被人体吸收,提高药材生物利用度;某些药物增加了有效成分或有效部位的含量,改善了药效[10-16]。黑曲霉(Aspergillusniger)是环境中的常见菌种,生长速度快,环境适应能力强,且生物安全性较高,非常适用于在中药基质上生长。前期试验发现黑曲霉在潮湿的三七药材中很容易生长。所以本研究利用黑曲霉对三七药材进行固体发酵,采用高效液相色谱-四级杆-飞行时间串联质谱(high performance liquidchromatography-quadrupole-timeofflight-tandemmass spectrometry,HPLC-Q-TOF-MS/MS)方法,对发酵产物中主要活性成分皂苷含量的变化进行检测,为三七药材的开发和利用及相关药物研究提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
三七药材购于吉林国安药业有限公司。
1.1.2 试剂
葡萄糖、蛋白胨、酵母浸粉、琼脂、麦芽浸膏、马铃薯浸出粉(生物试剂):北京奥博星生物技术有限责任公司;七水合硫酸镁、硫酸亚铁、磷酸二氢钾、氯化钾、硝酸钠甲醇均为分析纯:北京化工厂;乙腈、甲酸均为色谱纯:美国Thermo Fisher公司。人参皂苷Rb1(批号:MUST-12102301)、人参皂苷Rg1(批号:MUST-13041301)、人参皂苷Rd(批号:MUST-15020910)、人参皂苷Rh1(批号:MUST-15020914)、人参皂苷Rh2(批号:MUST-14062410)、人参皂苷CK(批号:MUST-15012711)、人参皂苷Rg3(批号:MUST-14041211)、人参皂苷F1(批号:MUST-14101610)标品:成都曼斯特生物科技有限公司;人参皂苷F2(批号:GR-133-131224)、三七皂苷R1(批号:GR-133-131109)、三七皂苷R2(批号:GR-133-131209)标品:南京广润生物制品有限公司。
1.1.3 培养基
斜面培养基采用马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L。自然pH,121℃灭菌20 min。
液体种子培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L。自然pH,121℃灭菌20 min。
固体发酵培养基:粉碎三七药材粉末(过10目筛),1.5%CaCO3,加入50%的蒸馏水,搅拌均匀121℃灭菌60 min。
1.1.4 菌种
黑曲霉(Aspergillus niger)CICC 2124:中国工业菌种保藏管理中心,PDA培养基斜面4℃保存。
1.2 仪器与设备
Agilent1260高效液相色谱仪、Agilent 6520 Q-TOF质谱仪:美国Agilent公司;DZX180微生物培养箱:上海艾测电子科技有限公司;ZD-88恒温冷冻振荡器、HSP150B恒温恒湿培养箱:金坛市天竟实验仪器厂;TG328A(S)分析天平:北京斯达恒通科技有限公司;YXQ-LS-50A立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;BPZ-6930LC真空干燥箱:上海一恒实验仪器总厂;FW177中草药粉碎机:天津市泰特仪器有限公司。
1.3 方法
1.3.1 菌种的复壮、复苏及种子液的制备
将黑曲霉斜面从低温冷藏冰箱中取出,迅速移至30℃水浴中加热30 min后,擦干试管表面,将斜面放置在28℃的微生物培养箱中12 h后,即可取出备用。将复苏的黑曲霉菌于液体培养基中,于28℃恒温培养培养5 d,即得液体种子培养基。
1.3.2 菌体培养
取三七药材粉碎(过10目筛),加入0.5%无机盐CaCO3,加入50%的蒸馏水,搅拌均匀,分装于250 mL广口三角瓶中,密塞瓶口,放入高压蒸汽灭菌器中保持温度121℃,灭菌60 min,取出,自然冷却至室温,在生物安全柜中接种黑曲霉菌液适量,待接种完成后放入温度为28℃,相对湿度65%的恒温恒湿培养箱中,培养20 d。
1.3.3 发酵产物供试品及对照样品的制备
将发酵至终点的发酵物从培养瓶中取出,置于减压真空干燥箱60℃干燥,用中草药粉碎机粉碎。取本品粉末(过65目筛)0.2 g,精密称定,精密加入甲醇4 mL,称质量,超声(150 W,40 kHz)处理1 h,冷却后再称质量,用甲醇补足减少的质量,摇匀,过滤,取续滤液,用0.22 μm微孔滤器过滤,作为供试品溶液。同法制得三七药材对照品溶液。
皂苷含量变化计算公式如下:

1.3.4 液相色谱-质谱分析
(1)高效液相色谱条件
采用ZORBAXSB-Aq色谱柱(250mm×4.6mm,5μm);以乙腈为流动相A,以水为流动相B,按表1中的程序进行梯度洗脱,进样量10 μL,流速1 mL/min。

表1 三七发酵产物高效液相色谱洗脱梯度Table 1 HPLC chromatographic elution condition ofPanax notoginsengfermentation product
(2)质谱条件
电喷雾离子源(electronic sprayion,ESI);电离模式:负离子模式;喷雾器压力:207kPa;干燥气(N2)流速:10L/min;干燥气温度:350℃;毛细管电压:3500V;碎裂电压:175V;锥孔电压:65 V;质量检测范围:300~1 400 m/z。
2 结果与分析
2.1 色谱峰归属
三七混标溶液及固体发酵产物进行鉴定分析,其液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)分析得到的总离子流色谱图见图1,各组分鉴定结果见表2。
由图1和表2可知,三七药材经黑曲菌固体发酵后主要活性成分发生较大变化。根据分子量和结构裂解规律,推断1~13号色谱峰均为皂苷类成分。经过标准品对照,色谱峰1、2、3、4、5、6、11、12、13分别鉴定为三七皂苷R1(notoginsenoside R1)、人参皂苷Rg1、三七皂苷R2(notoginsenoside R2)、人参皂苷Rh1、F1、Rd、F2、Rg3、CK;7号峰的[M-H]m/z=751.469 4计算分子式为C41H68O12,初步推测为三七皂苷T5(notoginsenoside T5);8、9、10号峰的[M-H]m/z值分别为619.432 9、619.432 4、619.432 3,计算分子式均为C36H60O8,为三个同分异构体,结合目前已有的文献报道,初步推测为人参皂苷Rk3、Rh4和Rh16。

图1 混标(A)和发酵产物(B)的皂苷化合物分析LC-MS总离子流色谱图Fig.1 Total ion chromatogram(TIC)of the mixed standards(A)and fermentation product(B)for saponin compounds analysis by LC-MS

表2 色谱峰鉴定Table 2 Identification of the chromatographic peaks
2.2 三七药材发酵前后主要皂苷类成分的含量变化
对三七药材及固体发酵产物进行鉴定分析,其LC-MS分析得到的总离子流色谱图见图2,通过液质联用的定量模式,记录不同色谱峰发酵前后的峰面积变化,三七药材及三七发酵产物皂苷峰面积对比结果见表3。
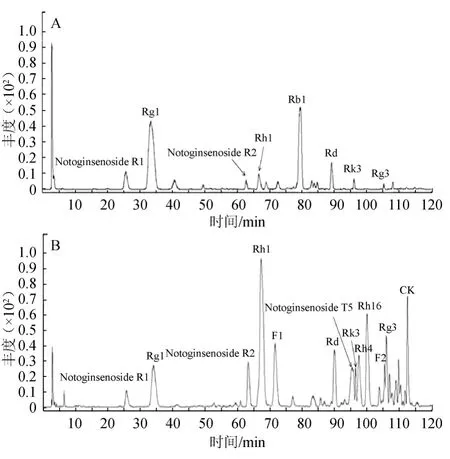
图2 三七发酵前(A)及发酵后(B)的皂苷化合物分析的LC-MS总离子色谱流图Fig.2 TIC of saponin compounds ofPanax notoginsengbefore(A)and after(B)fermentation for saponin compounds analysis by LC-MS

表3 三七药材及发酵产物皂苷峰面积对比Table 3 Peak areas of different saponins inPanax notoginseng and the fermentation products
由图2及表3可知,三七经过发酵之后,原生苷的含量均有不同程度的降低,而极性较低的稀有皂苷含量均有大幅度的提高。通过计算,原药材中含量较高的人参皂苷Rb1几乎全部转化生成其他物质,在发酵产物中已不可检出;人参皂苷Rg1的含量也有较大幅度的降低,经计算为62.19%;而三七皂苷R1的含量变化不大,仅降低了3.87%;三七皂苷R2、人参皂苷Rh1、人参皂苷Rd、人参皂苷Rk3的含量分别提高484.65%、1513.57%、121.98%、21.20%、208.73%;并且产生了生物利用度更好的稀有皂苷类成分人参皂苷F1、人参皂苷Rh4、三七皂苷Rh16、三七皂苷T5、人参皂苷Rg3和人参皂苷CK,推测均为生物转化产物。
3 结论
黑曲霉是工业上常用的发酵菌种,具有遗传系统稳定,生长迅速,酶系丰富等特点,其中尤以糖苷酶较为丰富,因此,利用黑曲霉对皂苷类成分进行结构改造具有良好的发展前景。在本实验中,三七药材经黑曲霉发酵后,皂苷类成分产生了显著的变化,利用标准品对其中主要的皂苷进行了鉴定,然后通过查阅大量三七药材及其加工产品的成分分析文献[17-22],对另外几个皂苷的结构特点、极性大小和在ZORBAX反相色谱柱上的相对保留时间,进行归纳总结,最终判断7号峰为三七皂苷T5,8号峰为人参皂苷Rk3,9号峰为人参皂苷Rh4,10号峰为人参皂苷Rh16;通过比较发酵前后三七药材的活性物质,发现药理活性和生物利用度更好的稀有皂苷含量明显增加,使得到的发酵产物展现出较高的临床应用价值和挖掘潜力,为指导三七药材的开发和利用以及稀有皂苷的大规模生产提供理论依据。
[1]张海港,李晓辉,李淑惠,等.三七总皂苷对烫伤大鼠心肌Gsα mRNA表达的影响[J].中草药,2001,32(11):1000-1002.
[2]高瑞兰,徐卫红,林筱洁,等.三七皂甙对造血细胞GATA-1和GATA-2转录调控蛋白的诱导作用[J].中华血液学杂志,2004,25(5):281-284.
[3]陈北阳,李 花,熊艾君.三七总皂苷对脑缺血再灌注后海马CA1区损伤的影响[J].湖南中医学院学报,2004,24(4):4-6.
[4]王根发,王文安,周永炜,等.三七皂甙对大鼠缺血再灌注损伤的保护作用[J].中国临床康复,2002,6(9):1268-1269.
[5]马丽淼,肖培根.三七总皂苷对突触体谷氨酸释放及谷氨酸受体特异性结合的影响[J].中国药理学通报,1998,14(4):309-310.
[6]马岩岩.三七皂甙成分对脂多糖诱导巨噬细胞炎性因子的影响及其机制的研究[D].广州:暨南大学硕士论文,2013.
[7]赵 鹏,李 彬,何为涛,等.三七皂苷对小鼠免疫功能影响的实验研究[J].中国热带医学,2004,4(4):522-524.
[8]刘昱良.三七皂甙制剂抑制小鼠胰腺癌皮下移植瘤的实验研究[D].昆明:昆明医科大学硕士论文,2013.
[9]周家明,崔秀明,曾 江,等.三七各部位单体皂苷成分研究进展与活性利用探讨[J].中药材,2007,30(12):1615.
[10]屈泽强,谢智光,王乃平,等.三七总皂苷抗衰老作用的实验研究[J].广州中医药大学学报,2005,22(2):130-132.
[11]TAO J Y,ZHENG G H,ZHAO L,et al.The anti-hyperlipidemia activities of six herbs before and after fermentation with white rot fungi[J].Journal of Chinese Pharmacology Sciences,2009,18(2):136-140.
[12]HASEGAWA H.Proof of the mysterious efficacy of ginseng:basic and clinical trials:metabolic activation of ginsenoside:deglycosylation by intestinal bacteria and esterification with fatty acid[J].Journal of Chinese Pharmacology Sciences,2004,95(2):153-157.
[13]李国红,张克勤,沈月毛.枯草芽孢杆菌对50种中药的发酵及抗菌活性检测[J].中药材,2006,29(2):154-157.
[14]李国红,沈月毛,王启方,等.发酵三七中的皂苷成分研究[J].中草药,2005,36(4):499-500.
[15]刘亮镜,曹 亮,蒋亚平,等.马钱子经朱红栓菌发酵前后毒性及镇痛、抗炎作用的实验研究[J].南京中医药大学学报,2009,25(3):205-208.
[16]庄 毅,洪 净.药用真菌双向性固体发酵工程与中成药药渣再开发[J].中国中药杂志,2006,31(22):1918-1919.
[17]LAU A J,WOO S O,KOH H L.Analysis of saponins in raw and steamed Panax notoginseng using high-performance liquid chromatography with diode array detection[J].J Chromatogr A,2003,1011(2):77-87.
[18]YANG W Z,YE M,QIAO X,et al.A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography mass spectrometry analysis:Its application inPanax ginseng,Panax quinquefoliumandPanax notoginsengto characterize 437 potential new ginsenosides[J].Anal Chim Acta,2012,739(20):57-65.
[19]LI L,TSAO R,DOU J P,et al.Detection of saponins in extract ofPanax notoginsengby liquid chromatography-electrospray ionization-mass spectrometry[J].Anal Chim Acta,2004,5361(1):23-28.
[20]DAN M,SU M M,GAO X F,et al.Metabolite profiling ofPanax notoginsengusing UPLC-ESI-MS[J].Phytochemistry,2008,69(11):2237-2244.
[21]WANG J R,YAU L F,GAO W N,et al.Quantitative comparison and metabolite profiling of saponins in different parts of the root ofPanax notoginseng[J].J Agr Food Chem,2014,62(36):9024-9034.
[22]WANG C Z,MCENTEE E,WICKS S,et al.Phytochemical and analytical studiesofPanaxnotoginseng(Burk.)F.H.Chen[J].J Nat Med,2006,602(2):98-103.

