基于多肽微阵列芯片的荧光和共振光散射法筛选凝血酶抑制剂
苏敏 李桃 刘殿骏 王振新
1(中国科学院长春应用化学研究所,电分析化学国家重点实验室,长春130022)
2(中国科学院大学,北京100049)
1 引言
蛋白酶是水解蛋白质肽键的一类酶的总称,凝血酶是一种重要的蛋白酶,主要参与血液凝结级联反应,使血液凝结成块阻止血液流失[1]。凝血酶与血栓栓塞性疾病的诊断和治疗密切相关[2],以凝血酶为靶点的抗凝血药物是临床用于治疗血栓的主要药物[3],开发高效、价格低廉的抗凝血药物是目前药物学研究热点[4,5]。
微阵列生物芯片技术可以在一张芯片上集成多种生物化学反应,能够实现对生物活性物质高效快速地测试和分析[6,7]。固定蛋白酶或蛋白酶特异底物的微阵列芯片可以同时分析多种抑制剂与蛋白酶之间的作用机理和作用效率[8,9]。Uttamchandani 等用蛋白微阵列芯片同时检测了3 种化合物对4 种半胱氨酸蛋白酶的抑制效率[10];Neumann 等用小分子微阵列芯片从近10 万个有机小分子中筛选出了6 种能与凝血酶活性位点结合的化合物[11]。迄今为止,仍鲜有使用多肽微阵列芯片在血液样品中筛选凝血酶抑制剂的报道。
本研究利用多肽微阵列芯片反应平台,荧光(Fluorescence)和共振光散射(Resonance Light Scattering,RLS)双检测手段,在血液样品中检测凝血酶抑制剂的抑制效率。双通路检测手段提高了检测结果的准确性,在加标血清和血浆中检测并比较了5 种化合物对凝血酶的抑制能力,并研究了在血浆中两种抑制剂对凝血酶抑制作用的可逆性。
2 实验部分
2.1 仪器与试剂
晶芯®SmartArrayerTM136 微阵列芯片点样系统和晶芯®LuxScan10K 微阵列芯片扫描仪(北京博奥生物技术有限公司);PMC082 芯片离心机(美国ChipMate 公司);SpotWareTM芯片扫描系统(美国Arrayit公司)。
人血液样品从长春市中心血站暨吉林省血液中心获得;荧光素标记的亲和素(FITC-Avidin)、凝血酶(Thrombin)、阿加曲班(Argatroban)、4-(2-氨乙基)苯磺酰氟盐酸盐(AEBSF)、胰蛋白酶抑制剂(Trypsin inhibitor)和N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺(E-64)(美国Sigma-Aldrich 公司);光学级三维高分子D 基片(北京博奥生物有限公司);多肽:CALNN,CALNNGK(biotin)G 和CAEGGf-PRSFRVVK(biotin)(上海强耀生物科技有限公司);抗凝血酶Ⅲ(Human Antithrombin-Ⅲ,HAT-Ⅲ,美国HTI 公司);其它试剂均为国产分析纯,实验用水为Milli-Q 超纯水(18.2 MΩ cm)。
2.2 实验方法
2.2.1 血液样品制备 血液采集后6 h 内离心分离血浆,并速冻制成新鲜冰冻血浆,-80 °C 保存。
用血浆稀释缓冲液(pH 7.35,20 mmol/L HEPES,21.7 mmol/L 柠檬酸钠,60 g/L BSA)将40 μL 血浆稀释1 倍,加入20 μL 的激活剂(30 pmol/L 重组人组织因子和24 μmol/L 磷脂混合物(磷脂酰丝氨酸∶ 磷脂酰乙醇胺∶ 磷脂酰胆碱=1∶ 1∶ 3,摩尔比),37 °C 孵育5 min。加入20 μL HEPES 缓冲液(pH 7.35,20 mmol/L HEPES,60 g/L BSA,0.1 mol/L CaCl2),制成活化的血浆。
将活化血浆1300 g 离心10 min,分离得到血清。
2.2.2 金纳米粒子探针制备 100 mL 超纯水中加入2 mL 1% 氯金酸溶液,加热至沸;加入2 mL 2%柠檬酸钠溶液继续加热搅拌30 min,合成30 nm 粒径的金纳米粒子[12,13]。取120 μL 1 g/L CALNNCALNNGK(biotin)G 混合液(9∶1,V/V),加入10 mL 4 nmol/L 金纳米粒子溶液中,室温静置1 h;离心除去上清液,重悬于探针缓冲液(pH 7.5,50 mmol/L 磷酸盐溶液,0.15 mol/L NaCl,0.1% (V/V)吐温-20,1% (w/V)BSA),4 °C 储存[14]。
2.2.3 多肽微阵列芯片制备和酶水解过程 用点样缓冲液(pH 8.5,0.3 mol/L 磷酸盐,0.2 mol/L NaCl,35% (V/V)甘油,0.002% (w/V)BSA)配制0.5 g/L 多肽(CAEGGfPRSFRVVK(biotin))溶液,使用晶芯®SmartArrayerTM136 微阵列芯片点样系统点样于光学级三维高分子D 基片上,30 °C 反应14 h。芯片表面的醛基基团与多肽N 末端半胱氨酸残基上的氨基和巯基基团共价反应形成五元环结构,使多肽固定于芯片表面[15]。用含0.1%(V/V)吐温-20 的洗涤液-I(pH 7.5,50 mmol/L 磷酸盐,1% (w/V)BSA)洗涤2 次;放入封闭液(pH 7.5,50 mmol/L 磷酸盐,0.15 mol/L NaCl,1% (w/V)BSA,0.1 mol/L乙醇胺)30 °C 反应1 h;用超纯水洗涤3 次,旋干(480 g,1 min)。
用酶反应缓冲液(pH 7.35,20 mmol/L HEPES,0.14 mol/L NaCl,2 mmol/L CaCl2)配制30 U/mL 凝血酶溶液,与芯片37 °C 反应1 h;依次用含0.1% (V/V)Triton X-100 的洗涤液-II(pH 7.5,20 mmol/L Tris,2 mmol/L EDTA,0.15 mol/L NaCl)、洗涤液-II 和超纯水洗涤芯片3 次,旋干。
2.2.4 酶水解过程识别 用3 μmol/L 荧光素标记的亲和素与芯片37 °C 反应1 h;依次用含1%(V/V)Tween-20 不含BSA 的洗涤液-I、不含BSA 的洗涤液-I 和超纯水洗涤芯片3 次,旋干;用晶芯®LuxScan10K 扫描仪进行扫描;用0.3 nmol/L 金纳米粒子与芯片37 °C 反应1 h,按上述步骤洗涤芯片并旋干。
2.2.5 抑制剂检测 将不同浓度的抑制剂分别与凝血酶溶液(30 U/mL)、加标血清(含30 U/mL 凝血酶)或血浆混合,血清或血浆的使用浓度为33%[16]。将混合溶液与芯片37 °C 反应1 h;依次用含0.1%(V/V)Triton X-100 的洗涤液-II、洗涤液-II 和超纯水洗涤芯片3 次,旋干;之后的识别过程与2.2.4 节描述相同。
2.2.6 信号检测和数据分析 用SpotWareTM芯片扫描仪提取共振光散射信号。所有数据都为扣除背景后的信号值,用6 个相同点的信号值计算平均值和标准偏差。抑制剂检测中,不加抑制剂的子阵列作为阴性对照,定义为最小信号值Imin;不加凝血酶的子阵列作为阳性对照,定义为最大信号值Imax。子阵列的相对信号强度(Relative fuorescence/RLS intensity,ΔI)用公式(1)计算:
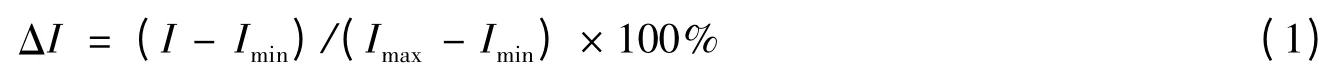
其中,I 为同时加入凝血酶和抑制剂的子阵列的信号值。酶溶液和加标血清中测得的IC50的差的绝对值(ΔIC50)定义为:
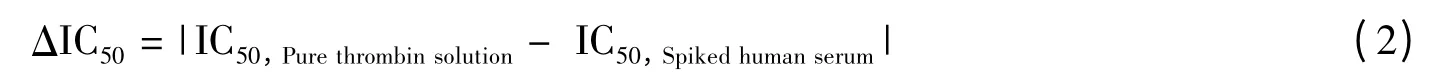
其中IC50,Purethrombinsolution为在酶溶液中测得的半抑制浓度,IC50,Spikedhumanserum为在加标血清中测得的半抑制浓度。
3 结果与讨论
3.1 检测原理
用文献[16]方法将多肽点样并固定在醛基基片表面,凝血酶水解多肽上的特异位点使多肽C 末端的生物素从芯片上解离,通过生物素和亲和素之间的特异性反应,用荧光探针和金纳米粒子探针标记此水解过程,荧光和共振光散射信号减弱。当加入凝血酶抑制剂时,凝血酶活性受到抑制,荧光和共振光散射信号减弱程度降低(图1)。
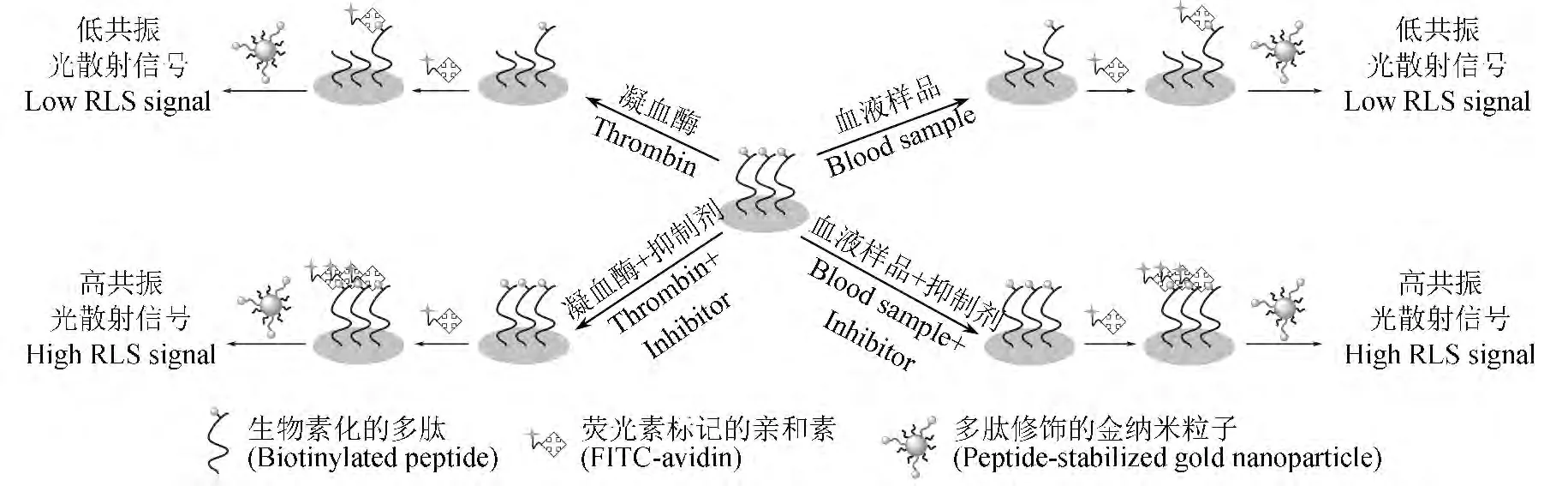
图1 基于多肽微阵列芯片的荧光法和共振光散射法检测凝血酶抑制剂Fig.1 Schematic representation of a peptide microarray-based fluorescence and resonance light scattering (RLS)assay for detecting thrombin inhibitor
3.2 酶溶液和加标血清中抑制剂的测定
为了验证本方法检测抑制剂的能力,检测了凝血酶抑制剂(阿加曲班、抗凝血酶Ⅲ和AEBSF)在酶溶液和加标血清中的IC50值。如图2 和图3 所示,3 种抑制剂均有效抑制了凝血酶活性,随抑制剂浓度增加,芯片阵列的荧光信号、共振光散射信号和相对信号强度都随之增大。凝血酶抑制剂IC50值见表1,3 种抑制剂在酶溶液中的IC50测定值均与文献[17,18]报道相符,加标血清中测得的IC50值和酶溶液中测得的相比有一定差别。IC50值大的抑制剂,其IC50差的绝对值也较大(AEBSF >抗凝血酶Ⅲ>阿加曲班)。在血清中,AEBSF 能与其它丝氨酸蛋白酶结合,抗凝血酶Ⅲ能与透明质酸结合肽酶等蛋白结合[18,19]。这种与血清蛋白的结合作用降低了抑制剂对凝血酶的抑制效率。阿加曲班几乎不与血清蛋白结合,对凝血酶的特异性较强,抑制效率较高[20]。说明在复杂的血清环境中,对凝血酶特异性差的抑制剂,其抑制能力明显降低。对于同一种抑制剂,由于血清蛋白对荧光素标记的生物素的非特异吸附,在纯酶溶液和加标人血清中通过荧光法测得的IC50差的绝对值小于共振光散射法。说明共振光散射法能够有效放大血清环境对抑制剂的干扰现象,较荧光法具有更高的检测灵敏度。以上实验结果表明,本方法不仅可以在酶溶液中,还可以在血清中定量计算抑制剂的抑制效率,考察复杂血清环境对抑制剂的影响。

表1 抑制剂IC50实验值与文献报道值对比Table 1 Comparison of IC50 value of this work and those from references

图2 (a)酶溶液和(b)加标血清中共振光散射法测定的抑制剂IC50曲线图和对应的扫描图,扫描图从左到右抑制剂浓度逐渐增加。阿加曲班浓度为0.0005,0.005,0.05,0.5,5,50 和500 μmol/L,抗凝血酶Ⅲ浓度为0.01,0.1,0.5,1,2.5,5,25 和100 μmol/L,4-(2-氨乙基)苯磺酰氟盐酸盐浓度为0.01,0.1,0.5,1,2.5,5,25,50和100 mmol/L。凝血酶浓度为30 U/mL,CAEGGfPRSFRVVK(biotin)点样浓度为0.5 g/L。Fig.2 Half maximal inhibitory concentration (IC50)curves and the corresponding images detected by RLS assay in(a)pure thrombin and (b)spiked human serum.The concentrations of inhibitors are increased from left to right in RLS images of each array.The concentrations of argatroban are 0.0005,0.005,0.05,0.5,5,50 and 500 μmol/L,the concentrations of human antithrobin Ⅲ(HAT-Ⅲ)are 0.01,0.1,0.5,1,2.5,5,25 and 100 μmol/L,and the concentrations of 4-(2-aminoethyl)ben zenesulfonyl fluoride hydrochloride (AEBSF)are 0.01,0.1,0.5,1,2.5,5,25,50 and 100 mmol/L,respectively.The concentration of thrombin is 30 U/mL,and the concentration of CAEGGf-PRSFRVVK(biotin)in spotting solution is 0.5 g/L
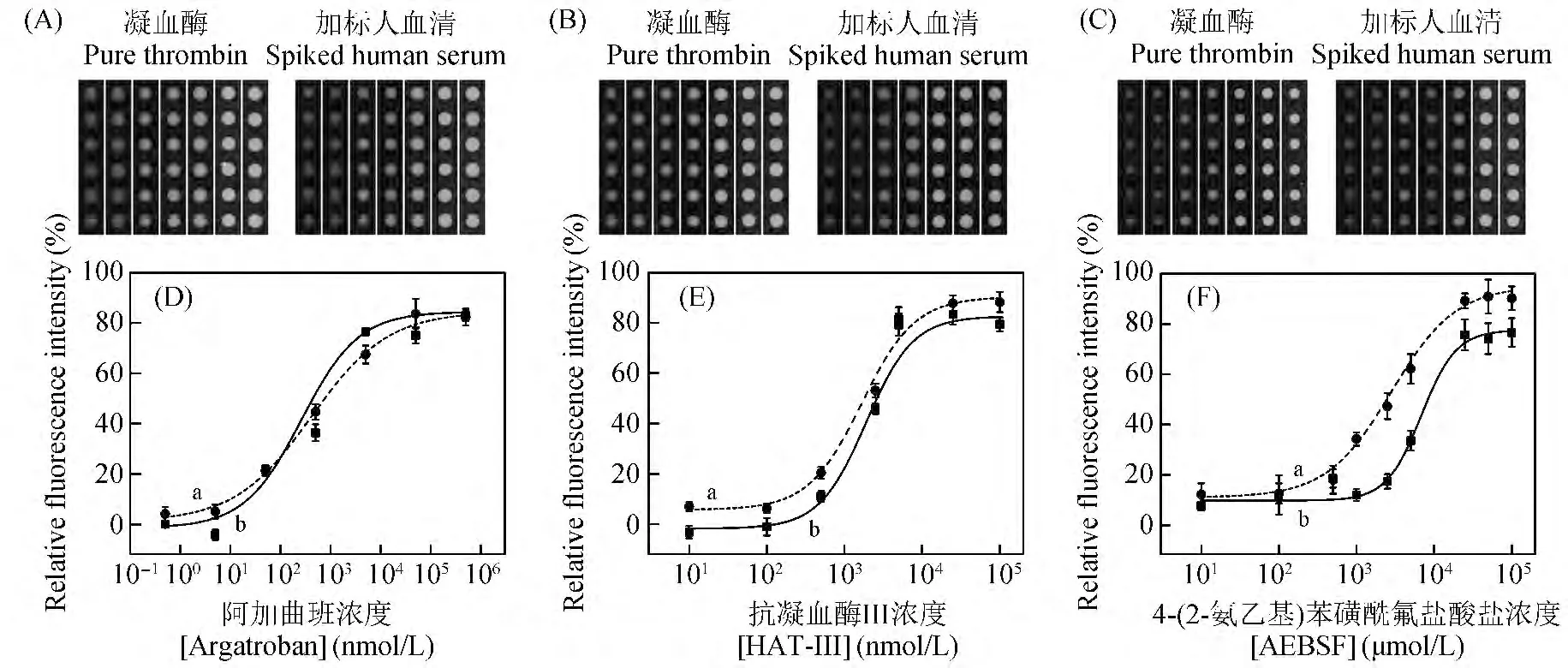
图3 (a)酶溶液和(b)加标血清中荧光法测定的抑制剂IC50曲线图和对应的扫描图Fig.3 IC50 curves and the corresponding images detected by fluorescent assay in (a)pure thrombin and (b)spiked human serum
3.3 血浆中抑制剂的测定
为了验证本方法在血浆中筛选抑制剂的能力,在血浆中检测了3 种常用凝血酶抑制剂(阿加曲班、抗凝血酶Ⅲ和AEBSF)及两种非凝血酶的蛋白酶抑制剂(胰蛋白酶抑制剂和E-64)对凝血酶的抑制效果。胰蛋白酶抑制剂和E-64 对凝血酶没有抑制活性[21,22]。如图4C 所示,在抑制剂浓度均为7.5 μmol/L 的条件下,共振光散射法测得5 种化合物的抑制能力为:阿加曲班>抗凝血酶Ⅲ>胰蛋白酶抑制剂>E-64 >AEBSF。其中,3 种凝血酶抑制剂在血浆中的抑制能力与酶溶液和加标血清中测得的IC50值大小相符,阿加曲班和抗凝血酶Ⅲ抑制能力明显高于另外3 种化合物。虽然荧光法测得5 种化合物的抑制能力趋势与共振光散射法一致,但其子阵列的荧光信号变化过小(图4D),不能满足在血浆中明确区分各种抑制剂抑制能力的要求。对比共振光散射法的检测结果,说明基于30 nm 金纳米粒子的共振光散射检测法,能够有效放大实验现象,提高检测能力,适用于复杂血浆环境中抑制剂的筛选。

图4 在血浆中检测5 种化合物的扫描图((A),(B))和对应的数据分析图((C),(D)),(A)和(C)为共振光散射法检测结果,(B)和(D)为荧光法检测结果。从a 到g(或h 到n)分别为:活化的血浆、胰蛋白酶抑制剂、N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺、4-(2-氨乙基)苯磺酰氟盐酸盐、阿加曲班、抗凝血酶Ⅲ和未活化的血浆。抑制剂浓度均为7.5 μmol/L,CAEGGfPRSFRVVK(biotin)点样浓度为0.5 g/L。Fig.4 Images ((A),(B))and the corresponding data analysis ((C),(D))of detection of 5 compounds in human plasma.(A),(C):The detection results of RLS assay;(B),(D):The detection results of fluorescent assay.From a to g (or h to n):activated human plasma,trypsin inhibitor,E-64,AEBSF,argatroban,HAT-Ⅲand non-activated human plasma.The concentration of inhibitors is 7.5 μmol/L,and the concentration of CAEGGfPRSFRVVK (biotin)in spotting solution is 0.5 g/L.
3.4 血浆中抑制剂可逆性考察
为了进一步考察本方法的实用性,对阿加曲班和抗凝血酶Ⅲ在血浆中对凝血酶的抑制能力进行了检测。用共振光散射法检测时,随抑制剂浓度增加抗凝血酶Ⅲ得到了近似的IC50曲线(图5C),而高浓度的阿加曲班并没有完全抑制凝血酶的活性(图5D)。抗凝血酶Ⅲ是凝血酶的不可逆抑制剂,高浓度下能够排除血浆中凝血酶天然底物纤维蛋白原等其它物质的干扰,直接与酶活性位点作用形成不可逆的复合物,完全抑制血浆中的凝血酶活性[23]。阿加曲班是凝血酶的可逆抑制剂,结合在凝血酶与纤维蛋白原作用的活性位点,产生空间位阻效应抑制纤维蛋白原与凝血酶的结合;同样,纤维蛋白原与凝血酶的结合也会产生空间位阻效应,抑制阿加曲班与凝血酶的结合[24]。血浆中纤维蛋白原与阿加曲班竞争结合凝血酶,因此增加阿加曲班的浓度也没有完全抑制凝血酶的活性。虽然阿加曲班在酶溶液和加标血清中测定的IC50值均小于抗凝血酶Ⅲ,但是由于二者的抑制类型不同,抗凝血酶Ⅲ比阿加曲班在血浆中的抑制效果更好,更具有实用价值。这些实验结果说明,基于多肽微阵列芯片的金纳米粒子共振光散射检测方法可以在血浆中区分抑制剂的类型,有助于判断抑制剂的实际使用价值。
在血浆中用荧光法检测时,加入不同浓度抗凝血酶Ⅲ(图6C)和阿加曲班(图6D),未能有效检测出这两种化合物的抑制能力。以上实验结果表明,基于多肽微阵列芯片的共振光散射检测方法较荧光法更适于在复杂血浆环境中进行抑制剂特性考查,本方法为发展以多肽微阵列芯片为平台的高通量药物筛选技术打下了基础。
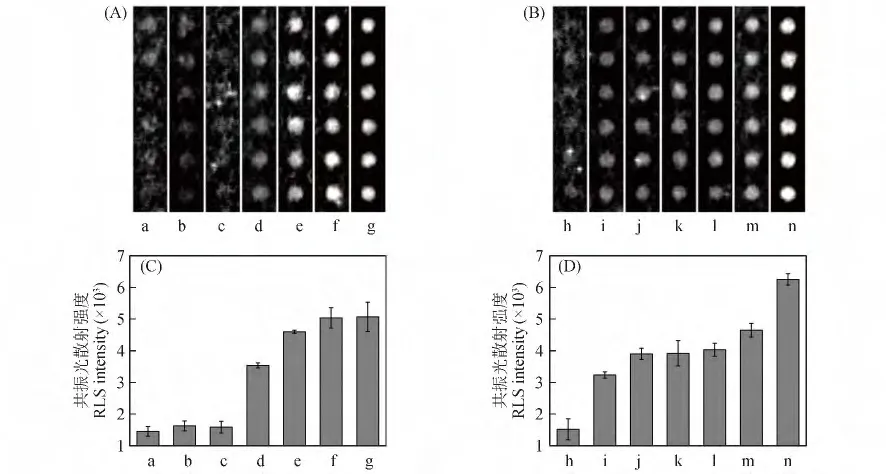
图5 在血浆中检测抗凝血酶Ⅲ(A,C)和阿加曲班(B,D)的共振光散射扫描图和对应的数据分析图,a 和h 均为活化的血浆,抗凝血酶Ⅲ浓度从b 到f 分别为1,2,5,10 和20 倍半抑制浓度,阿加曲班浓度从i 到m分别为1,2,5,10 和20 倍半抑制浓度,g 和n 为未活化的血浆。半抑制浓度均采用酶溶液中的测定值。CAEGGfPRSFRVVK(biotin)点样浓度为0.5 g/L。Fig.5 RLS images and the corresponding data analysis for detection of (A,C)HAT-Ⅲand (B,D)argatroban in human plasma.a and h are activated human plasma,the concentrations of HAT-Ⅲfrom b to f:1,2,5,10 and 20 ×IC50,the concentrations of argatroban from i to m:1,2,5,10 and 20 ×IC50,g and n are non-activated human plasma.The IC50 values are found with pure thrombin solution.The concentration of CAEGGfPRSFRVVK(biotin)in spotting solution is 0.5 g/L.

图6 在血浆中检测抗凝血酶Ⅲ(A,C)和阿加曲班(B,D)的荧光扫描图和对应的数据分析图Fig.6 Fluorescence images and the corresponding data analysis for detection of HAT-Ⅲ(A,C)and argatroban(B,D)in human plasma
1 Brummel K E,Paradis S G,Butenas S,Mann K G.Blood,2002,100(1):148 -152
2 Eriksson B I,Quinlan D J,Eikelboom J W.Annual Review of Medicine,USA:Annual Reviews,2011:62:41 -57
3 Straub A,Roehrig S,Hillisch A.Angew.Chem.Int.Ed.,2011,50(20):4574 -4590
4 Weitz J I.Thromb.Haemostasis,2010,103(1):62 -70
5 Levine M N.J.Clin.Oncol.,2009,27(29):4912 -4918
6 Mugherli L,Burchak O N,Balakireva L A,Thomas A,Chatelain F,Balakirev M Y.Angew.Chem.Int.Ed.,2009,48(41):7639 -7644
7 Fernandez L,Bleda M J,Gomara M J,Haro I.Anal.Bioanal.Chem.,2013,405(12):3973 -3982
8 Sun H Y,Chattopadhaya S,Wang J,Yao S Q.Anal.Bioanal.Chem.,2006,386(3):416 -426
9 Uttamchandani M,Lee W L,Wang J,Yao S Q.J.Am.Chem.Soc.,2007,129(43):13110 -13117
10 Uttamchandani M,Liu K,Panicker R C,Yao S Q.Chem.Comm.,2007,15:1518 -1520
11 Neumann T,Junker H D,Keil O,Burkert K,Ottleben H,Gamer J,Sekul R,Deppe H,Feurer A,Tomandl D,Metz G.Lett.Drug Des.Discov.,2005,2(8):590 -594
12 Turkevich J,Stevenson P C,Hillier J.Discuss.Faraday Soc.,1951,11:55 -75
13 Frens G.Nature,1973,241:20 -22
14 Levy R,Thanh N T K,Doty R C,Hussain I,Nichols R J,Schiffrin D J,Brust M,Fernig D G.J.Am.Chem.Soc.,2004,126(32):10076 -10084
15 Bi X Y,Lai S L,Yang K L.Anal.Chem.,2009,81(13):5503 -5509
16 Su M,Ma L,Li T,Liu D J,Wang Z X.Anal.Methods.,2013,5(21):5895 -5898
17 Berry C N,Girardot C,Lecoffre C,Lunven C.Thromb.Haemostasis,1994,72(3):381 -386
18 Liu Y.A Novel Method for the Quantitative Evaluation of Fibrinogen Coagulation[MS thesis].Atlanta,American:Georgia State University,2009:19
19 Rawlings N D,Waller M,Barrett A J,Bateman A.Nucleic Acids Res.,2014,42(D1):D503 -509
20 Hantgan R R,Jerome W G,Hursting M.Blood,1998,92(6):2064 -2074
21 Kunitz M.J.Gen.Physiol.,1947,30(4):311 -320
22 Barrett A J,Kembhavi A A,Brown M A,Kirschke H,Knight C G,Tamai M,Hanada K.Biochem.J.,1982,201(1):189 -198
23 Olson S T,Bjork I.Semin.Thromb.Hemost.,1994,20(4):373 -409
24 Bauer M,Brandstetter H,Turk D,Sturzebecher J,Bode W.Semin.Thromb.Hemost.,1993,19(4):352 -360

