花椒叶的化学组成、叶提取物体外抗氧化活性及其对黑腹果蝇抗氧化酶活性的影响
孙晨倩, 王正齐, 姚 美, 张华峰
(陕西师范大学食品工程与营养科学学院 药用资源与天然药物化学教育部重点实验室 西北濒危药材资源开发国家工程实验室, 陕西 西安 710062)
花椒叶的化学组成、叶提取物体外抗氧化活性及其对黑腹果蝇抗氧化酶活性的影响
孙晨倩, 王正齐, 姚 美, 张华峰①
(陕西师范大学食品工程与营养科学学院 药用资源与天然药物化学教育部重点实验室 西北濒危药材资源开发国家工程实验室, 陕西 西安 710062)
以采自陕西西安的花椒(ZanthoxylumbungeanumMaxim.)品种‘大红袍’(‘Dahongpao’)叶片为研究材料,对花椒叶中营养成分和活性成分的含量及其水提物和醇提物的体外抗氧化活性进行了分析,并研究了花椒叶醇提物对黑腹果蝇(DrosophilamelanogasterMeigen)体内超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性的影响。结果表明:花椒叶总蛋白质含量为204.727 g·kg-1,蛋白质的主要组分为醇溶蛋白、谷蛋白、清蛋白和球蛋白;氨基酸总含量达到245.941 g·kg-1,包含16种氨基酸,氨基酸的E/T值、CS平均值和AAS平均值分别为46.57%、148.86%和254.24%;粗纤维、粗脂肪、灰分、水分和可溶性多糖的含量分别为5.69%、2.07%、6.67%、9.13%和8.50 g·kg-1;醇提物中总多酚和类黄酮的含量分别为552.71和133.63 g·kg-1。花椒叶水提物和醇提物对ABTS+·和DPPH·均具有一定的清除能力;其中,0.08 mg·mL-1醇提物对ABTS+·的清除率(99.75%)与阳性对照VC(99.78%)接近,0.08 mg·mL-1水提物对ABTS+·的清除率则略低于VC;0.10 mg·mL-1醇提物和水提物对DPPH·的清除率分别为82.27%和81.34%,略低于VC。花椒叶醇提物和水提物的质量浓度与自由基清除率有明显的量效关系,其中,醇提物对自由基的清除能力较强,其对ABTS+·和DPPH·的IC50值分别为0.028 2和0.030 1 mg·mL-1。在黑腹果蝇培养基中添加0.1和0.3 mg·mL-1花椒叶醇提物,可使雌性和雄性黑腹果蝇的SOD活性以及雄性黑腹果蝇的GSH-Px活性显著或极显著提高,但对雌性黑腹果蝇的GSH-Px活性无显著影响。研究结果显示:花椒叶蛋白质含量高且品质较好、氨基酸组成均衡,达到优质植物蛋白资源的标准;花椒叶醇提物和水提物均具有一定的抗氧化活性,可能与其多酚和类黄酮含量较高有关。
花椒叶; 营养成分; 活性成分; 抗氧化活性; 抗氧化酶; 黑腹果蝇
芸香科(Rutaceae)植物花椒(ZanthoxylumbungeanumMaxim.)是重要的经济树种,在中国的种植面积约有2.1×106hm2[1]。花椒果皮是中国的传统香料,也是花椒最重要的深加工资源,在食品工业中具有重要用途;花椒叶可作为调味品和椒茶,在陕西和贵州等省份人们还将其作为新型蔬菜食用,具有驱风、发汗、抑菌和杀虫等功效[1-2]。为了明确花椒叶的生物活性,范菁华等[1]分析了花椒叶总黄酮的体外抗氧化活性;作者所在课题组对花椒叶中水溶性多糖含量进行了测定并摸索出定量分析方法[2]。但作为新型蔬菜资源,目前对花椒叶中蛋白质、氨基酸、脂肪和膳食纤维等营养成分的分析及花椒叶生物活性的研究尚处于起步阶段,这不仅影响了花椒叶资源的合理开发应用,也不利于花椒叶的食用安全性评估。
作者以产自陕西西安的花椒品种‘大红袍’(‘Dahongpao’)叶片为研究材料,系统测定了花椒叶中营养成分和活性成分的含量,并采用ABTS〔2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐〕和DPPH(1,1-二苯基-2-三硝基苯肼)方法分析了花椒叶水提物和醇提物的体外抗氧化活性;在此基础上,研究花椒叶醇提物对黑腹果蝇(DrosophilamelanogasterMeigen)体内超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性的影响,以期全面了解花椒叶的化学组成和生物活性,为这一新食品资源的合理开发应用提供基础研究数据。
1 材料和方法
1.1 材料、试剂和仪器
供试花椒品种‘大红袍’叶片于2014年4月采自陕西省西安市。随机选取5株样树,分别采摘当年生枝条顶端的叶片约200 g;用自来水和蒸馏水依次漂洗样叶,置于阴凉通风处干燥后粉碎并过80目筛,密封保存。酶学实验选用8 h内羽化未交配的野生型纯种黑腹果蝇。
主要试剂:ABTS、DPPH、半乳糖(纯度大于99%)、VC(纯度大于或等于99%)、考马斯亮蓝G-250和Folin-Ciocalteu’s试剂(美国Sigma公司);琼脂〔北京索莱宝有限公司(产地日本)〕;A001-1 SOD试剂盒和A005 GSH-Px试剂盒(南京建成生物工程研究所);牛血清白蛋白(北京奥博星生物技术有限责任公司);山柰酚标准品(批号520-18-3)和没食子酸标准品(批号149-91-7)的纯度均不低于98%(芜湖甙尔塔医药科技公司);溴甲酚绿-甲基红混合指示液由1 mg·mL-1溴甲酚绿乙醇溶液与2 mg·mL-1甲基红乙醇溶液以体积比3∶1配制而成;盐酸为优级纯;其余试剂为分析纯。
主要仪器:L-8900全自动氨基酸分析仪(日本HITACHI公司);KJELTEC 2300全自动凯氏定氮仪(瑞典FOSS公司);TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司);LGJ-18C型真空冷冻干燥机(北京四环科学仪器厂);SPX智能型生化培养箱(宁波江南仪器厂);JPCQ0328型全数字式超声波清洗机(武汉嘉鹏电子有限公司)。
1.2 方法
1.2.1 叶片水提物和醇提物的制备 参照文献[3]制备叶片水提物。取适量花椒叶样品粉末,按照料液比1∶40(W∶V)加入蒸馏水,于25 ℃、60 W条件下用超声波辅助提取30 min;然后于1 673g离心10 min,上清液用0.45 μm水系滤膜过滤,冻干后于4 ℃密封保存,供试。
参照文献[4]制备叶片醇提物。取适量花椒叶样品粉末,按照料液比1∶50(W∶V)加入体积分数50%乙醇,置于50 ℃水浴中浸泡2 h,在25 ℃、60 W条件下用超声波辅助提取20 min;然后于1 673g离心10 min,上清液用0.45 μm有机系滤膜过滤,冻干后于4 ℃密封保存,供试。
1.2.2 营养成分及活性成分含量的测定 采用GB 5009.5—2010方法测定花椒叶中总蛋白质含量;参照文献[5]的方法分离清蛋白、球蛋白、醇溶蛋白和谷蛋白,然后参照文献[6]的方法测定各种蛋白质组分的含量;采用GB/T 5009.10—2003中的酸、碱洗涤法测定粗纤维含量;采用GB/T 5009.6—2003中的索氏抽提法测定粗脂肪含量;采用GB/T 5009.3—2003中的直接称重法测定水分含量;采用GB/T 5009.4—2003中的灼烧称重法测定灰分含量;采用苯酚-硫酸法[2]测定花椒叶中的可溶性多糖含量。参照文献[5]的方法测定氨基酸含量(色氨酸未检测);参照文献[7]的方法计算氨基酸的化学评分(CS);参照文献[8]的方法计算必需氨基酸与总氨基酸含量的比值(E/T);参照文献[9]的方法计算氨基酸评分(AAS)。以上成分均重复测定3次。
采用分光光度法测定类黄酮含量:用体积分数50%乙醇配制质量浓度为1.0 mg·mL-1的山柰酚标准品溶液;并在波长190~400 nm范围内对山柰酚标准品溶液和花椒叶醇提物溶液进行扫描,最终确定以229 nm作为测定波长;用体积分数50%乙醇将山柰酚标准品溶液稀释成质量浓度(x)为2.0、4.0、8.0、12.0、16.0和20.0 μg·mL-1的溶液,在波长229 nm下测定其吸光度(y)并绘制标准曲线,所得回归方程为y=0.051x-0.001 4(R2=0.997 3);用乙醇将花椒叶醇提物稀释至适当浓度,在波长229 nm下测定其吸光度,并根据标准曲线计算花椒叶醇提物中的类黄酮含量。重复测定3次。
采用Folin-Ciocalteu比色法测定总多酚含量:用体积分数50%乙醇配制质量浓度(x)依次为15.0、30.0、60.0、90.0、120.0和150.0 mg·mL-1的没食子酸标准品溶液;各取0.5 mL,分别依次加入蒸馏水5 mL、 Folin-Ciocalteu’s试剂0.4 mL, 摇匀后静置5 min,再分别加入质量体积分数10%Na2CO3溶液0.8 mL,用体积分数50%乙醇定容至10 mL,在25 ℃水浴中反应2 h;在波长765 nm下测定吸光度(y),并绘制标准曲线,所得回归方程为y=0.002x+0.009 5(R2=0.997 4)。采用体积分数50%乙醇将花椒叶醇提物稀释至适当浓度,按照没食子酸标准曲线的测定方法在波长765 nm下测定吸光度,并根据没食子酸标准曲线计算总多酚含量。重复测定3次。
1.2.3 体外抗氧化活性的测定 分别采用ABTS+·和DPPH·自由基清除法[10]测定花椒叶水提物和醇提物的体外抗氧化活性;以VC作为阳性对照,配制质量浓度为1 mg·mL-1VC母液,稀释至与提取物待测溶液相同的梯度浓度。采用数学方法建立提取物质量浓度与自由基清除率之间量效关系的拟合方程;并参考文献[11]计算半效剂量(IC50)。实验设2次重复。
1.2.4 醇提物对黑腹果蝇SOD和GSH-Px活性的影响 将花椒叶醇提物配制成空白组、低剂量组和高剂量组,质量浓度分别为0.0、0.1和0.3 mg·mL-1。将黑腹果蝇随机分为3组,分别对应为空白组、低剂量组和高剂量组,每组80只,雌雄各半,2次重复。
低剂量组和高剂量组的黑腹果蝇先在基础培养基(基础培养基中玉米粉、红糖、琼脂、丙酸、干酵母粉和水的质量分数分别为10.0%、13.5%、1.5%、0.5%、1.0%和73.5%)中培养3 d,再转入分别添加了质量浓度0.1和0.3 mg·mL-1花椒叶醇提物的基础培养基中培养23 d;空白组的黑腹果蝇则在基础培养基中培养26 d,用同体积蒸馏水代替花椒叶醇提物。培养期间每隔3 d更换1次培养基。
培养期满后将所有黑腹果蝇置于-20 ℃条件下冷冻30 min。将各处理冷冻的黑腹果蝇分别移入匀浆器,加入预冷的生理盐水,在冰浴条件下匀浆,制成质量体积分数2%黑腹果蝇匀浆液;经941g离心15 min后取上清液,分别按照SOD和GSH-Px试剂盒说明书采用羟胺法和5,5′-二硫基-双(2-硝基苯甲酸)法测定上清液中SOD和GSH-Px的总活性。采用考马斯亮蓝法测定蛋白质含量,以蛋白质含量(x)为横坐标、吸光度(y)为纵坐标绘制标准曲线,回归方程为y=0.41x-0.065 2(R2=0.992 2)。根据酶总活性和蛋白质含量分别计算SOD和GSH-Px活性。实验设2次重复。
1.3 数据的统计分析
采用DPS v7.05软件对实验数据进行统计分析,并检测样本间差异显著性(差异显著:P<0.05;差异极显著:P<0.01)。
2 结果和分析
2.1 花椒叶中营养成分和活性成分的含量
2.1.1 营养成分和活性成分含量 花椒叶中蛋白质较丰富,总蛋白质含量为204.727 g·kg-1,占花椒叶总干质量20%以上;蛋白质的主要组分为醇溶蛋白(31.838 g·kg-1),谷蛋白(13.264 g·kg-1)和清蛋白(13.123 g·kg-1)含量居中,球蛋白含量较低(3.517 g·kg-1)。花椒叶中粗纤维、粗脂肪、灰分和水分的含量分别为5.69%、2.07%、6.67%和9.13%。花椒叶中可溶性多糖含量为8.50 g·kg-1;其醇提物中总多酚和类黄酮含量分别为552.71和133.63 g·kg-1。
2.1.2 氨基酸组成及含量分析 花椒叶中氨基酸组成及其含量见表1,氨基酸的化学评分(CS)和氨基酸评分(AAS)见表2。
由表1可以看出:花椒叶中氨基酸总含量达到245.941 g·kg-1,从中共检出16种氨基酸(脯氨酸未检出)。除色氨酸未检外,其他的人体必需氨基酸全部检出,其中赖氨酸、甲硫氨酸、苯丙氨酸、亮氨酸和异亮氨酸含量较高,必需氨基酸与总氨基酸含量的比值(E/T)达到46.57%。此外,花椒叶中的鲜味氨基酸(包括谷氨酸、天冬氨酸、甘氨酸、精氨酸和丙氨酸)也很丰富,说明花椒叶的鲜美程度较高。
由表2可知:花椒叶中氨基酸的CS平均值为148.86%;花椒叶蛋白质的限制氨基酸为苏氨酸,其CS值为68.87%。除苏氨酸外,花椒叶蛋白质中人体必需氨基酸的AAS值均超过100%,氨基酸的AAS平均值为254.24%。
表1 花椒叶的氨基酸组成及其含量
Table 1 Composition and content of amino acids in leaf ofZanthoxylumbungeanumMaxim.

氨基酸 Aminoacids含量/g·kg-1 Content赖氨酸Lys22.233甲硫氨酸Met15.187苯丙氨酸Phe20.293缬氨酸Val13.827亮氨酸Leu18.727异亮氨酸Ile17.640苏氨酸Thr6.627组氨酸His24.460精氨酸Arg28.507丝氨酸Ser7.280天冬氨酸Asp5.973谷氨酸Glu8.253甘氨酸Gly11.880丙氨酸Ala12.700半胱氨酸Cys12.987酪氨酸Tyr19.367必需氨基酸Essentialaminoacids114.534半必需氨基酸Semi-essentialaminoacids52.967非必需氨基酸Non-essentialaminoacids78.440总氨基酸Totalaminoacids245.941
表2 花椒叶中氨基酸的化学评分(CS)和氨基酸评分(AAS)
Table 2 Chemical score (CS) and amino acid score (AAS) of amino acids in leaf ofZanthoxylumbungeanumMaxim.
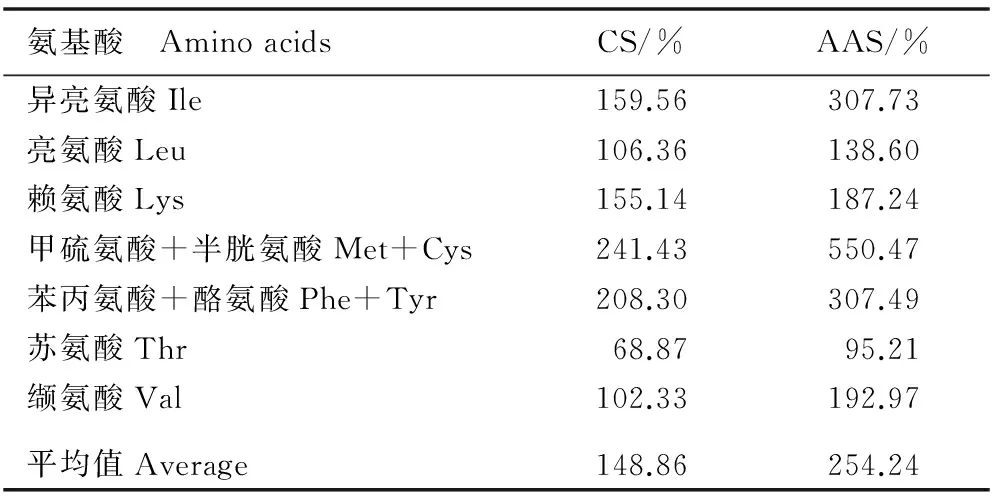
氨基酸 AminoacidsCS/%AAS/%异亮氨酸Ile159.56307.73亮氨酸Leu106.36138.60赖氨酸Lys155.14187.24甲硫氨酸+半胱氨酸Met+Cys241.43550.47苯丙氨酸+酪氨酸Phe+Tyr208.30307.49苏氨酸Thr68.8795.21缬氨酸Val102.33192.97平均值Average148.86254.24
2.2 花椒叶的抗氧化活性
2.2.1 对ABTS+·和DPPH·的清除率 花椒叶提取物对ABTS+·和DPPH·的清除率见图1。由图1可见:花椒叶醇提物和水提物对ABTS+·均有清除作用,且随提取物质量浓度的提高(0.00~0.08 mg·mL-1),ABTS+·清除率不断增高,说明花椒叶醇提物和水提物对ABTS+·的清除能力呈现明显的剂量依赖特征。当提取物质量浓度为0.08 mg·mL-1时,花椒叶醇提物对ABTS+·的清除率高达99.75%,与阳性对照VC对ABTS+·的清除率(99.78%)接近;而水提物对ABTS+·的清除率则略低于VC。

—●—: VC(阳性对照) VC(Positive control); —▲—: 醇提物 Ethanol extracts; —○—: 水提物 Aqueous extracts.
由图1还可以看出:花椒叶醇提物和水提物对DPPH·均有清除作用;在质量浓度0.00~0.10 mg·mL-1范围内,花椒叶醇提物和水提物质量浓度与DPPH·清除率之间呈明显的剂量依赖关系。当提取物质量浓度为0.10 mg·mL-1时,花椒叶醇提物和水提物的DPPH·清除率较为接近,分别为82.27%和81.34%,略低于VC。
采用数学方法建立提取物质量浓度与自由基清除率之间量效关系的拟合方程,并计算半效剂量(IC50),结果见表3。花椒叶醇提取和水提物的质量浓度与ABTS+·和DPPH·清除率之间均呈现良好的量效关系,R2为0.986 8~0.999 1。花椒叶醇提物和水提物对ABTS+·和DPPH·的IC50值均明显高于VC,说明花椒叶提取物的体外抗氧化能力低于VC;花椒叶醇提物对ABTS+·和DPPH·的IC50值均低于水提物,说明花椒叶醇提物的抗氧化能力高于其水提物。
2.2.2 对黑腹果蝇SOD和GSH-Px活性的影响 根据上述实验结果,为评价花椒叶的体内抗氧化活性,进一步分析花椒叶醇提物对黑腹果蝇SOD和GSH-Px活性的影响,结果见图2。由图2可以看出:用添加花椒叶醇提物的培养基饲养的雌性和雄性黑腹果蝇体内的SOD活性均高于空白组(花椒叶醇提物质量浓度0.0 mg·mL-1)。其中,低剂量组(花椒叶醇提物质量浓度0.1 mg·mL-1)的雌性黑腹果蝇的SOD活性极显著低于高剂量组(花椒叶醇提物质量浓度0.3 mg·mL-1)(P<0.01),但低、高剂量组的雌性黑腹果蝇的SOD活性均显著(P<0.05)或极显著高于空白组;而高剂量组的雄性黑腹果蝇的SOD活性略低于低剂量组,差异不显著(P>0.05),但低、高剂量组的雄性黑腹果蝇的SOD活性均显著高于空白组。
表3 花椒叶提取物质量浓度与ABTS+·和DPPH·清除率的拟合方程及半效剂量(IC50)1)
Table 3 Fitting equation of mass concentration of extracts from leaf ofZanthoxylumbungeanumMaxim. with scavenging rate to ABTS+· and DPPH·and half effect dose (IC50)1)

提取物Extracts与ABTS+·清除率的拟合方程FittingequationwithABTS+·scavengingrate方程EquationR2与DPPH·清除率的拟合方程FittingequationwithDPPH·scavengingrate方程EquationR2IC50/mg·mL-1S1S2VC(阳性对照Positivecontrol)y=17.832ln(x)+155.820.8491y=15.303ln(x)+143.210.90810.00260.0023醇提物Ethanolextractsy=-9414.3x2+2001.9x+1.07570.9991y=-8243.8x2+1540.8x+11.0630.98700.02820.0301水提物Aqueousextractsy=329.32x2+1005.4x+4.25080.9904y=-5290.8x2+1351.8x+1.69320.98680.04480.0430
1)y: 清除率Scavenging rate;x: 提取物质量浓度Mass concentration of extracts. S1: 对ABTS+·的半效剂量 Half effect dose to ABTS+·; S2: 对DPPH·的半效剂量 Half effect dose to DPPH·.

□: 雌虫 Female insect; ■: 雄虫 Male insect.
BG: 空白组(0.0 mg·mL-1) Blank group (0.0 mg·mL-1); LDG: 低剂量组(0.1 mg·mL-1) Low dose group (0.1 mg·mL-1); HDG: 高剂量组(0.3 mg·mL-1) High dose group (0.3 mg·mL-1).
图2 花椒叶醇提物对黑腹果蝇雌虫和雄虫SOD(A)和GSH-Px(B)活性的影响
Fig. 2 Effect of ethanol extracts from leaf ofZanthoxylumbungeanumMaxim. on activities of SOD (A) and GSH-Px (B) in female and male insects ofDrosophilamelanogasterMeigen
由图2还可以看出:高剂量组的雄性黑腹果蝇的GSH-Px活性最高,低剂量组次之,空白组最低,且低剂量组和高剂量组的雄性黑腹果蝇的GSH-Px活性均显著高于空白组;低剂量组和高剂量组的雌性黑腹果蝇的GSH-Px活性虽然略高于空白组,但差异不显著。
3 讨论和结论
上述研究结果表明:花椒叶中含有丰富的营养成分。花椒叶的总蛋白质含量高达204.727 g·kg-1,明显高于新型蔬菜红薯〔Ipomoeabatatas(Linn.) Lam.〕叶的总蛋白质含量(4.3~36.3 g·kg-1)[12];花椒叶蛋白质的E/T值为46.57%,高于WHO推荐的优质蛋白质资源标准(36%);除色氨酸未做检测外,花椒叶中含有全部的人体必需氨基酸;花椒叶中氨基酸的AAS平均值为254.24%,符合WHO规定的氨基酸模式要求[13];花椒叶中人体必需氨基酸和半必需氨基酸的含量分别为114.534和52.967 g·kg-1,均明显高于木本蔬菜植物香椿〔Toonasinensis(A. Juss.) Roem.〕叶(分别为85.1和15.4 g·kg-1)[14];花椒叶中粗脂肪含量(2.07%)低于红薯叶中的粗脂肪含量(3.68%)[15],符合人们的健康营养需求;粗纤维具有防治便秘和降血脂等功效,灰分则反映了矿物质等无机营养成分的含量,花椒叶中粗纤维和灰分的含量分别为5.69%和6.67%,低于红薯叶中粗纤维和灰分的含量(分别为11.71%和11.03%)[15]。综合分析结果表明:花椒叶所含的蛋白质品质较好、氨基酸种类齐全且组成合理,在不考虑其他因素的情况下可以作为优良的植物蛋白质来源。
李谷才等[16]的研究结果表明花椒果皮多糖具有较强的羟基自由基清除能力;齐素芬等[2]认为花椒叶粗多糖也具有一定的抗氧化活性;李君珂等[17]的研究结果显示,花椒叶多酚提取物可以有效降低白鲢咸鱼的脂肪氧化水平,使之易于形成较佳的风味、色泽和口感;范菁华等[1]认为花椒叶类黄酮提取物对羟基自由基等具有较强的清除能力。本研究结果表明,花椒叶中可溶性多糖含量为8.50 g·kg-1、醇提物中总多酚和类黄酮的含量分别为552.71和133.63 g·kg-1,这些活性成分均为花椒叶的抗氧化活性成分。
花椒叶水提物和醇提物均具有一定的自由基清除能力,且提取物的质量浓度与自由基清除率之间呈明显的量效关系,其中醇提物对自由基的清除能力较强。考虑到体外实验的局限性[18],采用国际通用的模式生物黑腹果蝇进一步研究花椒叶醇提物的体内抗氧化活性,并以与机体氧化应激密切相关的抗氧化酶(antioxidant enzyme)[19]SOD和GSH-Px活性为指标,结果显示花椒叶醇提物能够提高黑腹果蝇的SOD和GSH-Px活性。花椒叶醇提物中含约55%总多酚和13%类黄酮,而多酚和类黄酮通常具有良好的抗氧化活性[10,17,20]。据此推断,花椒叶醇提物的抗氧化活性很可能与其中含有较丰富的多酚和类黄酮有关。多酚与类黄酮是重要的植物活性成分,除了具有较强的抗氧化活性外,多酚还具有防治癌症、心血管疾病、糖尿病和骨质疏松症等药理活性[21],类黄酮还具有抗菌、抗炎和抗肿瘤等生物活性[19],因而,对花椒叶多酚和类黄酮的生理功能亟需进一步研究。
[1] 范菁华, 徐怀德, 李钰金, 等. 超声波辅助提取花椒叶总黄酮及其体外抗氧化性研究[J]. 中国食品学报, 2010, 10(6): 22-28.
[2] 齐素芬, 张华峰, 姚 美, 等. 苯酚-硫酸法测定花椒叶多糖含量[J]. 食品科学技术学报, 2015, 33(4): 40-46.
[3] YANG X A,YU W,OU Z P,et al.Antioxidant and immunity activity of water extract and crude polysaccharide fromFicuscaricaL. fruit[J]. Plant Foods for Human Nutrition, 2009, 64: 167-173.
[4] CAO J, XIA X, DAI X, et al. Flavonoids profiles, antioxidant, acetylcholinesterase inhibition activities of extract fromDryoathyriumboryanum(Willd.) Ching[J]. Food and Chemical Toxicology, 2013, 55: 121-128.
[5] 牛丽丽, 张华峰, 杨晓华, 等. 4种小檗科植物叶片的蛋白质及氨基酸组成分析[J]. 植物资源与环境学报, 2013, 22(4): 105-107.
[8] WANG X S,TANG C H,YANG X Q,et al.Characterization, amino acid composition andinvitrodigestibility of hemp (CannabissativaL.) proteins[J]. Food Chemistry, 2008, 107: 11-18.
[10] ZHANG H F, ZHANG X, YANG X H, et al. Microwave assisted extraction of flavonoids from cultivatedEpimediumsagittatum: extraction yield and mechanism, antioxidant activity and chemical composition[J]. Industrial Crops and Products, 2013, 50: 857-865.
[11] WU P, MA G, LI N, et al. Investigation ofinvitroandinvivoantioxidant activities of flavonoids rich extract from the berries ofRhodomyrtustomentosa(Ait.) Hassk[J]. Food Chemistry, 2015, 173: 194-202.
[12] WALTER W M, Jr., PURCELL A E, McCOLLUM G K. Labora-tory preparation of a protein-xanthophyll concentrate from sweet potato leaves[J]. Journal of Agricultural and Food Chemistry, 1978, 26: 1222-1226.
[13] De OLIVEIRA SOUSA A G, FERNANDES D C, ALVES A M, et al. Nutritional quality and protein value of exotic almonds and nut from the Brazilian Savanna compared to peanut[J]. Food Research International, 2011, 44: 2319-2325.
[14] 葛多云, 邹盛勤. 香椿叶中氨基酸和营养元素分析[J]. 微量元素与健康研究, 2005, 22(6): 23-24.
[15] SUN H, MU T, XI L, et al. Sweet potato (IpomoeabatatasL.) leaves as nutritional and functional foods[J]. Food Chemistry, 2014, 156: 380-389.
[16] 李谷才, 袁立华, 张 儒, 等. 花椒水溶性多糖的提取及其体外抗氧化活性研究[J]. 食品工业科技, 2011, 32(8): 258-260.
[17] 李君珂, 刘森轩, 刘世欣, 等. 花椒叶多酚提取物对白鲢咸鱼脂肪氧化及脂肪酸组成的影响[J]. 食品工业科技, 2015, 36(15): 109-113.
[18] VRAILAS-MORTIMER A, GOMEZ R, DOWSE H, et al. A survey of the protective effects of some commercially available antioxidant supplements in genetically and chemically induced models of oxidative stress inDrosophilamelanogaster[J]. Experimental Gerontology, 2012, 47: 712-722.
[19] ORR W C, SOHAL R S. Extension of life-span by overexpression of superoxide dismutase and catalase inDrosophilamelanogaster[J]. Science, 1994, 263: 1128-1130.
[20] 张华峰, 王 瑛, 黄宏文. 黄酮类化合物生物合成途径的进化及其在淫羊藿中的研究展望[J]. 中草药, 2006, 37(11): 1745-1751.
[21] FANG Z, BHANDARI B. Encapsulation of polyphenols: a review[J]. Trends in Food Science and Technology, 2010, 21: 510-523.
(责任编辑: 张明霞)
Chemical composition ofZanthoxylumbungeanumleaf, andinvitroantioxidant activity of leaf extracts and its effect on antioxidant enzyme activity inDrosophilamelanogaster
SUN Chenqian, WANG Zhengqi, YAO Mei, ZHANG Huafeng①
(Key Laboratory of Ministry of Education for Medicinal Resources and Natural Pharmaceutical Chemistry, National Engineering Laboratory for Resources Development of Endangered Crude Drugs in Northwest China, College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710062, China),
J.PlantResour. &Environ., 2015, 24(4): 38-44
Taking leaf of cultivar ‘Dahongpao’ofZanthoxylumbungeanumMaxim. collected from Xi’an of Shaanxi as research material, contents of nutrient components and active components, andinvitroantioxidant activity of its aqueous extracts and ethanol extracts were analyzed, and effects of ethanol extracts fromZ.bungeanumleaf oninvivosuperoxide dismutase (SOD) and glutathione-peroxidase (GSH-Px) activities inDrosophilamelanogasterMeigen were researched. The results show that total protein content inZ.bungeanumleaf is 204.727 g·kg-1, and main components in protein are gliadin, glutenin, albumin and globulin. Total content of amino acids reaches 245.941 g·kg-1with 16 kinds of amino acids. E/T value, average values of CS and AAS of amino acids are 46.57%, 148.86% and 254.24%, respectively. Contents of crude fiber, crude fat, ash, moisture and soluble sugar are 5.69%, 2.07%, 6.67%, 9.13% and 8.50 g·kg-1, respectively. Contents of total polyphenol and flavonoids in ethanol extracts are 552.71 and 133.63 g·kg-1, respectively. Both aqueous extracts and ethanol extracts fromZ.bungeanumleaf have a certain scavenging ability to ABTS+·and DPPH·, in which, scavenging rate of 0.08 mg·mL-1ethanol extracts to ABTS+·(99.75%) is close to that of positive control VC(99.78%), and that of 0.08 mg·mL-1aqueous extracts to ABTS+·is slightly lower than thatofVC. Scavengingrateof0.10 mg·mL-1ethanolextractsandaqueousextractsis82.27%and 81.34%, respectively, which is slightly lower than that of VC. Mass concentrations of ethanol extracts and aqueous extracts fromZ.bungeanumleaf have obvious dose-effect relations to scavenging rate of free radicals, in which, scavenging ability of ethanol extracts to free radicals is stronger,IC50value of ethanol extracts to ABTS+·and DPPH·is 0.028 2 and 0.030 1 mg·mL-1, respectively. Adding 0.1 and 0.3 mg·mL-1ethanol extracts fromZ.bungeanumleaf in culture medium forD.melanogastercan significantly or obviously significantly enhance SOD activity in female and male ofD.melanogasterand GSH-Px activity in male ofD.melanogaster, but has no significant effect on GSH-Px activity in female ofD.melanogaster. It is suggested that content of protein inZ.bungeanumleaf is high, quality of protein is better, and composition of amino acids is balance, meaning thatZ.bungeanumleaf reaches the standard for high quality vegetable protein resources. Ethanol extracts and aqueous extracts fromZ.bungeanumleaf have a certain antioxidant activity, which may be related to higher contents of polyphenol and flavonoids.
ZanthoxylumbungeanumMaxim. leaf; nutrient components; active components; antioxidant activity; antioxidant enzyme;DrosophilamelanogasterMeigen
2015-03-31
中央高校基本科研业务费专项资金项目(GK201503002); 陕西省科技合作计划项目(2014SJ-01); 陕西省自然科学基础研究计划项目(2015JM3101); 国家农业部农产品加工重点实验室开放课题项目(2015010)
孙晨倩(1991—),女,陕西咸阳人,硕士研究生,主要从事粮食、油脂与植物蛋白质工程方面的研究。
①通信作者 E-mail: isaacsau@sohu.com
S573+.9; TS207.3
A
1674-7895(2015)04-0038-07
10.3969/j.issn.1674-7895.2015.04.05

