吻内侧被盖核(RMTg)参与吗啡引起的大鼠睡眠紊乱
胡珍真 尹 豆 叶宸搏 孙焕欣 杨素荣△
(1复旦大学基础医学院药理学系 上海 200032; 2复旦大学药学院药理学与生物化学教研 上海 201203)
吻内侧被盖核(RMTg)参与吗啡引起的大鼠睡眠紊乱
胡珍真1尹 豆2叶宸搏1孙焕欣1杨素荣1△
(1复旦大学基础医学院药理学系 上海 200032;2复旦大学药学院药理学与生物化学教研 上海 201203)
目的 旨在阐明吻内侧被盖核(rostromedial tegmental nucleus,RMTg)是否参与吗啡引起的大鼠睡眠障碍。方法 将雄性SD大鼠随机分为溶剂对照组和吗啡组,每组7只,对照溶剂为人工脑脊液(artificial cerebrospinal fluid,ACSF)。采用脑立体定位、核团微量注射和睡眠记录与解析等技术观察RMTg内给予吗啡对大鼠睡眠-觉醒周期的影响。结果 与对照组相比,双侧RMTg 给予吗啡(16 mmol/L,每侧0.5 μL)可以引起大鼠长达4 h的觉醒,期间非快动眼(non-rapid eye movement,NREM)睡眠深度降低、快动眼(REM)睡眠减少的现象与吗啡临床用药所引起的睡眠障碍的表现相一致。结论 RMTg参与吗啡引起的大鼠睡眠紊乱。
吗啡; 睡眠; μ-型阿片受体(μOR); 吻内侧被盖核(RMTg); 大鼠
吗啡(morphine)作为一种阿片类的强效镇痛剂在临床广泛使用。然而,它在治疗疼痛的同时会引发一系列不良反应,包括睡眠障碍。本课题组前期研究表明,系统给予吗啡可以通过作用于睡眠中枢腹外侧视前区的μ-型阿片受体(μ-opioid receptor,μOR)抑制睡眠相关神经元而诱导大鼠的觉醒行为[1]。2009年被正式命名的一个中脑结构——吻内侧被盖核(rostromedial tegmental nucleus,RMTg)被发现向觉醒相关核团腹侧被盖区(ventral tegmental area,VTA)有密集的神经纤维投射[2],同时接受觉醒相关的网状结构和被盖核的支配[3],且富含μOR[2-4]。与众多神经行为调节一样,吗啡治疗中引起患者的睡眠紊乱可能也存在多靶点、多通路的调控网络。本研究中,我们采用神经核团微量注射的方法,观察吗啡对大鼠睡眠觉醒行为的影响,研究其促觉醒作用的潜在靶点,为治疗吗啡用药伴发的睡眠障碍提供一定的参考。
材 料 和 方 法
实验动物 SPF级雄性SD大鼠(290~340 g,8~10周龄)由中科院上海实验动物中心提供,许可证号SCXK(沪)2007-0005。每只大鼠仅供一次实验使用,不重复利用。动物分笼饲养在睡眠觉醒生物解析系统专用饲养笼中。饲养环境:恒温(24±1) ℃、恒湿60%±2%、隔音、静电屏蔽、自动光控12 h/12 h 明暗周期(光照度≈100 lux,开灯时间为7:00,关灯时间为19:00),动物可自由获取食物和水。实验过程中尽最大可能减少动物使用量及动物所遭受的痛苦。实验方案得到复旦大学实验动物伦理委员会批准。
试剂与药品 盐酸吗啡注射液(morphine hydrochloride injection,东北制药集团公司沈阳第一制药厂,批号080808-2)以新鲜配制的人工脑脊液(artificial cerebrospinal fluid,ACSF)稀释到16 mmol/L,避光保存,给药量为每侧0.5 μL。水合氯醛(国药集团化学试剂有限公司,批号80096628);牙托粉和牙托水(上海张江生物材料有限公司)。
主要仪器 微型手持式颅钻(型号78001,深圳市瑞沃德生命科学有限公司);脑立体定位仪(型号68002,深圳市瑞沃德生命科学有限公司);微量进样器(1 μL,上海高鸽工贸有限公司);脑电波数据分析软件SleepSign 3.0(日本Kissei Comtec株式会社);睡眠觉醒生物解析系统VitalRecorder 3.0(日本Biotex Kyoto公司)。
手术埋置记录电极和给药套管 用10%水合氯醛(360 mg/kg,i.p.)麻醉动物,用剃毛器剃去大鼠头颈部毛发,将其固定于脑立体定位仪上,用75%酒精消毒手术区,切开颅顶皮肤,剥离皮下组织,刮除骨膜,暴露颅骨前后囟。参考文献[5]进行定位,以前囟为参考点,中线右侧旁开2~3 mm,前后方向(+2.0、-2.0 mm)以0.8 mm 钻头钻孔,以穿透颅骨但不伤及脑组织为宜, 作为脑电图(electroencephalogram,EEG)记录电极螺丝安装位置;中线左侧对称位置以1.0 mm钻头钻孔,不打通颅骨,为参考电极螺丝安装位置;后囟前后取中线左右等距离的两点以1.0 mm 钻头钻孔,不打通颅骨,为支持螺丝所在位置。
于大鼠前囟后6.8 mm,旁开0.3 mm,用0.8 mm 钻头钻通颅骨,两侧开孔前外侧2 mm 处分别钻不通透的孔并旋上螺丝。借助脑立体定位仪垂直臂上的夹持器将不锈钢套管(长度为19 mm,外径为0.6 mm,带内芯)从颅骨表面缓慢竖直深入7.4 mm,套管末端至RMTg 正上方1 mm(图 1),用牙科水泥固定套管于同侧支持螺丝上,待水泥彻底固化后撤去夹持器。
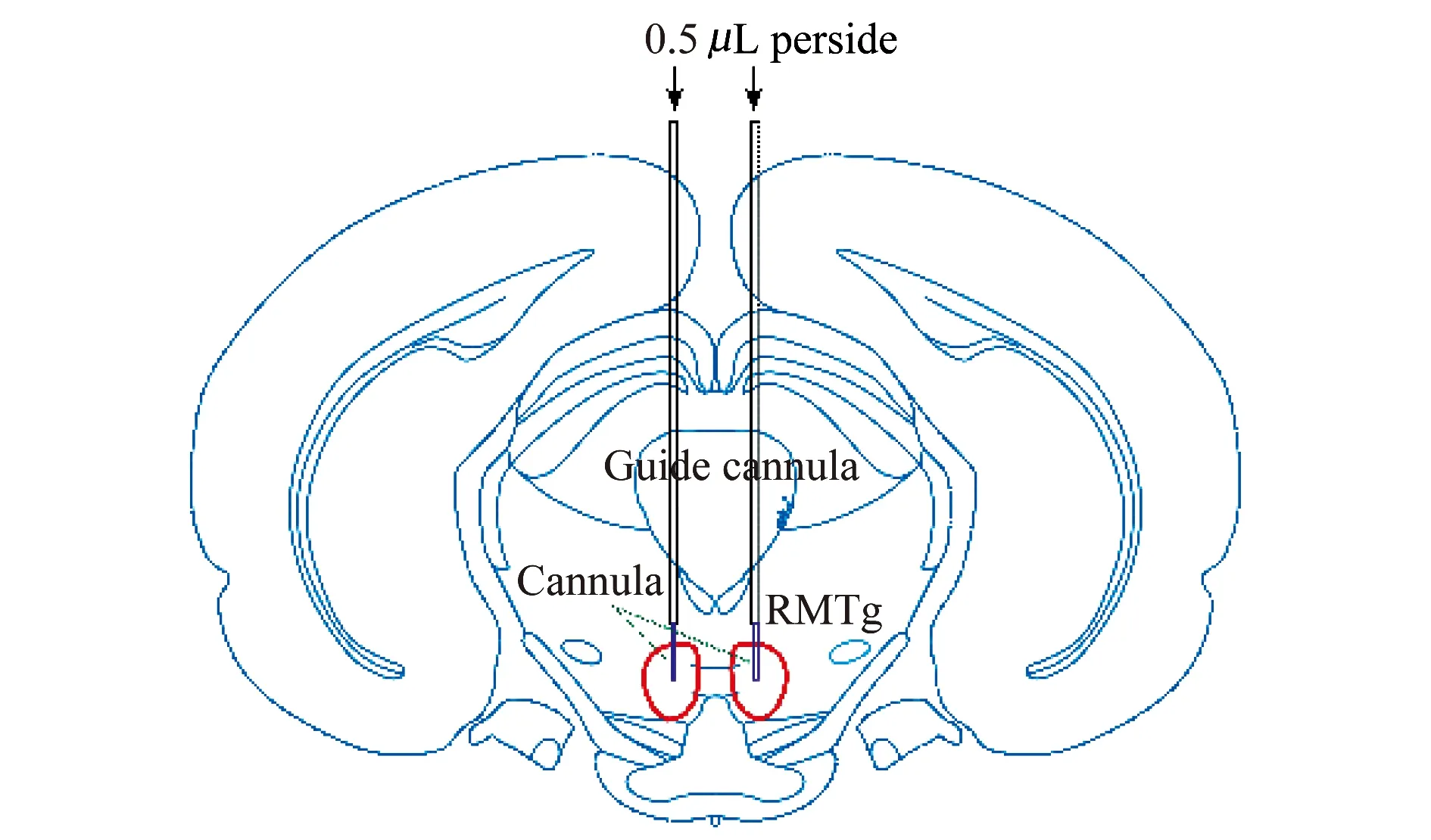
图1 核团微量注射给药模式图Fig 1 Schematic diagram of microinjection
将电极和套管装好后,用牙托粉将电极与颅骨紧密贴合固定,将两根采集肌电图(electromyogram,EMG)的电极插入颈部肌肉内,涂撒青霉素钠,缝合创口。将动物以侧卧势放置于37 ℃ 恒温热板上直至苏醒,苏醒后的动物单笼饲养,恢复1周后用于脑电波记录。动物在记录笼中适应至少2天后开始记录。
实时记录与核团微量注射给药 7:00开始记录脑电波,9:00 经套管给予μOR 激动剂吗啡(morphine,MOR),参考文献[6]并经预实验确定MOR浓度为16 mmol/L(配药浓度为3 mg/mL),以ACSF作为对照,给药容积为0.5 μL/侧。给药时,给药针深入并超出套管末端1 mm,保证给药针尖端正好处于RMTg核团正中央位置。
EEG/EMG解析 EEG/EMG记录完毕,采用SleepSign解析软件,以10 s为解析单元,按统一设定的标准(图2)自动扫描判定觉醒W(wake)、非快动眼睡眠S(non-rapid eye movement sleep,NREM)和快动眼睡眠R(REM)。自动扫描完毕,进行人工核查,必要时修正[7]。将大鼠睡眠觉醒分为:觉醒(W)、非快速眼动睡眠(S)和快速眼动睡眠(R):S 时,脑电δ波(0.65~4 Hz)占优势,波幅大,EMG安静;R 时,EEG θ波(6~10 Hz)占优势,波幅较小,EMG安静;W 时,EEG波幅进一步减小,EMG活跃。其中,REM属于进入睡眠的第1阶段,由浅入深又可细分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期,EEG波幅越大、EMG越安静表示睡眠越深;REM属于睡眠的第2阶段,有明显的眼球运动,EMG安静,但机体其他各项生理活动更趋向于觉醒时的状态。
结 果
吗啡微量注射引起大鼠觉醒增加 表1所示:给予ACSF或吗啡前后8 h大鼠觉醒量、NREM睡眠量和REM睡眠量的时程分析,及给药后4 h觉醒量、NREM睡眠量和REM睡眠量的总量。
RMTg局部微量注射16 mmoL吗啡,观察动物的睡眠觉醒量的改变。时程分析表明,吗啡引起的觉醒相对ACSF 组在4 h内有差异,NREM睡眠减少,REM睡眠无变化。统计4 h睡眠觉醒总量显示,核团微量注射吗啡可使大鼠觉醒量增加98.00% (P<0.001),同时NREM和REM睡眠分别减少89.40% (P<0.001)和98.99% (P<0.05)。以上结果表明RMTg局部给予吗啡可以明显减少大鼠NREM和REM睡眠量。
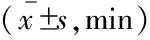
表1 微量注射吗啡至RMTg引起大鼠觉醒量增加Tab 1 Wakefulness was increased by microinjection of morphine into RMTg in rats
ACSF:Artificial cerebrospinal fluid;MOR:Morphine.vs.ACSF control group,(1)P<0.05;(2)P<0.01.In each group,n=7.
吗啡微量注射引起大鼠睡眠觉醒结构改变 图3显示:给予ACSF或吗啡后的4 h内,大鼠觉醒、NREM睡眠和REM睡眠3个时相不同时程的片段发作次数和时相转换(图3A),包括各时相片段总数(图3B)、各时相片段的平均持续时间(图3C)以及时相转换次数(图3D)。
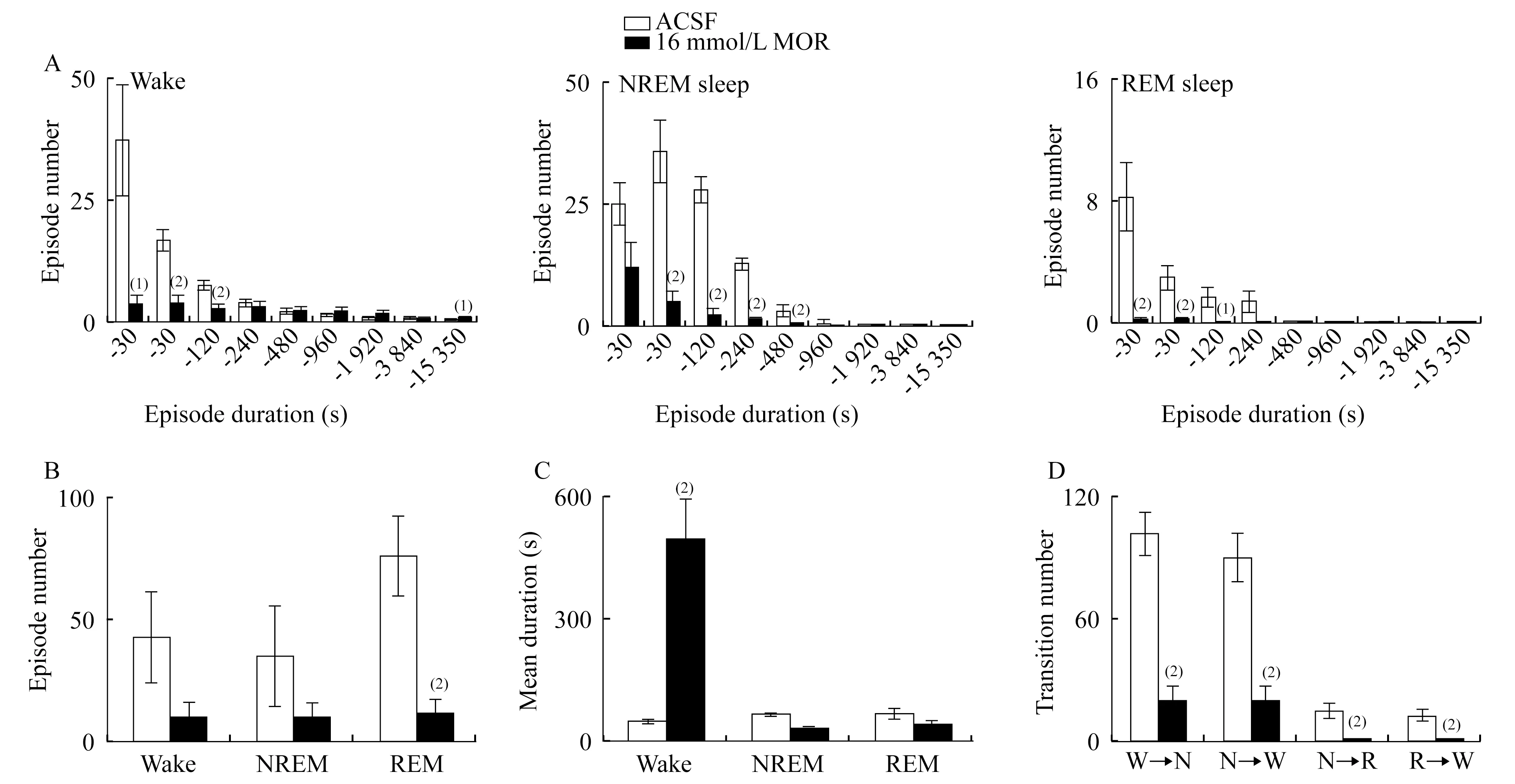
图3 吗啡微量注射后睡眠觉醒的片段发作次数与时相转换分析Fig 3 Episode number and stage transition analysis of sleep-wake behavior after microinjection of morphineThe bars represented episode duration(A),episode number(B),mean duration(C)and transition number(D)during the following 4 h after the microinjection of ACSF or morphine.vs.ACSF control group,(1)P<0.05;(2)P<0.01.Data were shown as(n=7).
RMTg 局部微量注射吗啡,观察动物的睡眠结构。该剂量吗啡引起大鼠短时觉醒片段的减少但超长时程片段增加,而NREM和REM睡眠片段普遍减少。结果表明,觉醒和NREM睡眠片段有减少趋势,但与ACSF组相比差异无统计学意义,而在REM睡眠片段的减少方面,差异有统计学意义。片段平均持续时间分析显示,觉醒片段的平均持续时间显著延长,而NREM和REM睡眠无显著性改变。这些结果说明,吗啡微量注射引起觉醒的增加来源于觉醒片段的平均持续时间大大延长,REM睡眠的减少主要是因为REM片段的发作次数明显减少,而NREM睡眠的减少是片段次数和时程均有减少趋势造成的。同时发现,大鼠各时相之间的转换次数均明显减少,呈现去片段化睡眠现象。
吗啡微量注射引起大鼠睡眠深度降低 RMTg局部微量注射吗啡后观察动物的睡眠深度,记录给予ACSF或吗啡后的4 h内大鼠NREM睡眠脑波不同频率的能量密度(图4)。关注NREM睡眠(以0.5~4 Hz为主),可见此频段的百分比降低,通常认为典型的REM睡眠(4~6 Hz)和觉醒(6~10 Hz)的成分有所增加,更高频段(代表活跃状态的觉醒)的分布连续增加,说明吗啡不仅引起觉醒量的增加,且觉醒状态的动物异常活跃;而动物睡眠量减少且深度有所降低。
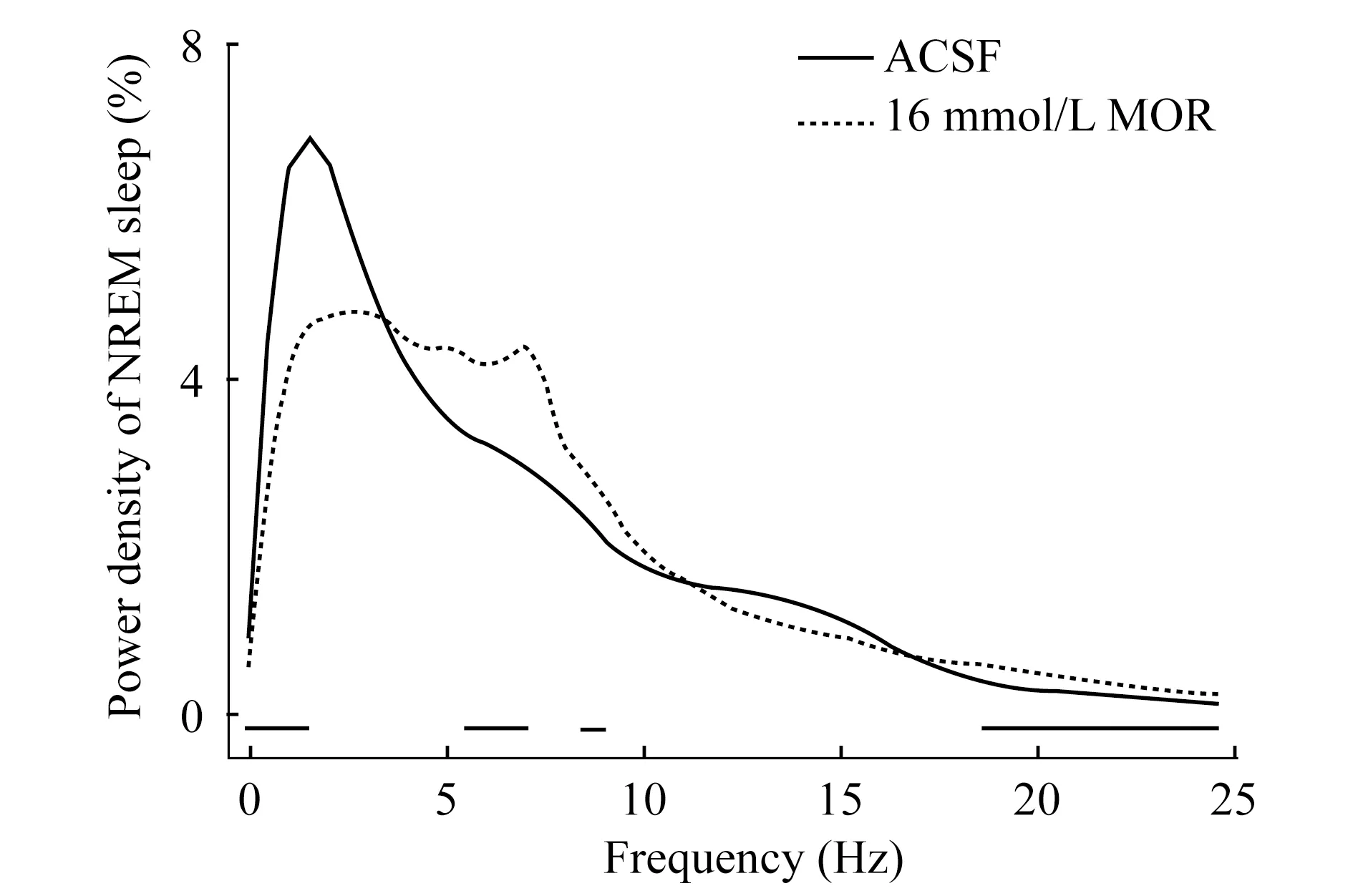

The curves represented logarithmic mean values of absolute power densities of NREM sleep during the 4 h after the administration.The horzontal bars indicated a statistical difference (P<0.05) between ACSF group and MOR group.ACSF:Artifical cerebrospinal fluid; MOR:Morphine.
讨 论
睡眠是人类的普遍行为,人生大约1/3在睡眠中度过。然而很多人深受失眠之苦,睡眠医学作为一门新生学科,仍有众多谜团亟待破解。
睡眠障碍通常表现为入睡困难、维持睡眠困难、过早觉醒和睡后无恢复感,可引起躯体功能障碍或明显不适,及时运用镇静催眠药有助于避免失眠损害人体健康和正常生活。镇痛药吗啡是从罂粟中提取的一种生物碱,近年来大量实验发现植物中的多种化学成分具有不同程度的镇静安神作用,尤其一些中药复方制剂治疗失眠效果显著且不良反应少而备受关注。例如中药复方制剂和颜®坤泰胶囊(熟地黄、黄连、白芍、阿胶、黄芩、茯苓)在治疗女性围绝经期、卵巢早衰、妇科肿瘤的放化疗或手术等引起的失眠具有独到的疗效,是个成功的案例。这些研究结果为我们二次开发和提取作用靶点明确的单体类镇静催眠药提供了线索,同时也为开发新的镇静催眠药物奠定了基础。失眠机制与催眠药物的研究并驾齐驱,将能提高人们的睡眠质量,降低失眠的痛苦。
吗啡及其代谢物可以透过血脑屏障(blood brain barrier),这为研究其临床疗效(无论是镇痛作用还是不良反应)的中枢机制提供了保证。核团微量注射是对局部神经核团进行药理学操控的常用手段,借助套管对特定核团给予特定受体的激动剂或拮抗剂可模拟该脑区神经元的兴奋或抑制效应。我们用μOP激动剂吗啡干预RMTg局部的神经元,观察到大鼠长达4 h的觉醒,伴随NREM和REM睡眠减少,而且NREM睡眠深度降低,与吗啡临床应用时引起患者浅睡眠增加、深睡眠减少的报道一致[8-9],说明RMTg是吗啡引起睡眠紊乱可能的中枢作用靶点之一。
今后的研究中,我们需要关注RMTg参与吗啡促觉醒作用的下游可能的神经通路。其直接兴奋皮层引起觉醒,还是通过去抑制GABA能的神经投射兴奋下游的多巴胺系统介导觉醒[10]?其次,吗啡是μOR的非选择性激动剂,需要进一步明确其觉醒作用的受体机制。另外,大量研究显示RMTg与吗啡成瘾密切相关[11],但具体作用机制尚不明确,其成瘾机制和觉醒机制是否有类似的神经解剖学基础也值得研究。本研究采用单次微量注射吗啡观察到RMTg参与了吗啡促觉醒作用,而吗啡慢性用药引起睡眠障碍的情况可能更为复杂,有待进一步研究。
[1] Wang Q,Yue XF,Qu WM,etal.Morphine inhibits sleep-promoting neurons in the ventrolateral preoptic area via mu receptors and induces wakefulness in rats [J].Neuropsychopharmacology,2013,38(5):791-801.
[2] Jhou TC,Geisler S,Marinelli M,etal.The mesopontine rostromedial tegmental nucleus:A structure targeted by the lateral habenula that projects to the ventral tegmental area of Tsai and substantia nigra compacta [J].JCompNeurol,2009,513(6):566-596.
[3] Bourdy R,Barrot M.A new control center for dopaminergic systems:pulling the VTA by the tail [J].TrendsNeurosci,2012,35(11):681-690.
[4] Jhou TC,Xu SP,Lee MR,etal.Mapping of reinforcing and analgesic effects of the mu opioid agonist Endomorphin-1 in the ventral midbrain of the rat [J].Psychopharmacology(Berl),2012,224(2):303-312.
[5] Paxinos G,Watson G.大鼠脑立体定位图谱 [M].3版.诸葛启钏,译.北京:人民卫生出版社,2005.
[6] Lecca S,Melis M,Luchicchi A,etal.Effects of drugs of abuse on putative rostromedial tegmental neurons,inhibitory afferents to midbrain dopamine cells [J].Neuropsychopharmacology,2011,36(3):589-602.
[7] Qu WM,Huang ZL,Xu XH,etal.Dopaminergic D1 and D2 receptors are essential for the arousal effect of modafinil [J].JNeurosci,2008,28(34):8462-8469.
[8] Dimsdale JE,Norman D,DeJardin D,etal.The effect of opioids on sleep architecture [J].JClinSleepMed,2007,3(1):33-36.
[9] Shaw IR,Lavigne G,Mayer P,etal.Acute intravenous administration of morphine perturbs sleep architecture in healthy pain-free young adults:a preliminary study [J].Sleep,2005,28(6):677-682.
[10] Kaufling J,Veinante P,Pawlowski SA,etal.Gamma-aminobutyric acid cells with cocaine-induced delta FosB in the ventral tegmental area innervate mesolimbic neurons [J].BiolPsychiatry,2010,67(1):88-92.
[11] Jalabert M,Bourdy R,Courtin J,etal.Neuronal circuits underlying acute morphine action on dopamine neurons [J].ProcNatlAcadSciUSA,2011,108(39):16446-16450.
The rostromedial tegmental nucleus (RMTg) participates in sleep disruption caused by morphine in rats
HU Zhen-zhen1, YIN Dou2, YE Chen-bo1, SUN Huan-xin1, YANG Su-rong1△
(1DepartmentofPharmacology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China;2DepartmentofPharmacologyandBiochemistry,SchoolofPharmacy,FudanUniversity,Shanghai201203,China)
Objective To clarify the potential role of rostromedial tegmental nucleus (RMTg) in morphine-caused sleep disruption in rats. Methods Male SD rats were randomly divided into vehicle control group (n=7) treated with artificial cerebrospinal fluid (ACSF) and morphine group (n=7).By using brain stereotaxic,nucleus microinjection and sleep recording techniques,we observed the effects of microinjection of morphine into rat RMTg on the sleep-wake cycle. Results Compared with the control group,microinjection of morphine (16 mmol/L,0.5 μL perside) into the bilateral RMTgs induced 4-hour wakefulness.During this period,the depth of non-rapid eye movement (NREM) sleep became light and the amount of rapid eye movement sleep decreased,which conformed to the phenotype of sleep disruption caused by clinical morphine usage. Conclusions The RMTg may be involved in the sleep disruption caused by morphine in rats.
morphine; sleep; μ-opioid receptor (μOR); rostromedial tegmental nucleus (RMTg); rat
上海市科委资助项目(11ZR1402000);上海市重点学科建设项目(B119);上海市卫计委资助项目(2010234)
R 96
A
10.3969/j.issn.1672-8467.2015.02.002
2014-09-24;编辑:段佳)
△Corresponding author E-mail:sryang@shmu.edu.cn
*This study was supported by the Project of Shanghai Committee of Science and Technology (11ZR1402000),Shanghai Leading Academic Discipline Project (B119),and the Project of Shanghai Municipal Commision of Health and Family Planning (2010234).

