盐胁迫下黄豆亚属植物游离脯氨酸积累响应的差异分析
徐 明,徐靖宇,杨冬爽,张 婧,金晓飞,石连旋
(1.东北师范大学生命科学学院,吉林长春130024;2.吉林省农作物新品种引育中心,吉林长春130062)
盐胁迫下黄豆亚属植物游离脯氨酸积累响应的差异分析
徐 明1,徐靖宇1,杨冬爽1,张 婧1,金晓飞2,石连旋1
(1.东北师范大学生命科学学院,吉林长春130024;2.吉林省农作物新品种引育中心,吉林长春130062)
以中国同一纬度的不同黄豆亚属植物为试验材料,通过分析栽培大豆、半野生大豆、耐盐型野生大豆、盐敏感型野生大豆在盐胁迫下的生长及游离脯氨酸代谢的响应过程,研究了黄豆亚属植物生理代谢的演化趋势及进化规律.结果表明:耐盐型野生大豆游离脯氨酸含量的增加主要取决于鸟氨酸合成途径的增强;栽培大豆游离脯氨酸含量的变化与谷氨酸合成途径的增强及其降解途径的显著增加有关;半野生大豆游离脯氨酸含量的变化与鸟氨酸、谷氨酸合成途径的增强以及降解途径的降低均密切相关.黄豆亚属植物适应环境选择的压力以及人工选育的需要,体内游离脯氨酸代谢途径发生了显著的变化.
大豆;进化;盐胁迫;酶活性;游离脯氨酸
栽培大豆(Glycine max(linn.)Merr.)是世界上主要的农作物,也是重要的经济作物之一.其同一属还包括有半野生大豆(Glycine gracilis Skv.)和野生大豆(Glucine sojaSieb.et Zucc.),这3个物种具有明显的亲缘关系[1-2].野生大豆在适应生长环境过程中也产生了不同的生态类型,如在高盐环境下生长的野生大豆抗盐性显著增强,形成了抗盐型野生大豆[3].将同一纬度不同黄豆亚属植物一起进行比较研究,有助于对大豆属植物进化历程的理解.
游离脯氨酸是植物体内重要的渗透调节物质,其在植物体内有两种合成途径,关键的限速酶分别是Δ1-吡咯啉-5-羧酸合成酶(P5CS)和鸟氨酸转氨酶(δ-OAT).脯氨酸在植物体内降解途径的限速酶为脯氨酸脱氢酶(ProDH)[4-6].脯氨酸代谢过程和含量与植物对逆境胁迫的适应有着密切的关系,它的积累量与逆境水平、抗性密切关联[7].
大豆属植物进化的研究,不仅仅是基础生物学的问题,在大豆种质资源利用方面也具有重要的意义.对现存生态群体从形态学、细胞学、生理生化、分子生物学等方面进行系统的比较实验生物学研究,是目前大豆起源进化研究的根本方法[8].本研究以中国同一纬度的不同黄豆亚属植物为试验材料,人工模拟盐胁迫处理大豆幼苗,测定了其生长参数、叶片游离脯氨酸含量以及脯氨酸代谢过程中关键酶的活性,分析了盐胁迫下不同黄豆亚属植物生长及脯氨酸代谢的响应过程,以从生理代谢的角度揭示豆科黄豆亚属植物的进化规律和演化趋势,为大豆种质资源的利用以及大豆新品种的选育提供参考.
1 试验材料与方法
1.1 试验材料
试验材料:栽培大豆(M)、半野生大豆(S)、盐敏感型(W1)和耐盐型(W2)野生大豆种子,吉林省农作物新品种引育中心提供.其中栽培大豆品种为吉农24,耐盐型野生大豆保存号为Tongyu06311,盐敏感型野生大豆保存号为Huinan06116.
1.2 试验设计
将供试材料采用沙培方式进行培养,花盆直径为19cm.出苗后每盆定苗5株,并于每天清晨用2倍Hoagland营养液浇灌一次,待幼苗生长到3出复叶时期开始进行盐胁迫处理.胁迫处理溶液采用NaCl和Na2SO4(n(NaCl)∶n(Na2SO4)=1)及1倍Hoagland营养液配制,其中Na+浓度为45mmol/L;对照组用1倍Hoagland营养液浇灌.每一处理5盆重复.胁迫处理3周后采集植物叶片,进行相关参数的测量.收集试验材料地上部分和地下部分,测定株高和根长;测定后将植物材料120℃杀青,80℃烘干至恒重,分别对地上部分和地下部分进行称重.
1.3 游离脯氨酸含量及其代谢关键酶活性的测定
游离脯氨酸含量测定采用磺基水杨酸法-酸性茚三酮方法[9];Δ1-吡咯啉-5-羧酸合成酶(P5CS)活性的测定采用Hayzer的方法[10],酶活性单位定义为单位时间内生成1μmolγ-谷氨酞胺所需要的酶量,以U/(g·min)(鲜重)表示;鸟氨酸转氨酶(δ-OAT)活性的测定采用余光辉等的方法[11],以单位时间内生成1mmolΔ-吡咯啉-5-羧酸(P5C)的量为一个δ-OAT活性单位;脯氨酸脱氢酶(ProDH)活性的测定采用赵福庚等的方法[12],以D(600)/(g·min)(鲜重)为一个酶活力单位.采用UV754N紫外-可见分光光度计进行比色.
1.4 数据处理
采用SPSS Statistics 18.0软件进行数据统计分析,数据取15次重复的平均值,以(平均值±标准误差)表示;采用单向方差分析法(ANOVA)进行多重比较(P<0.05);采用Sigma Plot 10.0软件完成图表的绘制.
2 结果分析
2.1 盐胁迫下不同黄豆亚属植物生长的变化
不同黄豆亚属植物植株干重差异显著.无盐胁迫下,植株地上部分干重和根干重均表现为栽培大豆>半野生大豆>野生大豆.盐胁迫下不同黄豆亚属植物地上、地下部分干重均呈下降的趋势,半野生大豆下降最高,其次是栽培大豆和野生大豆.盐胁迫下,不同黄豆亚属植物胁变反应差异明显,地上部分干重栽培大豆和盐敏感型野生大豆、耐盐型野生大豆的降低幅度分别为21.27%,20.95%,22.15%;半野生大豆的降低幅度较小,比对照组降低了8.19%.根干重栽培大豆、半野生大豆、盐敏感型野生大豆,分别比对照组降低了26.22%,21.39%,46.15%,耐盐型野生大豆与对照组相比无显著差异(见图1).
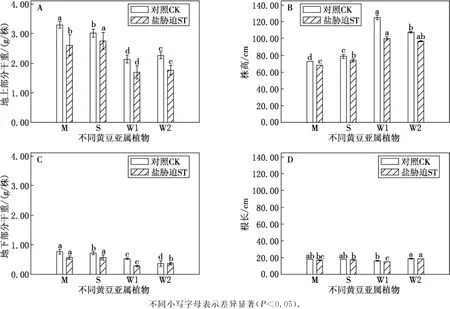
图1 盐胁迫下不同黄豆亚属植物地上部分干重、株高、地下部分干重、根长的变化
盐胁迫下,4种大豆植株的高度均呈降低的变化趋势,但降低的幅度显著不同,栽培大豆、半野生大豆、耐盐型野生大豆分别比对照组降低了6.94%,5.81%,9.91%,盐敏感型野生大豆降低的幅度最大,比对照组降低了20.16%.无盐胁迫时,耐盐型野生大豆的根最长,其次为栽培大豆和半野生大豆,盐敏感型野生大豆的根较短;盐胁迫下,除耐盐型野生大豆的根长无显著性变化外,其他均呈下降趋势,其中栽培大豆、半野生大豆、盐敏感型野生大豆分别比对照组降低了7.22%,5.56%,7.50%(见图1).
2.2 盐胁迫下不同黄豆亚属植物游离脯氨酸含量的变化
无盐胁迫下,不同黄豆亚属植物叶片游离脯氨酸含量差异显著(见表1),半野生大豆含量为最高,分别比栽培大豆、盐敏感型野生大豆、耐盐型野生大豆高32.14%,23.33%,131.25%.盐胁迫后,不同黄豆亚属植物叶片游离脯氨酸含量均呈现升高的趋势(见表1),半野生大豆含量同样为最高.但是,游离脯氨酸含量增加幅度显著不同,其中耐盐型野生大豆的变化幅度最大,为43.75%;其次为栽培大豆和半野生大豆,分别为16.22%,17.86%,盐敏感型野生大豆增加趋势不显著.

表1 盐胁迫下不同黄豆亚属植物叶片游离脯氨酸含量(FW)μg/g
2.3 盐胁迫下不同黄豆亚属植物游离脯氨酸代谢关键酶活性的变化
盐胁迫下,不同黄豆亚属植物叶片P5CS活性差异显著,半野生大豆叶片的P5CS活性为最高,分别比栽培大豆和盐敏感型野生大豆高59.38%.同时,只有栽培大豆呈现出降低的趋势,比对照组降低了18.84%;半野生大豆呈现增加的趋势,比对照组增加了28.26%;而野生大豆与对照组相比无显著性变化.无胁迫下,不同黄豆亚属植物叶片δ-OAT活性并无显著性差异;盐胁迫时,δ-OAT活性变化各异,栽培大豆和半野生大豆变化不显著,均比盐敏感型野生大豆高27.94%;而盐敏感型野生大豆比耐盐型野生大豆低11.54%.当受到盐胁迫时,不同黄豆亚属植物的叶片δ-OAT活性变化幅度不同,栽培大豆比对照组增加了14.15%,其他与对照组相比均无显著性差异.无胁迫时,半野生大豆叶片的ProDH活性最高,分别比栽培大豆和盐敏感型野生大豆高178.13%,123.43%,盐敏感型野生大豆比栽培大豆高24.48%,比耐盐型野生大豆低53.14%.在盐胁迫下,只有半野生大豆ProDH活性呈降低的趋势,比对照组降低了39.51%;栽培大豆和盐敏感型野生大豆叶片ProDH活性呈现增加的趋势,分别比对照组增加104.17%,61.92%;而耐盐型野生大豆ProDH活性与对照组相比,无显著差异(见图2).
3 讨论与结论
目前关于豆科大豆属黄豆亚属中各类型间的分类地位及其遗传关系一直都存在着很大的争议[13-15].盐胁迫下,植物生物量等生长参数的变化显示了受盐胁迫抑制的程度以及抗胁迫能力的高低[16].本试验的结果表明,生物量、株高、根长等生长参数的变化均显示出耐盐型野生大豆的抗逆性强于盐敏感型野生大豆;而栽培大豆的抗逆性低于盐敏感型野生大豆.这与前人的研究结果相一致[17],同时也为后续游离脯氨酸的分析提供了依据和基础.
游离脯氨酸是最有效的渗透调节物质之一.游离脯氨酸的积累量与植物适应逆境的能力有着密切的关系[18-19].从游离脯氨酸含量的测试分析可以看出,耐盐型野生大豆的游离脯氨酸增加的幅度远远大于盐敏感型野生大豆、半野生大豆和栽培大豆,表现出较强的渗透调节能力.植物体内有两条脯氨酸合成途径,谷氨酸途径是由谷氨酸通过两步连续还原合成脯氨酸,关键酶为Δ1-吡咯啉-5-羧酸合成酶;鸟氨酸途径是由鸟氨酸通过转氨基作用后又经还原作用生成脯氨酸,关键酶为鸟氨酸转氨酶;而脯氨酸的降解主要依赖于脯氨酸脱氢酶[7].本试验结果证实,盐胁迫下,耐盐型野生大豆、半野生大豆和栽培大豆脯氨酸代谢途径的变化有着明显的不同.耐盐型野生大豆游离脯氨酸含量的增加主要取决于鸟氨酸合成途径的增强;栽培大豆游离脯氨酸含量的变化与谷氨酸合成途径增强及其降解途径的显著增加有关;而半野生大豆游离脯氨酸含量的变化与鸟氨酸和谷氨酸合成途径的增强以及降解途径的降低均密切相关.同时,本试验结果显示,4种不同黄豆亚属植物游离脯氨酸的积累主要受鸟氨酸合成途径与脯氨酸降解途径控制.
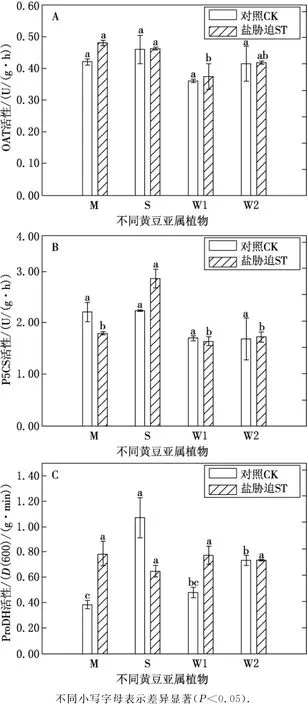
图2 盐胁迫下不同黄豆亚属植物脯氨酸代谢关键酶(δ-OAT、P5CS、ProDH)活性的变化
野生大豆、半野生大豆、栽培大豆3种不同黄豆亚属植物随着自然环境的选择以及人工栽培的选育,植物体内游离脯氨酸代谢途径也随之发生着变化.耐盐型野生大豆为了适应盐渍化环境,脯氨酸合成增加的同时其降解过程未出现类似栽培大豆的增强,因此,游离脯氨酸在体内大量积累,进而适应盐环境.栽培大豆在合成增加的同时其降解过程也大幅度提高,因此脯氨酸积累量显著小于耐盐型野生大豆.半野生大豆脯氨酸代谢过程与3种关键酶均密切相关,与栽培大豆和野生大豆均不同,可以认为,其属于黄豆亚属植物进化过程中的一个中间类型.
[1] 王克晶,李福山,海妻矩彦,等.中国河北省和日本东北部天然野生大豆群体性状调查比较[J].中国油料作物学报,2000,22(4):17-22.
[2] WU X L,HE C Y,CHEN S Y.The diversity and evolution relation of Glycine[J].Nature Science Progress,2001(7):689-698.
[3] TUYEN D D,LAL S K,XU D H.Identification of a major QTL allele from wild soybean(Glycine sojaSieb.&Zucc.)for increasing alkaline salt tolerance in soybean[J].Theor Appl Genet,2010,121:229-236.
[4] DELAUNEY A J,HU C A A,KISHOR P B K,et al.Cloning of ornithine-aminotransferase cDNA fromVigna aconitifolia by trans-complementation in Escherichia coli and regulation of proline biosynthesis[J].Biol Chem,1993,268:18673-18678.
[5] KISHOR P B K,SANGAM S,AMRUTHA R N,et al.Regulation of proline biosynthesis,degradation,up-take and transport in higher plants:its implications in plant growth and abiotic stress tolerance[J].Current Science,2005,88:424-438.
[6] 夏方山,董秋丽,董宽虎.碱性盐胁迫对碱地凤毛菊苗期脯氨酸代谢途径的影响[J].中国草地学报,2011,33(1):48-52.
[7] 赵贵林,陈强,胡国霞,等.水稻脯氨酸代谢关键酶对水分胁迫的响应[J].干旱地区农业研究,2011,29(3):80-83.
[8] 田清震,盖钧镒.大豆起源与进化研究进展[J].大豆科学,2001,20(1):54-59.
[9] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2005:161-162.
[10] HAYZER D J,LEISINGER T.The gene-enzyme relationships of proline biosynthesis in Escherichia Coli.J.Gen[J].Microbiol,1980,118:287-293.
[11] 余光辉,刘正辉,曾富华,等.脯氨酸累积与其合成关键酶活性的关系[J].湛江师范学院学报,2002,23(6):57-60.
[12] 赵福庚,孙诚,刘友良,等.ABA和NaCl对碱蓬多胺和脯氨酸代谢的影响[J].植物生理与分子生物学学报,2002,28(2):117-120.
[13] 王克晶,李向华.中国野生大豆(Glycine soja)遗传资源主要形态、遗传变异和结构[J].植物遗传资源学报,2012,3(6):917-928.
[14] 吴三玲.半野生大豆(Glycine gracilis)基因组深度测序及其进化分析[D].浙江:浙江大学,2013:3-4.
[15] WANG K J,LI X H.Interspecific gene flow and the origin of semi-wild soybean revealed by capturing the natural occurrence of in-trogression between wild and cultivated soybean populations[J].Plant Breeding,2011,130:117-17.
[16] 刘滨硕,康春莉,李忠民,等.不同盐碱梯度生境下羊草根茎生长的研究[J].东北师大学报:自然科学版,2013,45(3):110-114.
[17] 罗庆云,於丙军,刘友良,等.大豆苗期耐盐性鉴定指标的检验[J].大豆科学,2001,20(3):178-182.
[18] 阮成江,谢庆良.盐胁迫下沙棘的渗透调节效应[J].植物资源与环境学报,2002,11(2):45-47.
[19] 郭立泉,王红宇,麻莹,等.星星草响应盐碱胁迫的渗透调节和离子平衡机制[J].东北师大学报:自然科学版,2010,42(2):120-125.
The difference analyses on free proline metabolism of plant soybeans subgenus under salt stress
XU Ming1,XU Jing-yu1,YANG Dong-shuang1,ZHANG Jing1,JIN Xiao-fei2,SHI Lian-xuan1
(1.School of Life Sciences,Northeast Normal University,Changchun 130024,China;2.Jilin Center of Germplasm Introduction and Breeding of Crops,Changchun 130062,China)
In order to explore the different physiological metabolism evolution trend and evolution between cultivated soybean,semi-wild soybean,salt tolerance wild soybean,salt sensitive wild soybean,the response of growth and metabolism process of proline under salt stress were investigated.The results showed that,the increasing proline content of salt tolerance wild soybean depended on the enhancing of ornithine pathway;the change of proline content in cultivated soybean depended on the enhancing of both glutamate pathway and degradation;and that of semi-wild soybean depends on all three pathways.Significant changes had happened in proline metabolism pathway of sojain order to adapt to the environment selection pressure and the requirement for artificial breeding.
soybean;evolution;salt stress;enzyme activity;free proline
Q 945.79 [学科代码] 180·5140
A
(责任编辑:方 林)
1000-1832(2015)03-0122-05
10.16163/j.cnki.22-1123/n.2015.03.025
2014-11-15
国家自然科学基金资助项目(31270366).
徐明(1990—),女,硕士研究生;通讯作者:石连旋(1972—),男,博士,副教授,主要从事大豆生理生态学研究.

