三黄泻心汤有效成分逆转LPS诱导急性肾损伤的机制研究
白羽,肖箫,薛莹雪,张楠,徐广宇
(1.吉林医药学院 药学院,吉林 吉林 132013;2.吉林大学第一医院,吉林 长春 130021;3.北华大学 药学院,吉林 吉林 132013)
三黄泻心汤有效成分逆转LPS诱导急性肾损伤的机制研究
白羽1,肖箫1,薛莹雪1,张楠2,徐广宇3Δ
(1.吉林医药学院 药学院,吉林 吉林 132013;2.吉林大学第一医院,吉林 长春 130021;3.北华大学 药学院,吉林 吉林 132013)
目的 研究三黄泻心汤有效成分对脂多糖(lipopolysaccharide, LPS)诱导急性肾损伤的逆转机制。方法 将C57BL/6小鼠随机分为6组:对照组、LPS组、大黄酸组、小檗碱组、黄芪苷组和地塞米松组,每组8只,对照组腹腔注射生理盐水0.5 mL,其余各组腹腔注射LPS(0.1 mL/g)。除LPS组外,其余各组在注射LPS 2 h之前分别注射大黄酸(0.1 mL/g)、小檗碱(0.1 mL/g)、黄芩苷(0.1 mL/g)、地塞米松(0.001 mL/g)。作用1 d后断头处死小鼠并采血,使用诊断试剂盒及全自动生化分析仪检测尿素氮及肌酐情况;酶联免疫检测试剂盒对血清中TNF-α和IL-6浓度进行定量;取肾脏组织进行HE染色及免疫组化;Western blot法检测凋亡蛋白表达。结果 与对照组相比,其余各组小鼠血中的尿素氮、肌酐、TNF-α和IL-6含量明显下降(P<0.05)。HE染色见LPS处理的肾小管上皮细胞肿胀、变性、脱落,管腔狭小且出现管型及渗出物,肾间质水肿,有炎症细胞的浸润。而其余各组与LPS相比上述症状均明显减轻。免疫组化结果显示LPS组Bax、Caspase3的表达明显增多,而其余各组的表达减少。但Bcl-2在LPS组明显减少,在其余各组却增多。Western blot结果显示LPS组凋亡蛋白Bax、Cleave-caspase3、CytoC表达增多,而其余各组较LPS组减少。但Bcl-2在LPS组表达减少而在其余各组的表达增多。结论 三黄泻心汤有效成分能逆转LPS诱导的急性肾损伤,其作用机制与糖皮质激素地塞米松的作用相类似。
三黄泻心汤;大黄酸;小檗碱;黄芩苷;急性肾损伤
急性肾损伤是由多种治病因素导致的肾功能急剧恶化的临床急症,部分继发于肾脏基础疾病,但也常常由肾外因素所导致[1]。由于起病后肾功能急转直下,常常导致临床治疗难以赶上肾功能恶化的速度,因而病死率极高。近年来提出的急性肾损伤治疗方案主要以血液净化及皮质醇激素治疗为主,但这些治疗费用昂贵,亦或副作用较多,使临床治疗陷入了僵局[2-3]。三黄泻心汤的有效成分为大黄酸、小檗碱和黄芪苷,具有抗氧化应激,清除炎性介质的作用[4]。本实验旨在通过研究三黄泻心汤有效成分对急性肾损伤的逆转作用,为临床中急性肾损伤的救治提供新思路。
1 材料与方法
1.1 实验动物 选择4~6周雄性C57BL/6小鼠48只,体质量18~20 g,由吉林大学动物实验中心提供,合格证号:SCXK-(吉)2003-0001。
1.2 药品与试剂 大黄酸、小檗碱、黄芩苷(中国药品生物制品检定所,批号分别为0757-200405、110713-200208、110715-200514);地塞米松(山东新华有限公司,批号:37020644);LPS(英国Sigma公司,110M4086V)。
组织裂解液RIPA(购自北京诺博莱德科技有限公司);NE-PER核蛋白-胞浆蛋白抽提试剂盒(购自上海索莱宝生物科技有限公司);Bax、Bcl-2、CytoC、caspase3、β-actin抗体(购自Santa Cruz Biotechnology);小鼠TNF-α和IL-6 ELISA试剂盒(购自美国R&D公司);肌酐、尿素氮试剂盒(购自南京建成生物科技公司);免疫组化试剂(购自北京中杉公司)。
1.3 主要实验仪器 台式控温离心机(德国Eppendorf公司);蛋白质转膜装置(上海仪器总场);倒置显微镜、全自动显微镜数码摄像机(日本OLYMPUS);电泳仪(美国Bio-rad)。
1.4 方法 取大黄酸1 mg溶于10 μL 1 mol/LNaOH中,加90 μL PBS中低温保存,使用时稀释1000倍。分别取小檗碱、黄芩苷1 mg溶于100 μL DMSO中,低温保存使用前稀释1000倍。1 mg LPS溶于1 mL细胞培养液中,地塞米松为原液(5 mg/mL)。
1.4.1 实验分组:参照陈燕[5]对急性肾损伤小鼠模型的构造并稍作修改,将48只C57BL/6小鼠,随机分为6组(n=8),即对照组、LPS组、大黄酸组、小檗碱组、黄芪苷组和地塞米松组。对照组小鼠给予腹腔注射0.5 mL生理盐水,其余各组给予腹腔注射LPS(0.1 mL/g)。其中大黄酸组、小檗碱组、黄芪苷组在注射LPS 前2 h分别给予腹腔注射大黄酸、小檗碱、黄芪苷0.1 mL/g。地塞米松组在注射LPS前2 h腹腔注射地塞米松0.001 mL/g。各组在LPS注射1 d后断头处死小鼠。收集血液1.5 mL以备生化及炎症因子等检测使用,分别取6组肾脏组织冻存固定,以备后续试验使用。
1.4.2 检测血液生化指标及血清中TNF-α和IL-6的含量:将上述步骤制备的小鼠血液置于室温3000 r/min离心10 min,得到血清样本,使用诊断试剂盒及全自动生化分析仪检测尿素氮及肌酐情况。严格按照酶联免疫检测试剂盒说明书的步骤,对血清中TNF-α和IL-6浓度进行定量。
1.4.3 肾脏组织HE染色及凋亡蛋白表达的测定:将保存的小鼠肾脏组织固定后,通过HE染色方法用倒置显微镜(×400)观察各组肾脏组织的形态。肾脏组织的凋亡蛋白的表达采用免疫组化法测定Bax、Bcl-2、Cyto C、Caspase3的表达,并在显微镜观察组织中蛋白表达情况。
1.4.4 Western blot检测:参照陈燕[5]的方法并稍作修改对小鼠的肾脏进行Western blot检测。肾脏总蛋白、胞浆及胞核蛋白的提取:将100 mg肾脏组织用液氮处理后研磨成粉末,移至离心管。向离心管中加入800 μL组织裂解液RIPA。冰上孵育10 min后置于室温10 min,于4 ℃,12000 r/min,离心20 min。收集上清液后分装。于-80 ℃保存。参照NE-PER核蛋白-胞浆蛋白抽提试剂盒说明书的步骤提取细胞核和胞浆蛋白,-80 ℃保存备用。
蛋白浓度测定采用二喹啉甲酸法测定细胞浆、细胞核提取物及总蛋白。之后配置聚丙烯酰胺凝胶,依次进行SDS-PAGE电泳、转膜、封闭、抗体孵育、ECL显色。使用GIS凝胶图像分析系统对特异性条带进行灰度扫描,以β-actin或LaminB1作为内参。

2 结果
2.1 生化指标及TNF-α和IL-6含量的测定 与对照组相比,LPS组中尿素氮、肌酐、TNF-α和IL-6显著升高(P<0.05),表明急性肾损伤模型复制成功。与LPS组相比,大黄酸组、小檗碱组、黄芪苷组、地塞米松组的尿素氮、肌酐、TNF-α和IL-6均明显降低(P<0.05)。见表1。

表1 各组尿素氮、肌酐、TNF-α和IL-6比较Tab.1 Comparison of urea nitrogen, serum creatnine, TNF-α and IL-6 of every ±s)
*P<0.05,与对照组相比,compared with control group;#P<0.05,与LPS组相比,compared with LPS group
2.2 肾脏组织HE染色及凋亡蛋白表达的测定 光镜下观察HE染色的肾脏组织,经LPS处理的肾小管上皮细胞肿胀、变性、脱落,管腔狭小且出现管型及渗出物,肾间质水肿,有炎症细胞的浸润。而其余各组与LPS相比上述症状明显减轻。见图1。

图1 肾脏组织形态学的HE染色(×400)Fig.1 Kidney tissue morphology of HE staining(×400)
采用免疫组化的方法检测凋亡蛋白Bax、Bcl-2、caspase3的表达。在注射LPS后的小鼠肾脏组织发生了凋亡,由图中可看出LPS的凋亡程度严重,而其余各组的凋亡程度有不同程度的减轻。与对照组相比,LPS组Bax、Caspase3的表达明显增多,而其余各组的表达减少但Bcl-2在LPS组明显减少,在其余各组却增多。见图2。
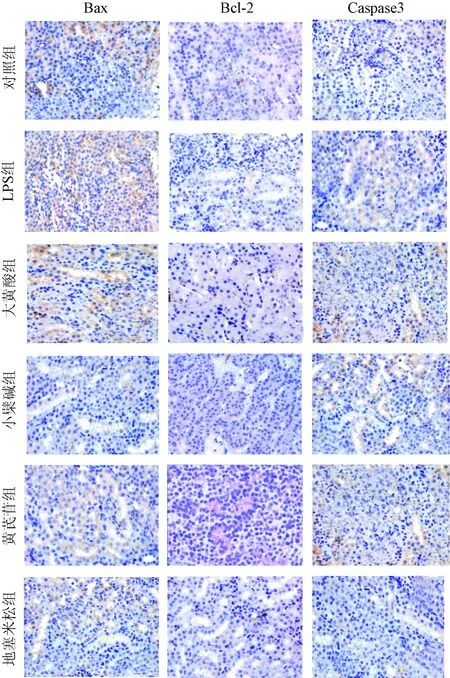
图2 免疫组化检测肾脏组织Bax、Bcl-2和Caspase3的表达(×400)Fig.2 Organize the expression of Bax,Bcl-2 andCaspase3 immunohistochemical detection of kidneys(×400)
2.3 Western blot结果 与对照组相比,LPS组Bax、caspase3 的表达明显增多(P<0.05),Bcl-2明显减少(P<0.05),而CytoC的增多不明显。与LPS组相比,大黄酸组、小檗碱组、黄芪苷组的Bax、CytoC、Cleaved caspase3的表达明显减少(P<0.05),而Bcl-2的表达明显增多,但3者之间的变化并不明显。地塞米松组与LPS组相比Bax的表达明显减少,Bcl-2的表达明显增多(P<0.05)

图3 三黄泻心汤有效成分和地塞米松对LPS诱导AKI小鼠肾脏组织凋亡相关蛋白的表达的影响A.免疫印迹法检测Bax、Bcl-2、CytoC、Cleaved caspase3在肾脏组织的表达;B.肾脏组织Bax、Bcl-2、CytoC、Cleaved caspase3与β-actin的灰度值1.对照组;2.LPS组;3.大黄酸组;4.小檗碱组;5.黄芪苷组;6.地塞米松组*P<0.05,与对照组相比;#P<0.05,与LPS组相比Fig.3 The effective constituent of Sanhuangxiexin Decoction and dexamethason on apoptosis-related protein expression of kidney tissues in LPS-induced acute kidney injury miceA.Expression of Bax,Bcl-2,CytoC and Cleaved caspase3 in kidney tissues detected by Western blot; B.Density ratio of Bax, Bcl-2,CytoC and Cleaved caspase3 with β-actin1.Control group;2.LPS group;3.Rhein group;4.Berberine group;5.Baicalin group;6.Dexamethasone group* P<0.05,compared with control group;#P<0.05,compared with LPS group
3 讨论
急性肾损伤是由各种致病因素导致的肾功能迅速减退[6]。相关文献报道显示近10年内急性肾损伤的发病率及因急性肾损伤入院和入重症监护病房的患者数量逐年攀升[7-8]。目前大量的实验室研究集中在糖尿病肾病后中药的单体如大黄酸、小檗碱等对肾功能的逆转及修复[9-10]。有体外实验证实大黄酸可以抑制C-myc mRNA的表达,进而减少增殖细胞核抗原的表达而抑制系膜细胞的增殖[11]。同时大黄酸抑制系膜细胞增殖的效应还与周期素激酶抑制剂p27表达的上调有关[12]。小檗碱能够抑制p38MAPK信号通路对抗高糖诱导的系膜细胞的增殖及纤维连接蛋白和胶原的表达[13],显著抑制LPS诱导的系膜细胞增殖及NF-kB的核转位,使其下游因子ICAM-1、TGF-β1、iNOS及FN蛋白的表达减少[14]。而黄芩苷减轻糖尿病肾病的机制可能是通过提高SOD、GSH-PX等抗氧化酶在肾脏中的作用来清除氧自由基从而进一步减轻肾脏的损伤[15]。但急性肾功能衰竭在发病机制中也存在多种炎症介质的产生过多及超氧化物的损害的发生。现代的研究证实糖皮质激素能够通过减轻炎症介质的产生,清除超氧化物进而在急性肾损伤的过程中缓解急性期症状[16]。但上述中药单体成分是否具有和糖皮质激素相类似的作用相关的报道仍不多。本实验中大黄酸、小檗碱、黄芩苷作用于小鼠后在使用LPS诱导小鼠肾脏损伤,发现尿素氮、肌酐明显较LPS组下降(P<0.05),TNF-α、IL-6的量也明显减少(P<0.05)。同时在肾脏组织的形态学、免疫组化及凋亡蛋白的表达上也有相同的结果。地塞米松能够通过减轻肾小管细胞线粒体的损伤及对Bax/Bcl-2凋亡蛋白的直接调控而起到对急性肾损伤时细胞凋亡的抑制作用[16]。NF-κB是参与炎症衍生的重要转录因子,静息状态下是没有活性的,但当LPS和TNF-α等促炎因子的作用下促使IκB磷酸化导致IκB与NF-κB解离而降解成p56、p56进入核内而调节基因进而产生IL-6、TNF-α等,导致炎症因子的瀑布效应。本实验中发现三黄泻心汤的有效成分能有有效减少TNF-α、IL-6的产生进而抑制瀑布效应的发生,为临床当中三黄泻心汤治疗急性肾损伤提供了理论基础。
[1] Bellomo R,Ronco C,Kellum JA,et al.Acute renal failure-definition,outcome measures,animal models,fluid therapy and information technology needs:the Second International Consensus Conference of the Acute Dialysis Quality Initiative(ADQI)Group[J].Crit Care,2004,8(4):R204-R212.
[2] Brennan-Speranza TC,Henneicke H,Gasparini SJ,et al.Osteoblasts mediate the adverse effects of glucocorticoids on fuel metabolism[J].J Clin Invest,2012,122(11): 4172-4189.
[3] Ishani A,Xue JL,Himmelfarb J,et al.Acute kidney injury increases risk of ESRD among elderly[J].J Am Soc Nephrol,2009,20(1):223-228.
[4] 梅颖,三黄泻心汤对实验性肝损伤内毒素血症的影响研究[D].贵阳:贵阳中医学院,2007.
[5] 陈燕,人参二醇组皂苷改善LPS诱导急性肾损伤小鼠肾功能分子机制的研究[D].吉林:吉林大学,2014.
[6] KDIGO.Clinical Practice Guideline for Acute Kidney Injury[J].Kidney Int Suppl,2012,2(1):8-12.
[7] Mehta RL,Kellum JA,Shah SV,et al.Acute Kidney Injury Network:report of an initiative to improve outcomes in acute kidney injury[J].Crit Care,2007,11(2):R31.
[8] Hosted EA,Clermont G,Kersten A,et al.RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients:a cohort analysis[J].Crit Care,2006,10(3):R73.
[9] Ambroisine ML,Millis P,Nehme J,et al.Aldoste rone and anti-aldoster one Effects in cardiovascular diseases and diabetic nephropathy[J].Diabetes Metab,2004.30(4):311-318.
[10] Sato A,Hayashi K.Antiproteinuric effects of mineraloco rtieoid receptor blockade in patients with Chronic renal disease[J].Am J Hypertens,2005,18(1):44-49.
[11] Li X,Liu W,Wang Q,et al.Emodin suppresses cell Proliferati 0n and fibronectin expression via P38MAPK pathway in rat mesangial cells cultured under high glueose[J].Mol Cell Endoerino,2009,307(l-2):157-162.
[12] 姚建,黎磊石,周红.大黄素对培养人系膜细胞纤维连接蛋白产生的抑制作用[J].肾脏病与透析肾移植杂志,1994,3(5):349-351.
[13] Jiang Q,Liu PQ,Wu XQ,et al.Berberine attenuates lipopolysa ccharide一induced extracelluar matrix accumulation and inflammation in rat mesangial cells:Involvement of NF-kappa B signaling pathway[J].Mol Cell Endoerinol,2011,331(1):34-40.
[14] Lan TA,Shen XY,Liu PQ,et al.Berberine ameliorates renal injure in diabetic C57BL/6 mice:Involvement of suppression of SPhK-S1p signaling pathway [J] .Arch Biochem Biophys,2010,502(2):112-120.
[15] 苏宁,罗荣敬,苏杭,等.黄芩苷对糖尿病肾病大鼠肾功能及其抗氧化应激作用的研究[J].中药新药与临床药理,2007,1S(5):341-344.
[16] Choi HM,Jo SK,Kim SH,et al.Glucocorticoids attenuate septic acute kidney injury[J].Biochem Biophys Res Commun,2013,435(4):678-684.
(编校:王冬梅)
Study on mechanism of active ingredients in Sanhuang Xiexin Decoction on acute kidney injury induced by lipopolysaccharide
BAI Yu1, XIAO Xiao1, XUE Ying-xue1, ZHANG-Nan2, XU Guang-yu3Δ
(1.Department of Pharmacy, Jilin Medical College, Jinlin 132013, China; 2.The First Hospital of Jilin University, Changchun 130021, China; 3.Department of Pharmacy, Beihua University, Jinlin 132013, China)
ObjectiveTo research on reversal mechanism of active ingredients of Sanhuang Xiexin Decoction on lipopolysaccharide-induced acute kidney injury.MethodsC57BL/6 mice were randomly divided into 6 groups: control group, LPS group, rhein group, berberine group, baicalin group and dexamethasone group.8 mice in each group.Control group were injected intraperitoneally with 0.9%NaCl 0.5 mL, and the remaining groups were injected intraperitoneally with LPS 0.1 mL/g.The mice of rhein group, berberine group, baicalin group and dexamethasone group were respectively injected intraperitoneally rhein, berberine, baicalin(0.1 mL/g) and dexamethasone(0.0001 mL/g) 2 h before LPS injection.One day after LPS treatment, mice were decapitated and blood collected, diagnostic kits and automatic biochemical analyzer were used to detected urea nitrogen and creatinine.TNF-α and IL-6 concentrations in serum were detected by ELISA kit.HE staining and immunohistochemistry were performed in the kidney tissues.expression of apoptosis protein detected by Western blot.ResultsCompared to control group, the blood urea nitrogen, serum creatnine, TNF-α and IL-6 level were significantly lower(P<0.05).HE staining found the renal tubular epithelial cell which treated with LPS were swelling, degeneration, loss, narrow lumen and tube type and exudate, renal interstitial edema, inflammatory cells infiltration.And symptoms of the other group were significantly slight.Immunohistochemical results showed that the expression of Bax and Caspase3 in LPS group was obviously increased, while the expression of the others group was decreased,neither did Bcl-2.Western blot results showed that apoptosis proteins Bax, Cleave-caspase3, CytoC expression increased of LPS group, while the other groups were lower than LPS group.But Bcl-2 expression reduced in LPS group and increased in others group.ConclusionThe effective constituent of Sanhuang Xiexin Decoction can reversal of LPS induced acute kidney injury and its mechanism of action is similar to that of dexamethason.
Sanhuang Xiexin Decoction; rhein; berberine; baicalin ;acute kidney injury
吴阶平医学基金(320.6750.13216和320.6750.13229),吉林省教育厅“十二五”,科学技术研究课题(吉教科合字[2014]第505号)
白羽,女,博士,讲师,研究方向:生物化学与分子生物学,E-mail:baiyu218@163.com;徐广宇,通讯作者,男,博士,讲师,研究方向:微生物与生化药学,E-mail:xuguangyu2005@163.com。
R692
A
1005-1678(2015)08-0011-04

