大鲵皮肤黏液糖蛋白的提取纯化及抗肺癌活性研究
徐伟良,陈德经,刘宇,魏泓,刘青
(1.陕西理工学院 生物科学与工程学院,陕西 汉中 723000;2.陕西理工学院 陕西省资源生物重点实验室, 陕西 汉中 723000;3.第三军医大学 基础部实验动物学教研室,重庆 400038)
大鲵皮肤黏液糖蛋白的提取纯化及抗肺癌活性研究
徐伟良1,陈德经2Δ,刘宇3,魏泓3,刘青1
(1.陕西理工学院 生物科学与工程学院,陕西 汉中 723000;2.陕西理工学院 陕西省资源生物重点实验室, 陕西 汉中 723000;3.第三军医大学 基础部实验动物学教研室,重庆 400038)
目的 研究大鲵皮肤黏液糖蛋白提取纯化工艺以及体外对人肺癌细胞A549活性的影响。方法 利用碱提取和DEAE-52离子交换层析与Sephadex G-100凝胶层析分离纯化大鲵黏液糖蛋白;并采用MTT比色法体外检测大鲵黏液糖蛋白对人肺癌细胞A549的抑制率。结果 黏液糖蛋白中的总糖含量为4.23%,经SDS-PAGE电泳检测,糖蛋白的分子量在30 kDa左右,为单一纯品。随糖蛋白纯品浓度从1、10、20、40 μg/mL逐渐增加,糖蛋白对A549细胞的抑制率逐渐增大;当糖蛋白浓度为40 μg/mL,作用24 h时,对A549细胞的抑制率可达85.66%,作用48 h时,可达92.32%。与阳性对照紫杉醇相比,大鲵皮肤黏液糖蛋白对人肺癌细胞A549有显著的抑制作用。结论 大鲵黏液糖蛋白对人肺癌细胞具有明显的抑制作用,可为抗肺癌药物的开发提供理论依据。
大鲵;皮肤黏液;糖蛋白;纯化;MTT法;抗肺癌
大鲵(AndriasdavidianusBlanchard)为大型两栖、有尾目、隐鳃鲵科[1]。大鲵皮肤腺体主要有黏液腺和颗粒腺2种,黏液腺体细胞可释放粘糖蛋白,与水结合后成为黏液,覆盖在上皮游离面,形成了一道天然的防护屏障[2-3]。曲敏等[4-6]从大鲵体表黏液获得了一种黏液低聚糖肽,并证明了该糖肽具有抗氧化、抗疲劳及对小鼠急性肝损伤有一定的保护作用。大鲵皮肤颗粒腺能够分泌具有特殊性气味的白色粘稠状黏液,其成分是含有丰富的功能,复杂多样的生物活性分子。王利锋等[7]从大鲵皮肤黏液中分离纯化出了一种小分子的抗菌肽,并证明其具有很好的广谱抗菌作用;郭文韬等[8]对大鲵皮肤分泌物的水溶组分进行体外抗肿瘤活性检测,实验表明分泌物可溶组分对小鼠腹水瘤细胞和人宫颈癌细胞有一定的抑制作用,但具体何种活性成分对抑制肿瘤细胞生长起作用目前还不清楚。糖蛋白是一类由糖和蛋白质以共价键连接而成的共价复合物[9],参与调节细胞的生长、分化、受精以及免疫等生命活动遍及始末,具有降血糖、抗氧化、抗肿瘤、抗衰老、增强免疫调节等作用[10-12]。
目前,体外抗肿瘤药物筛选的方法很多,主要有MTT比色法、同位素渗入法、流式细胞仪法、生物荧光法以及SRB 法等[13-14],其中MTT比色法是一种检测细胞生存和增殖状态的方法,具有简单、快速、精确等优点。本实验通过柱色谱法对大鲵皮肤黏液糖蛋白进行分离、纯化,并利用MTT比色法对所得糖蛋白纯品进行体外抗肺癌A549细胞活性检测,以期为大鲵黏液糖蛋白抗肿瘤药物的开发提供理论基础。
1 材料与方法
1.1 药品与试剂 大鲵皮肤黏液冻干粉(实验室自制);成熟大鲵(陕西汉源生物科技有限公司;人肺癌细胞系A549(第三军医大学实验动物中心);紫杉醇(大连美仑生物科技有限公司);DEAE-52纤维素(北京慧德易生物科技有限公司);Sephadex G-100、MW3500透析袋、胰蛋白酶、二甲基亚砜、MTT溶液(Sigma公司);RPMI-1640培养基(Gibco);胎牛血清(杭州四季青生物工程研究所);PBS缓冲液、氯仿、正丁醇、蒽酮均为分析纯。
1.2 主要实验仪器 CO2培养箱、酶标仪、倒置显微镜(Thermo公司);722G可见分光光度计(上海仪电分析仪器有限公司);自制凝胶层析系统[包括8823B紫外检测器、TBE-300A色谱工作站、TBP-50A恒流泵(均为上海同田生化技术公司)、BS-100A自动收集器(上海沪西分析仪器厂有限公司)、凝胶(1.6 cm×60 cm)层析柱(北京慧德易科技有限责任公司)]。
1.3 实验方法
1.3.1 大鲵皮肤黏液糖蛋白的提取与测定
① 碱提法提取糖蛋白:准确称量5 g大鲵皮肤黏液冻干粉,以0.4 mol/L NaOH溶液在料液比为1︰25,45 ℃温度下,提取2 h[15];将提取液以4000 r/min,离心15 min,上清液加入无水乙醇至终浓度为76%,调pH至7.0左右,于4 ℃冰箱中静置醇沉8 h;离心去除上清液,糖蛋白沉淀用无水乙醇洗涤3次,进行真空干燥。利用Sevage法脱蛋白,离心去除变性蛋白,重复数次,至无变性蛋白质析出为止。再经透析,浓缩,真空冷冻干燥,得糖蛋白粗品,并利用公式1计算得率:
粗糖蛋白得率%=糖蛋白粗品质量/黏液干粉称重量×100%(公式 1)。
② 糖蛋白中总糖含量的测定——蒽酮硫酸法:取0.1 g大鲵糖蛋白粗品定容至50 mL容量瓶中,取1 mL黏液糖蛋白溶液于试管中,采用蒽酮硫酸法同样步骤进行操作,于620 nm处进行比色测定OD值[16-17]。利用公式2计算总糖含量:
总糖含量(%)=(样品浓度×稀释倍数×样品体积)/糖蛋白试样质量×100% (公式 2)。
1.3.2 大鲵皮肤黏液糖蛋白的分离纯化
① DEAE-52离子交换层析:根据DEAE-52离子交换树脂性质和实际情况确定层析条件为:糖蛋白进样浓度为2~3 mg/mL,进样体积为1 mL,流速为0.5 mL/min,用0、0.05、0.2、0.4 mol/L的NaCl溶液进行分段洗脱。根据实验室自制的凝胶层析设备,在280 nm处实时监测样品洗脱状态,并以每管5 mL收集样品,用硫酸蒽酮法跟踪检测620 nm处多糖吸收值,同时以收集的管数为横坐标,吸光值(620 nm)为纵坐标绘制DEAE-52纤维素色谱柱洗脱曲线[18]。合并相同组分,减压浓缩,用透析袋(MW3500)透析24 h,以去除NaCl和小分子杂质,最后将透析液真空冷冻干燥,得到初步纯化的糖蛋白样品。
② Sephadex G-100凝胶柱层析:经DEAE-52纤维素初步纯化的糖蛋白用葡聚糖凝胶Sephadex G-100进一步分离纯化,上样糖蛋白浓度为2 mg/mL,上样量为柱体积的3%,用流速为0.5 mL/min的去离子水洗脱,每隔5 mL收集一管。用硫酸蒽酮法跟踪检测(620 nm处吸收值),合并相同组分,减压浓缩,真空冷冻干燥,得糖蛋白纯品[19]。
1.3.3 SDS-PAGE蛋白电泳鉴定:将纯化的大鲵黏液糖蛋白样品经分离胶、浓缩胶浓度分别为15%和5%的聚丙烯酰胺凝胶蛋白电泳估算糖蛋白样品的分子量。
1.3.4 糖蛋白体外抗肺癌活性实验
① 大鲵皮肤黏液糖蛋白的处理:将Sephadex G-100层析纯化得到的糖蛋白纯品用PBS缓冲液溶解,调整pH至7.0,经0.22 μm过膜除菌,通过蒽酮比色法测定其总糖浓度,并配制成1、10、20、40 μg/mL梯度的样品,-20 ℃保存待用。
② A549肺癌细胞株的培养:培养液为含体积分数为10%胎牛血清的RPMI1640培养液,将A549细胞从液氮罐中取出,迅速放入37 ℃水浴锅中快速溶解,并移入培养皿内(培养皿内先加入培养液),在37 ℃、饱和湿度、5%CO2培养箱中培养,每1~2d换液,传代培养[20]。
③ A549肺癌细胞的接种:将指数生长期的A549细胞用0.25%胰酶消化液消化脱壁,吹打细胞培养液使其形成单细胞悬液。然后取200 μL细胞悬液接种于96孔细胞培养板(6孔重复)中,使细胞约为5000~10000/孔,过夜培养[21-22]。经培养时间后,弃去原培养液,实验组加入新配制的含有不同浓度的大鲵皮肤黏液糖蛋白溶液100 μL;阳性对照组为1 mg/mL的紫杉醇试剂,阴性对照组加入等量的细胞培养液;在37 ℃、饱和湿度、5%CO2培养箱中培养24 h或48 h。
④ A549肺癌细胞生长抑制测定:细胞经培养实验要求时间后,加入MTT(5 mg/mL)20 μL,继续培养4 h,弃上清,每孔加入裂解液二甲基亚砜100 μL,37 ℃震荡温育30 min;于波长为570 nm的酶标仪上,测定各孔的吸光度值。并通过公式3计算A549肺癌细胞的生长抑制率:
细胞抑制率IR(%):=[1-(实验组A值)/(对照组A值)]×100%(公式3)
实验重复3次以上,结果基本一致,再以其中1次实验值为准,绘制曲线。

2 结果
2.1 大鲵皮肤黏液糖蛋白中总糖含量 经计算碱提取糖蛋白的得率为3.85%,通过蒽酮比色法测定碱提取糖蛋白中总糖含量为4.23%。
2.2 大鲵皮肤黏液糖蛋白纯化结果
2.2.1 大鲵黏液糖蛋白的DEAE-52离子交换层析:通过阴离子交换树脂DEAE-52对黏液糖蛋白进行分离纯化,见图1、2。由图1可知,当以0.2 mol/L的NaCl溶液洗脱时,在280 nm处实时监测可得到单一的对称峰,经硫酸蒽酮法实时跟踪检测(620 nm处吸收值)每管的收集液样品的A值表明(见图2),在洗脱峰处,也有明显的多糖吸收峰。故可以初步判定该部分是含糖蛋白的溶液,收集合并这一组份,经浓缩,透析,冷冻干燥,得到大鲵黏液糖蛋白初步纯化组分。

图1 DEAE-52洗脱样品蛋白质吸收峰Fig.1 DEAE-52 samples of elution protein absorption peak
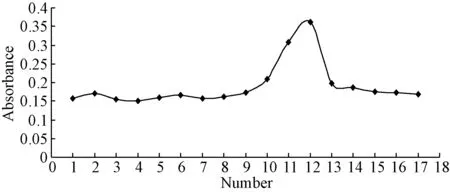
图2 DEAE-52洗脱样品多糖吸收峰Fig.2 DEAE-52 samples of elution polysaccharide absorption peak
2.2.2 大鲵黏液糖蛋白的Sephadex G-100葡聚糖凝胶层析:经DEAE-52离子交换层析得到的糖蛋白样品,经Sephadex G-100凝胶色谱再次对黏液糖蛋白初步纯化组分进一步分离纯化,其结果见图3、4。由图3可知,经去离子水洗脱,在280 nm处实时监测得到一个单一组分吸收峰,并经蒽酮比色法检测表明(见图4),在样品出峰处又出现了多糖和蛋白的重叠峰,故可以证明纯化的峰值样品应是单一糖蛋白组分,将该组分收集,减压浓缩,冷冻干燥,即得到精制大鲵黏液糖蛋白纯品。

图3 Sephadex G-100洗脱样品蛋白质吸收峰Fig.3 Sephadex G-100 protein elution sample absorption peak

图4 Sephadex G-100洗脱样品多糖吸收峰Fig.4 Sephadex G-100 samples of elution polysaccharide absorption peak
2.3 SDS-PAGE电泳测定糖蛋白分子量 采用SDS-PAGE聚丙烯酰胺凝胶电泳的方法来验证糖蛋白的分子量,见图5。由图5可知,通过碱提取、DEAE-52离子交换层析、Sephadex G-100层析纯化的糖蛋白样品纯度不断提高,当经Sephadex G-100层析纯化后,SDS蛋白电泳检测到在分子量为30000 Da处有一条清晰的蛋白条带。因此可证明所得精制糖蛋白的分子量约为30 kDa。

图5 大鲵黏液糖蛋白的SDS-PAGE电泳图1.碱提糖蛋白;2.DEAE-52层析糖蛋白;3.Sephadex G-100层析糖蛋白;M.标准分子量蛋白Fig.5 SDS-PAGE electrophoretogram of Salamander mucus glycoprotein 1.Alkali mention glycoprotein;2.DEAE-52 chromatography glycoprotein;3.Sephadex G-100 chromatography glycoprotein;M.Marker
2.4 黏液糖蛋白对A549肺癌细胞的抑制作用 大鲵黏液糖蛋白对A549肺癌细胞增殖抑制作用情况,见表1。由表1实验结果进行对数回归分析可知,随糖蛋白纯品浓度从1、10、20、40 μg/mL的增加,糖蛋白对A549细胞的抑制率逐渐增大;当糖蛋白浓度为40 μg/mL,作用24 h时,对A549细胞的抑制率可达85.66%,作用48 h时,可达92.32%。大鲵黏液糖蛋白对A549细胞的抑制作用在一定浓度范围内有时间依赖性,与阳性对照紫杉醇相比较,对A549细胞增殖抑制作用差异有统计学意义(P<0.05)。

表1 糖蛋白样品对A549细胞增殖抑制的量效关系±s,n=3)Tab.1 Concentration-response relationship of glycoprotein samples on A549 cell proliferation ±s,n=3)
*P<0.05,与阳性对照组相比,compared with positive control group
3 讨论
大鲵皮肤黏液含有的丰富的药理活性成分,是天然药用资源开发的宝库。本实验通过柱色谱法对大鲵皮肤黏液糖蛋白样品进行分离纯化,最终得到一种分子量约为30 kDa单一组分的糖蛋白。
将所得黏液糖蛋白样品利用MTT比色法对A549肺癌细胞的活性检测表明,黏液糖蛋白具有良好的抗肺癌活性的作用。随样品浓度从1、10、20、40 μg/mL的增加,黏液糖蛋白对A549细胞的增殖抑制作用明显增大,其增殖抑制作用与阳性对照组比较差异显著(P<0.05),且大鲵黏液糖蛋白对A549细胞的抑制作用,在一定浓度范围内有时间依赖性。大鲵黏液糖蛋白的抗肺癌细胞作用,可为抗肺癌药物的开发提供理论依据。
[1] 侯进慧,朱必才,童玉玮,等.中国大鲵研究进展[J].四川动物,2004,23(3):262-266.
[2] 刘炯宇,江建平,谢锋,等.两栖动物皮肤结构及皮肤抗菌肽[J].动物学杂志,2004,39(1):112-116.
[3] 黄智慧,马爱军,汪岷.鱼类体表黏液分泌功能与作用研究进展[J].海洋科学,2009,33(1):90-94.
[4] 曲敏.大鲵黏液低聚糖肽的制备、性质和生物活性及应用研究[D].沈阳:沈阳农业大学,2012.
[5] 李伟,于新莹,佟长青,等.大鲵黏液酶解产物的制备及其抗疲劳作用研究[J].食品工业科技,2011,32(6):146-148.
[6] 曲敏,田丽冉,佟长青,等.大鲵低聚糖肽对四氯化碳致小鼠急性肝损伤的保护作用[J].食品工业科技,2013,34(14):350-352.
[7] 王利锋,李学英,王大忠.大鲵皮肤分泌液中抗菌肽的鉴定及生物活性研究[J].中国生化药物杂志,2011,4(32):269-272.
[8] 郭文韬.大鲵遗传多样性及皮肤附属物特性研究[D].武汉:华中科技大学,2013.
[9] Zdebska E,Koscielak JA.Single-sample method for determination of carbohydrate and protein contents glycoprotein bands separated by sodium dodecyl sulfate-polyacrylamide gel electrophoresis[J].Anal Biochem,1999,275(2):171-179.
[10] Takakura D,Hashii N,Kawasaki N.An improved in-gel digestion method for efficient identification of protein and glycosylation analysis of glycoproteins using guanidine hydrochloride[J].Proteomics,2014,14(3):196-201.
[11] 童朝阳,林福生,张守兰,等.褶纹冠蚌Cristaria plicata 提取物抗肿瘤作用的实验研究[J].中国海洋药物,2003,22(3):20-24.
[12] Xu Y,Bailey UM,Punyadeera C,et al.Identification of salivary N-glycoproteins and measurement of glycosylation site occupancy by boronate glycoprotein enrichment and liquid chromatography/electrospray ionization tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2014,28(5):471-482.
[13] 李鹏翀,赵博新,梁倩莹,等.MTT法检测非小细胞肺癌对紫杉醇的敏感性[J].药学研究,2014,33(1):1-4.
[14] Hayon T,Dvilansky A,Shpilberg O,et al.Appraisal of the MTT-based Assay as a Useful Tool for Predicting Drug Chemosensitivity in Leukemia[J].Leukemia&Lymphoma,2003,44(11):1957-1962.
[15] Scott PE,Purkall DB,Ruddy S.Effects of thrombospondin purified by heparin affiniy orion-eiebange chromatography on the alternative completeb pathway[J].J Immunol Methods,1997,202(2):213-216.
[16] 张杰,李春艳,李劲平,等.蒽酮硫酸法与苯酚硫酸法测定竹节参多糖含量的比较研究[J].中南药学,2012,10(6): 421-424.
[17] 邓长江,李长清,朱希强,等.蒽酮-硫酸法测定芽短梗霉发酵液残糖和总糖含量的研究[J].食品与药品,2006,8(11): 54-56.
[18] 魏元青,许泓瑜,万彩霞,等.松口蘑发酵菌丝体中抗肿瘤糖蛋白的分离纯化及组成分析[J].中国医药工业杂志,2004,35(11):650-652.
[19] 李亚娜,林永成,余志刚.甘薯糖蛋白的分离、纯化和结构分析[J].华南理工大学学报(自然科学版),2004,32(9):59-62.
[20] 凌斌勋,柞蚕抗菌肽抗人鼻咽癌CNE2的实验研究[D].广州:第一军医大学,2002.
[21] Van MJ,Kaspers GJ,Cloos J.Cell sensitivity assays:the MTT assay[J].Methods Mol Biol,2011,731:237-245.
[22] 高晓天,周小林,梁克,等.抗前胃泌素释放肽单克隆抗体在小细胞肺癌诊断应用[J].中国热带医学,2009,9(1):51-52.
(编校:王冬梅)
Extraction and purification of giant salamander skin mucous glycoprotein and study its anti-cancer activity of lung cancer
XU Wei-liang1, CHEN De-jing2Δ, LIU Yu3, WEI Hong3, LIU Qing1
(1.The School of Biological Science & Engineering, Shanxi University of Technology, Hanzhong 723001, China; 2.Shaanxi Provincial Bio-resource Key Laboratory, Shanxi University of Technology, Hanzhong 723001, China; 3.Department of Laboratory Animals of Basic Medical, The Third Military Medical University, Chongqing 400038, China)
ObjectiveTo study the appearance of skin mucous glycoprotein in vitro on the activity of human lung cancer cells A549.MethodsUsed alkali extraction and DEAE-52 ion exchange chromatography and Sephadex G-100 gel chromatography purification salamander mucous glycoprotein; Salamander mucous glycoprotein inhibition of human lung cancer cells A549 was detected by MTT colorimetric method in vitro.ResultsIt showed that the total sugar content in the appearance of mucus was 4.23%, the relatively pure glycoprotein component, by SDS protein electrophoresis tests, it contained a single glycoprotein component, its molecular weight was about 30 kDa.With glycoprotein pure concentration increased from 1,10,20,40 μg/mL, the glycoprotein inhibition rate of A549 cells increased; when the glycoprotein concentration was 40 μg/mL, for 24 h action, the inhibition rate of A549 cells was up to 85.66 %, while the role of 48 h, the inhibition rate of A549 cells was up to 92.32%.Inhibition effect of mucus glycoprotein on A549 cell compared with positive control drug, had significant difference.ConclusionSalamander mucus glycoproteins of human lung cancer cells has obvious inhibitory effect, can provide theoretical basis for the development of lung cancer drug resistance.
giant salamander; mucus; glycoprotein; purification; MTT method; anti-lung cancer
陕西省中小企业科技创新项目(2014CXZJ36)
徐伟良,男,硕士,研究方向:应用生物化学,E-mail: xwlgra@126.com;陈德经,通讯作者,男,硕士,副教授,硕士生导师,研究方向:食品生物技术,E-mail:cdjslg@126.com。
TQ461
A
1005-1678(2015)08-0044-04

