PiC在阿霉素所致SD大鼠心肌损伤中的表达情况及姜黄素的保护作用
卢均坤,王燕琴,初而复,李欣,张明亮,Sudeep,齐向前
(1.天津医科大学,天津 300070;2.佳木斯大学附属第一医院 心内二科,黑龙江 佳木斯 154003;3.佳木斯大学校医院 超声科,黑龙江 佳木斯 154003;4.天津泰达国际心血管病医院 内二科,天津 300457)
PiC在阿霉素所致SD大鼠心肌损伤中的表达情况及姜黄素的保护作用
卢均坤1,2,王燕琴3,初而复2,李欣2,张明亮2,Sudeep2,齐向前4Δ
(1.天津医科大学,天津 300070;2.佳木斯大学附属第一医院 心内二科,黑龙江 佳木斯 154003;3.佳木斯大学校医院 超声科,黑龙江 佳木斯 154003;4.天津泰达国际心血管病医院 内二科,天津 300457)
目的 探讨线粒体磷酸载体(PiC)在阿霉素所致SD大鼠心肌损伤中的表达情况,及姜黄素对阿霉素所致SD大鼠心肌损伤的保护作用。方法 60只成年SD大鼠随机分为3组:对照组、阿霉素组、姜黄素+阿霉素组。正常对照组:按2.5 mL/kg尾静脉注射0.9%氯化钠注射液,1周1次,连续注射6周;阿霉素组:按1.25 mg/kg鼠尾静注射0.5 mg/mL阿霉素(0.9%氯化钠注射液稀释,约0.5 mL),1周1次,共注射6周;阿霉素+姜黄素组:阿霉素使用同上,大鼠从每次注射完阿霉素,同时应用12 mg/mL姜黄素注射液,以30 mg/kg药液(约0.5 mL)经尾静脉缓慢注射,共注射6周。应用谷胱甘肽过氧化物酶检测试剂盒(Gpx)、超氧化物歧化酶(SOD)检测试剂盒、丙二醛(MDA)检测试剂盒检测心肌细胞内氧化应激水平,应用流式细胞仪检测SD大鼠心肌细胞凋亡水平;应用Western blot技术和Real-time PCR技术检测PiC的表达情况。结果 阿霉素组大鼠心肌细胞凋亡显著增加(P<0.05),而阿霉素+姜黄素组较阿霉素组大鼠心肌细胞凋亡显著降低(P<0.05);阿霉素+姜黄素组大鼠心肌细胞内Gpx活性、SOD活力均明显高于阿霉素组(P<0.05),而低于对照组(P<0.05);阿霉素+姜黄素组大鼠Slc25a3基因表达量、MDA含量及PiC蛋白表达量均明显高于对照组(P<0.05),而低于阿霉素组(P<0.05)。结论 阿霉素可以使心肌线粒体中PiC的表达及氧化应激水平显著升高,心肌细胞凋亡增加;而姜黄素可以有效拮抗阿霉素所引起的这种损伤作用。
阿霉素;姜黄素;线粒体磷酸载体;氧化应激;Slc25a3基因
恶性肿瘤患者化疗后可引起一系列不良反应,包括心脏毒性、肾脏毒性、肝脏毒性、神经系统毒性、免疫功能低下等各系统损害,其中以心脏毒性对人体的危害最大[1-3]。阿霉素(doxorubicin,DOX)也称为14-羟基柔红霉素,是目前临床应用中蒽环类药物的代表药物之一。线粒体是细胞物质与能量代谢的重要场所,它能通过电子传递链的氧化磷酸化反应为有机体提供90%的ATP能源,维持机体的各项生理机能[4]。线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)大量开放是导致线粒体功能障碍的关键,与多种心脏疾病的发生发展关系密切[5]。研究发现[6],蒽环类药物可以导致MPTP开放,引起一系列心肌细胞凋亡、坏死。PiC是位于线粒体内膜上的一种重要的功能蛋白,其功能主要是使重要的代谢底物:无机磷酸(Pi)通过线粒体内膜,从细胞质转移到线粒体基质。PiC可能是MPTP和细胞死亡潜在的始动监视者[7]。研究表明[8],PiC可以在MPTP开放中发挥重要作用。PiC由多种编码基因共同调控,其中Slc25a3基因是编码PiC基因的重要组成部分,研究发现PiC的表达量与Slc25a3的表达情况密切相关[9]。但目前关于阿霉素对心肌细胞内PiC表达的影响及其分子机制,国内外尚未见报道。
姜黄素(curcumin,CUR)有广泛的药理活性,其发展前景日益引起人们的重视。目前的研究主要集中在抗炎、抗氧化、抗肿瘤、抗纤维化、抗艾滋病等[10-13],但对姜黄素保护心肌细胞具体机制的研究相对较少,姜黄素保护心肌细胞的途径和机制尚不明确。本实验通过构建阿霉素所致心肌损伤的体内模型,并使用姜黄素对已发生心肌损伤的体内模型进行干预,进一步研究PiC在姜黄素干预阿霉素所致心肌损伤中的表达情况及深入探讨姜黄素对阿霉素所致心肌损伤的保护作用的具体机制。
1 材料与方法
1.1 实验动物及饲料 成年健康的SD大鼠,体质量在180~220 g之间,雄雌不限,共60只,购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2012-0001;正常饲养,购自哈尔滨医科大学实验动物中心。
1.2 实验仪器及试剂 实验仪器:高速低温离心机(Sigma,美国),FA2004电子分析天平(上海衡平电子仪器公司,中国),全自动酶标仪(BioTek),制冰机(ZIEGRA-EISMASCHINEN),匀速摇床(北京六一仪器厂),FACSCalibur 流式细胞仪(BD),PCR反应扩增仪(ABI);SW-CJ-1D洁净工作台(江苏苏洁净化设备厂);H6-1微型电泳槽(上海精益有机玻璃制品仪器厂);DYY-8型稳压稳流电泳仪(上海琪特分析仪器有限公司);YXJ-2离心机(湘仪离心机仪器有限公司);凝胶成像系统(上海复日科技有限公司);TU-1901紫外分光光度计(北京普析通用仪器有限公司);移液器(范围100~1000μL,20~200μL,0.5~10μL)(BBI);StepOne型荧光定量PCR仪(ABI)。
实验试剂:谷胱甘肽过氧化物酶检测试剂盒、超氧化物歧化酶检测试剂盒、丙二醛检测试剂盒、细胞蛋白裂解液(RIPA)、BCA蛋白定量试剂盒、Western blot化学发光试剂盒均为南京碧云天产品,Annexin V流式细胞试剂盒(BD),Trizol(Invitrogen),DEPC(SIGMA),ABI SybrGreen PCR Master Mix(ABI),引物(上海生工公司),抗体(Santa)。
1.3 动物模型建立 所有实验动物均在清洁级动物室中进行饲养。60只SD大鼠随机分为3组:对照组(con)、阿霉素组(dox)、姜黄素+阿霉素组(cur)。正常对照组:0.9%氯化钠注射液2.5 mL/kg,以尾静脉注射的方式,每周1次注射到大鼠体内,连续注射6周;阿霉素组:将阿霉素用0.9%氯化钠注射液稀释为0.5 mg/mL,以1.25 mg/kg的剂量,以鼠尾静脉缓慢静推(约0.5 mL)入大鼠体内,每周1次,共注射6周;阿霉素+姜黄素组:阿霉素使用同上,大鼠从每次注射完阿霉素,同时应用12 mg/mL姜黄素注射液,以30 mg/kg药液(约0.5 mL)经尾静脉缓慢注射,共注射6周。11周后,全部大鼠采用脊髓离断的方法处死,取心脏组织进行下一步实验。本实验严格遵循《实验动物保护条例》。
1.4 心肌组织内氧化应激水平检测 取0.5 g心肌冰组织在浴下用匀浆器匀浆,用生理盐水制成10%的组织匀浆,4 ℃ 3000 r/min离心10 min,取上清液检测。严格按照试剂盒说明,检测心肌组织内Gpx活性、SOD活力及MDA含量。
1.5 应用Annexin V法检测SD大鼠心肌细胞的凋亡情况 使用10%水合氯醛300 μg/kg麻醉大鼠,于剑突下作切口取出心脏,立即放入4 ℃灌流液中,于液面下行主动脉插管,采用Langendorff离体心脏灌流装置,并在灌流液中加入胶原酶(浓度为0.2 g/L),用剪刀取心室肌组织,浸入高钾KB液中,轻轻吹打,过300 μm的不锈钢筛网,室温稳定1 h后,室温放置6~7 h备用[14-16]。
1.6 应用Western blot检测PiC蛋白的表达 取心肌组织0.5 g后剪切成细小的碎片,加入含有1%PMSF的RIPA裂解液1 mL,用匀浆器匀浆,至充分裂解后,4 ℃ 13 500 r/min离心15 min,取上清液。使用BCA试剂盒测量蛋白样本浓度,分别为:对照组7.0145 μg/μL,阿霉素组13.57 μg/μL,姜黄素+阿霉素组12.83 μg/μL;蛋白上样量分别为:对照组3.6 μL,阿霉素组1.9 μL,姜黄素+阿霉素组2.0 μL。以小鼠Slc25a3单克隆抗体作为一抗(1:1000),4 ℃过夜,以HRP标记的羊抗鼠酶标抗体作为二抗(1:10000)进行Western blot检测。
1.7 应用Real-time PCR检测PiC基因的表达 心脏组织RNA提取采用Trizol试剂提取方法。采用AMV First Strand cDNA Synthesis Kit试剂盒于PCR反应扩增仪(ABI)上将提取的总RNA逆转录为cDNA。cDNA产物保存在-20 ℃。Real-time PCR采用ABI SybrGreen PCR试剂盒说明书在20 μL反应体系中进行PCR扩增。实验体系:SYBR Green Taq Ready Mix 10 μL,正向和反向引物1.0 μL,水6.0 μL和cDNA2.0 μL(约100 ng),上述实验重复3次。每个样本的溶解曲线只有1个溶解峰即表明产物是唯一的,没有非特异扩增。采用Livak法即2-(ΔΔCt)法对PCR的数据进行分析。本实验引物设计均采用Primer 6.0软件,Slc25a3基因上游引物为5′-GTGGTTTGG-CTAAAGGATGG-3′,下游引物为5′-GGGCAATGTCAGCGAAGAA-3′,β-actin上游引物为5′-CGTAAAGACCTCTATGCCAACA-3′,下游引物为5′-AGCCACCAATCCACA-CAGAG-3′,本实验中的引物序列均由上海生工生物工程有限公司合成。

2 结果
2.1 各组大鼠心肌组织内氧化应激水平检测结果 结果显示,阿霉素组SD大鼠体内谷胱甘肽过氧化物酶活性及SOD活力均明显低于对照组及阿霉素+姜黄素组(P<0.05),MDA含量明显高于对照组及阿霉素+姜黄素组(P<0.05);同时阿霉素+姜黄素组SD大鼠体内谷胱甘肽过氧化物酶活性及SOD活力均高于阿霉素组且低于对照组(P<0.05),MDA含量低于阿霉素组且高于对照组(P<0.05),见表1。表明姜黄素可以减低阿霉素所导致SD大鼠机体内的氧化应激水平,从而起到保护作用。

表1 各组SD大鼠心肌细胞内GSH活性、SOD活力及MDA含量Tab.1 GSH activity, SOD activity and MDA content in the cardiac muscle cells of SD ±s)
*P<0.05,与阿霉素组相比较,compared with doxorubicin group
2.2 Annexin V法检测SD大鼠心肌细胞的凋亡情况 结果显示,阿霉素组SD大鼠心肌细胞的凋亡率(23.55±1.47)%明显高于对照组(8.43±1.97)%及阿霉素+姜黄素组(16.01±2.85)%,同时阿霉素+姜黄素组SD大鼠心肌细胞的凋亡率明显高于对照组,但低于阿霉素组(P<0.05),见图1。这表明阿霉素可以引起SD大鼠心肌细胞发生凋亡,而姜黄素可以通过对抗阿霉素的作用,起到保护心肌细胞的作用。

图1 动物模型心肌细胞凋亡情况Fig.1 Apoptosis of myocardial cells in animal models
2.3 Western blot技术检测线粒体磷酸载体(PiC)蛋白的表达情况 结果显示,阿霉素组的线粒体磷酸载体蛋白表达情况明显高于对照组及阿霉素+姜黄素组,阿霉素+姜黄素组的PiC蛋白的表达情况低于阿霉素组,而高于对照组(P<0.05),见图2。这表明阿霉素可以明显促进SD大鼠心肌细胞内PiC蛋白的表达,而姜黄素可以有效对抗阿霉素在心肌细胞内对PiC蛋白表达的促进作用。
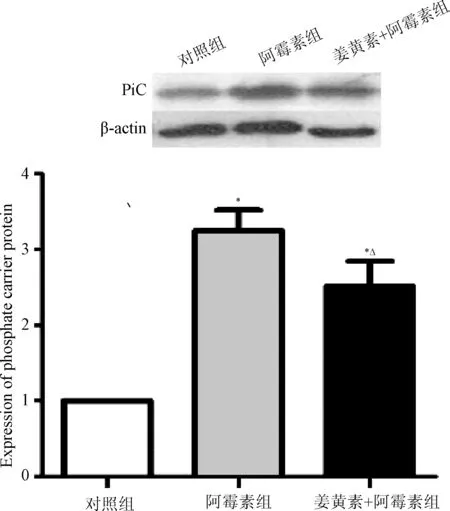
图2 PiC蛋白在阿霉素所致SD大鼠心肌细胞损伤中及姜黄素干预后的表达情况(n=20)*P<0.05,与对照组比较;△P<0.05,与阿霉素组比较Fig.2 Expression of PiC protein in SD rats with myocardial cell injury induced by doxorubicin and the effect of curcumin(n=20)*P<0.05, compared with control group;△P<0.05, compared with doxorubicin group
2.4 Real-time PCR技术检测Slc25a3基因的表达情况 结果显示,阿霉素组的Slc25a3基因的mRNA表达情况明显高于对照组及姜黄素干预组,而姜黄素干预组的Slc25a3基因的mRNA表达高于对照组、低于阿霉素组(P<0.05),见图3。这表明阿霉素可以促进SD大鼠心肌细胞内Slc25a3基因的表达,而姜黄素可以明显下调阿霉素对心肌细胞内Slc25a3基因的表达作用。
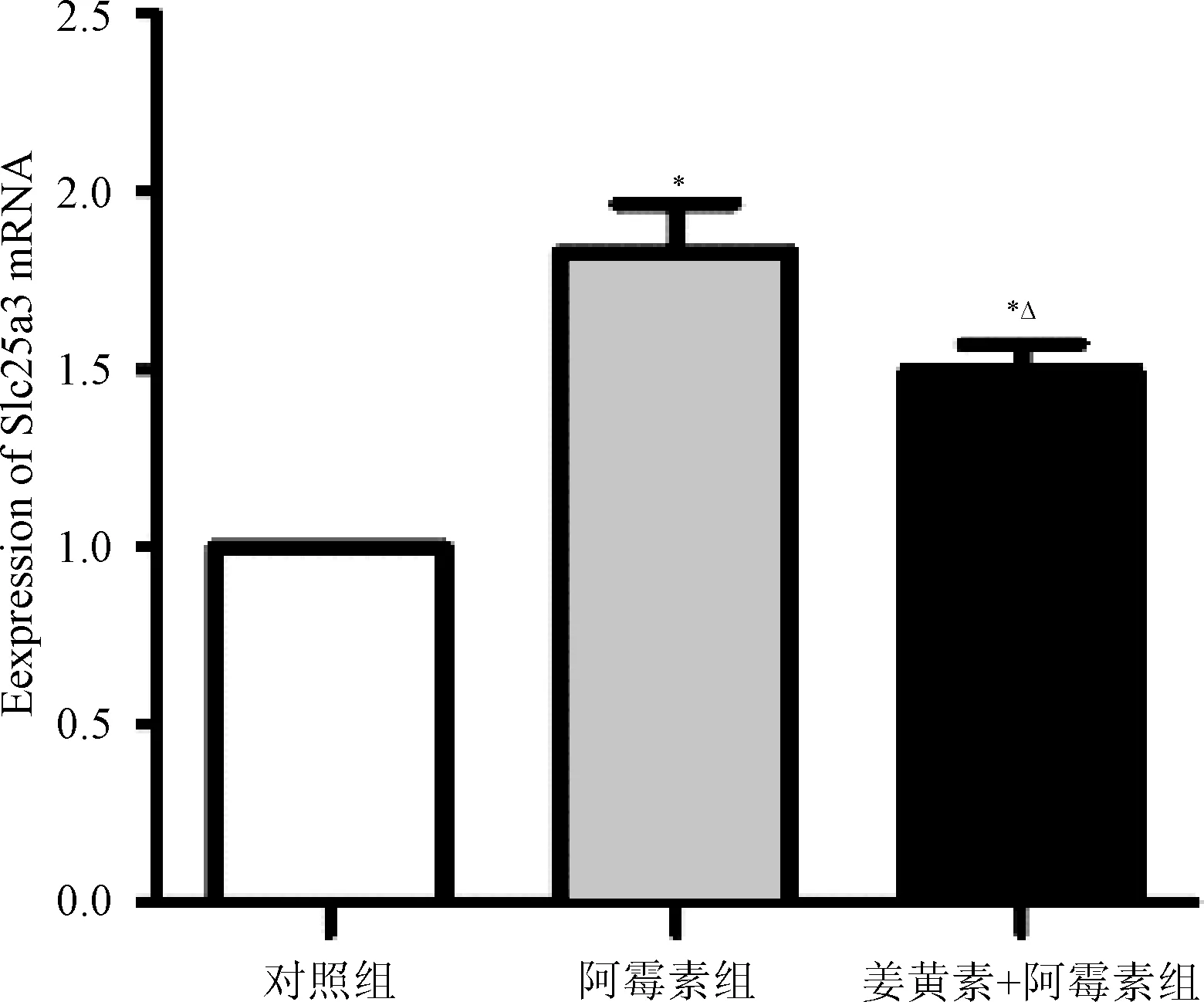
图3 各组Slc25a3基因表达比较(n=20)*P<0.05,与对照组比较;△P<0.05,与阿霉素组比较Fig.3 Comparison of Slc25a3 mRNA expression in each group(n=20)*P<0.05, compared with control group;△P<0.05, compared with doxorubicin group
3 讨论
阿霉素是一种抗肿瘤抗生素,可抑制细胞RNA和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,对各种生长周期的肿瘤细胞都有杀灭作用[17-18]。研究发现[19],长期使用阿霉素的患者可出现可引起迟发性严重心力衰竭,有时可在停药半年后发生。线粒体是细胞物质与能量代谢的重要场所,由于线粒体是外来化合物诱导细胞损伤的敏感细胞器,因此线粒体在细胞凋亡机制中越来越受到人们的重视。研究发现,阿霉素心肌损伤与线粒体在亚细胞水平广泛性、进展性的损伤有关,线粒体作为心肌细胞的死亡与存活的门户,在心肌缺血性疾病中尤为重要[20]。MPTP大量开放是导致线粒体功能障碍的关键,而PiC是构成MPTP的关键性线粒体内膜成分。研究表明[21],SLc25的2个外显子3A与3B,3A主要存在于肌肉、心脏、甲状腺组织,而3B存在于肌体所有组织中。Slc25a3基因的纯合子突变患者显示运动不耐受,近端肌肉无力和心肌病等[22]。多个研究证实线粒体ATP合成下降与Slc25a3减少有关,凸显出线粒体磷酸盐转运在能量产生中的重要作用,值得注意的是,患者线粒体PiC缺陷时在肌肉组织线粒体的ATP合成减少,与肥厚型心肌病和心输出量减少相关[23]。在对1型糖尿病患者的研究中发现肌间纤维线粒体Slc25a3合成显著减少,ATP合成也显著减少,随着线粒体蛋白组学异常,心脏功能失调[24]。在本研究中发现阿霉素组大鼠Slc25a3上调,可能引起线粒体大量增生,本课题组早期的研究证实,阿霉素引起大鼠心肌损伤后的早期,线粒体大量增生,排列紊乱、肿胀、畸形,峭减少[25],线粒体增生可能为代偿性,为保证心肌细胞提供ATP。姜黄素干预组大鼠Slc25a3下调,可能与线粒体功能部分恢复有关。
姜黄素(curcuma,CUR)为姜黄属植物,具有保护缺血心肌,预防心肌梗死的作用。研究证实,姜黄素对大鼠脑缺血再灌注损伤具有保护作用,其作用与增加脑血流量,抗脂质过氧化和防止钙超载有关[26]。同时,姜黄素对大鼠心肌的缺血性损伤具有保护作用,且这种保护作用呈现一定的剂量依赖关系,可能有随着剂量的增大作用增强的趋势。此外,姜黄素还可以拮抗多种理化因素对DNA的损伤增加体内SOD水平,清除超氧阴离子。研究表明活性氧(ROS)的产生与线粒体密切相关,产生氧化应激,参与细胞损伤与凋亡[27]。
本实验通过使用流式细胞仪检测心肌细胞凋亡情况,及GSH、SOD、MDA 3种试剂盒检测心肌细胞内的氧化应激水平,鉴定动物模型建立情况。结果显示,阿霉素损伤组心肌细胞凋亡率明显高于对照组及姜黄素干预组,GSH活性及SOD活力均明显低于对照组及姜黄素干预组,而MDA含量明显高于对照组及姜黄素干预组(均P<0.05)。本实验结果表明在体内模型中,阿霉素对心肌细胞所造成的损伤存在,并且这种损伤会随作用时间的推移不断增加。通过对动物模型心肌细胞内氧化应激水平的检测,本研究发现GSH活性、SOD活力及MDA含量均随阿霉素作用时间延长而发生相应改变,但当加入一定浓度的姜黄素后,会出现氧化应激水平下降的表现,这表明姜黄素对阿霉素所引起的心肌细胞损伤具有一定的保护作用。
本实验还通过Western blot及Real-time PCR对阿霉素所致SD大鼠心肌损伤模型及姜黄素干预后的PiC表达情况进行检测,结果显示,阿霉素损伤后的SD大鼠心肌细胞内PiC表达明显上调(P<0.05),但使用姜黄素进行干预后,PiC表达情况明显下降,但仍高于对照组(P<0.05)。这表明姜黄素在对抗阿霉素所引起的心肌损伤中,可以通过调节蛋白和基因的表达对心肌细胞起到一定的保护作用,同时也说明虽然姜黄素具有明确的保护作用,但其并不能将受损的心肌细胞完全恢复至正常,这可能也会受到姜黄素浓度及阿霉素作用时间的制约。
本实验通过构建阿霉素所致心肌损伤的体内模型,并使用姜黄素对已发生心肌损伤的动物模型进行干预。结果表明姜黄素对阿霉素所引起的SD大鼠心肌细胞损伤具有一定的保护作用,这种保护作用是否是通过调节动物模型体内的氧化应激水平和PiC在蛋白和基因水平的表达情况来发挥作用还有待进一步研究。本实验揭示了阿霉素在机体内对心肌细胞造成损伤的机制及姜黄素在体内对抗阿霉素所引起心肌细胞损伤的主要途径,为进一步研究PiC在姜黄素干预阿霉素所致心肌损伤中的表达情况及深入探讨姜黄素对阿霉素所致心肌损伤的保护作用的具体机制提供了新的科研思路,为今后的靶基因治疗提供理论依据。
[1] Guenancia C,Li N,Hachet O,et al.Paradoxically,iron overload does not potentiate doxorubicin-induced cardiotoxicity in vitro in cardiomyocytes and in vivo in mice[J].Toxicol Appl Pharmacol,2015,284(2):152-162.
[2] Heeba GH,Mahmoud ME.Dual effects of quercetin in doxorubicin-induced nephrotoxicity in rats and its modulation of the cytotoxic activity of doxorubicin on human carcinoma cells[J].Environ Toxicol,2014.
[3] Nagai K,Oda A,Konishi H.Theanine prevents doxorubicin-induced acute hepatotoxicity by reducing intrinsic apoptotic response[J].Food Chem Toxicol,2015,11(78C):147-152.
[4] Wided K,Hassiba R,Mesbah L.Polyphenolic fraction of Algerian propolis reverses doxorubicin induced oxidative stress in liver cells and mitochondria[J].Pak J Pharm Sci,2014,27(6):1891-1897.
[5] Ascensão A,Lumini-Oliveira J,Machado NG,et al.Acute exercise protects against calcium-induced cardiac mitochondrial permeability transition pore opening in doxorubicin-treated rats[J].Clin Sci (Lond),2011,120(1): 37-49.
[6] Raschi E, Vasina V, Ursino MG,et al.Anticancer drugs and cardiotoxicity: insights and perspectives in the era of targeted therapy [J].Pharmacology and Therapeutics,2010,125(2):196-218.
[7] Palmieri F.The mitochondrial transporter family (SLC25): physiological and pathological implications [J].Pflugers Arch,2004,447:689-709.
[8] Varanyuwatana P,Halestrap AP.The roles of phosphate and the phosphate carrier in the mitochondrial permeability transition pore[J].Mitochondrion,2012,12(1):120-125.
[9] Bhoj EJ,Li M,Ahrens-Nicklas R,et al. Pathologic Variants of the Mitochondrial Phosphate Carrier SLC25A3: Two New Patients and Expansion of the Cardiomyopathy/Skeletal Myopathy Phenotype With and Without Lactic Acidosis [J].JIMD Rep,2015,9:59-66.
[10] Dong J,Shao W,Yan P,et al.Curcumolide,a unique sesquiterpenoid with anti-inflammatory properties from Curcuma wenyujin [J].Bioorg Med Chem Lett,2015,25(2):198-202.
[11] 石瑶,孟浦,刘亚黎,等.姜黄素对H9c2心肌细胞氧化应激损伤的保护作用及其机制[J].实用儿科临床杂志,2012,27(13):983-986.
[12] Chen W,Lu Y,Gao M,et al.Anti-angiogenesis effect of essential oil from Curcuma zedoaria in vitro and in vivo [J].J Ethnopharmacol,2011,133(1):220-226.
[13] Singh V,Rana M,Jain M,et al.Curcuma oil attenuates accelerated atherosclerosis and macrophage foam-cell formation by modulating genes involved in plaque stability,lipid homeostasis and inflammation[J].Br J Nutr, 2014,13:1-14.
[14] 石晓路,柳絮,郭会彩,等.大鼠心肌细胞分离方法的改进[J].中国药理学通报,2010,26(5):687-690.
[15] 戴小燕,方秋娟.Langendorff 体心脏灌注模型的制备及应用[J].医学综述,2012,1138(13):2036-2039.
[16] 牛拴成,张轩萍,梁宏亮,等. 鼠心肌细胞急性分离方法[J].山西医科大学学报,2002,33(2):173-174.
[17] Desai VG,C Kwekel J,Vijay V,et al.Early biomarkers of doxorubicin-induced heart injury in a mouse model [J].Toxicol Appl Pharmacol,2014,281(2):221-229.
[18] Zimmermann M,Arachchige-Don AS,Donaldson MS,et al.Elevated cyclin G2 expression intersects with DNA damage checkpoint signaling and is required for a potent G2/M checkpoint arrest response to doxorubicin[J].J Biol Chem,2012,287(27):22838-22853.
[19] 张泉丽,陈乃耀.阿霉素对大鼠心肌损伤的实验研究[J].中国医药指南,2012,10(34):66-67.
[20] Halestrap AP.What is the mitochondrial permeability transition pore?[J].J Mol Cell Cardiol,2009,46: 821-831.
[21] Sonia H Shah,Jacqueline A Pallas.Identifying differential exon splicing using linear models and correlation coefficients [J]. BMC Bioinformatics,2009,10(26):1-26.
[22] Mayr JA,Zimmermann FA,Horváth R,et al.Deficiency of the mitochondrial phosphate carrier presenting as myopathy and cardiomyopathy in a family with three affected children[J].Neuromuscul Disord,2011,21(11):803-808.
[23] Mayr JA,Merkel O,Kohlwein SD,et al.Mitochondrial phosphate-carrier deficiency: a novel disorder of oxidative phosphorylation[J].Am J Hum Genet,2007,80(3):478-484.
[24] Baseler WA,Thapa D,Jagannathan R,et al.miR-141 as a regulator of the mitochondrial phosphate carrier (Slc25a3) in the type 1 diabetic heart[J].Am J Physiol Cell Physiol, 2012, 303(12):C1244-1251.
[25] 卢均坤,吕维娟,刘洋,等,姜黄素及谷胱甘肽对阿霉素所致大鼠急性心肌损伤的保护作用[J].中国老年学杂志,2015,35(3):726-728.
[26] Yu CC,Hu H,Wang XD,et al.Effect of curcumin on the injury in hippocampal neurons and the expression of RANTES in hippocamp during cerebral ischemia/ reperfusion in spontaneously hypertensive rats SHR[J]. Zhongguo Yingyong Shenglixue Zazhi,2014,30(4):360-367.
[27] Fleury C,Mignotte B,Vayssière JL.Mitochondrial reactive oxygen species in cell death signaling[J].Biochimie,2002, 84(2-3):131-141.
(编校:吴茜)
Expression of PiC in SD rats with myocardial damage induced by adriamycin and protective effect of curcumin
LU Jun-kun1,2, WANG Yan-qin3, CHU Er-xia2, LI Xin2, ZHANG Ming-liang2, Sudeep2, QI Xiang-qian4Δ
(1. Medical University of Tianjin, Tianjin 300070, China; 2. Department of Cardiology Division II, 1stAffiliated Hospital of Jiamusi University, Jiamusi 154003, China; 3. Department of Ultrasonographt, Hospital of Jiamusi University, Jiamusi 154003, China; 4. Department of Internal Medicine II, TEDA International Cardiovascular Hospital, Tianjin 300457, China)
ObjectiveTo discuss the expression of mitochondrial phosphate carrier (PiC) in myocardial injury caused by doxorubicin, and the protective mechanism of curcumin in myocardial injury caused by doxorubicin.Methods60 adult SD rats were randomly divided into three groups: control group, doxorubicin group, curcumin+doxorubicin group. Control group was injected 0.9% sodium chloride injection (2.5 mL/kg) by rat tail vein injection, one times per week, 6 times in total.Doxorubicin group was injected with 0.5 mg/mL doxorubicin which diluted with 0.9% sodium chloride injection by rat tail vein injection, and the dosage was 1.25 mg/kg(about 0.5 mL). Curcumin+doxorubicin group was injected the same dose doxorubicin as doxorubicin group. After that, 12 mg/mL curcumin injection was added with 30mg/kg by rat tail vein injection. one times per week, 6 times in total. The glutathione peroxidase (Gpx) assay kit, superoxide dismutase (SOD) assay kit and malondialdehyde (MDA) detection kits were used to test the oxidative stress levels in myocardial cells of SD rats. Flow cytometry is used to test the SD rat cardiomyocytes transferred level. Application of Western blot and Real-time PCR technology were used to detect expression of PiC.ResultsThe Gpx activity and SOD vitality in myocardial cells of SD rats in curcumin with doxorubicin group all significantly increased compare with those of doxorubicin group, and all decreased compare with those of control group.But the rate of myocardial apoptosis, content of malondialdehyde and expression of Slc25a3 gene and PiC protein from myocardial cells of SD rats from curcumin with doxorubicin group all significantly increased compare with those of control group, and all decreased compare with those of doxorubicin group.ConclusionDoxorubicin could increase the expression of PiC in myocardial mitochondria, the levels of oxidative stress, and the apoptosis of myocardial cells, and the effect of curcumin could be effective against the injury induced by doxorubicin.
doxorubicin; curcumin; MPTP; oxidative stress; Slc25a3 gene
黑龙江省自然科学基金项目(H201365);佳木斯大学重点项目(Sz2013-004)
卢均坤,男,博士在读,副主任医师,研究方向:冠心病的介入治疗,心血管疾病介入诊治,E-mail:ralilve@163.com;齐向前,通讯作者,男,主任医师、教授、博士生导师,研究方向: E-mail:ljkuuu@163.com。
R541.9, Q505
A
1005-1678(2015)08-0058-05

