鹿茸蛋白2种不同提取方法的比较研究
李超华,王毅,何忠梅,孙娅楠
(1.吉林农业大学 中药材学院,吉林 长春 130118;2.中国中医科学院 医学实验中心 形态学实验室, 北京 100700)
鹿茸蛋白2种不同提取方法的比较研究
李超华1,2,王毅2,何忠梅1Δ†,孙娅楠2Δ†
(1.吉林农业大学 中药材学院,吉林 长春 130118;2.中国中医科学院 医学实验中心 形态学实验室, 北京 100700)
目的 探讨从鹿茸中获得促进神经细胞损伤修复蛋白的最佳提取方法。方法 将新鲜鹿茸分别采用匀浆法和超微粉碎法获取鹿茸蛋白混合物(velvet antler proteins, VAPs);用Bradford法及SDS-PAGE检测并比较蛋白含量及蛋白组分差别;用扫描电镜观察不同提取方法超微结构不同。建立1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium, MPP+)MPP+诱导神经母细胞瘤细胞SH-SY5Y损伤模型,用该模型观察不同提取方法所得蛋白对损伤恢复的影响。结果 超微粉碎法提取的鹿茸蛋白得率更高,得到的蛋白质条带更多,图谱清晰;电镜结果表明超微粉碎法得到的鹿茸蛋白干粉均无细胞结构,且颗粒较细;活性检测中,匀浆法提取的鹿茸蛋白从125 μg/mL 浓度开始可显著提高1mM MPP+作用下 SH-SY5Y 细胞的增殖率,而超微粉碎法提取的鹿茸蛋白的最低有效浓度为62.5 μg/mL,促增殖率可达到25.45%。结论 超微粉碎法既能大量提取鹿茸蛋白又能最大限度保证蛋白促细胞增殖活性,是较为理想的蛋白提取方式。
鹿茸;蛋白提取;SH-SY5Y
鹿茸为鹿科动物梅花鹿或马鹿的密生茸毛的未骨化的幼角,是我国非常珍贵的传统中药材。研究表明,鹿茸中的化学成份较复杂,其主要的药理活性成分有无机元素、氨基酸、多肽、蛋白质、多糖、脂肪酸、磷脂等,其中蛋白类成份高达55.26%[1]。
近年来一系列相关研究[2-5]发现:鹿茸蛋白具有免疫调节、促进创伤愈合、改善性功能、抗肿瘤、抗炎、抗氧化、抗疲劳、抗缺氧、治疗神经损伤等多种生物学效应,有广泛的应用前景和巨大的药用价值。因此如何得到大量蛋白质并保证其蛋白活性是阐释其药理作用的前提。
本研究对2种不同提取方法即匀浆法和超微粉碎法对鹿茸蛋白提取含量及产率的影响进行了比较分析,并探讨了2种方法提取的蛋白促MPP+损伤后SH-SY5Y细胞增殖的活性,为后续药效学研究筛选出鹿茸蛋白提取的最佳方案。
1 材料与方法
1.1 材料
1.1.1 实验试剂:SH-SY5Y细胞株由西苑医院赠送;Bradford蛋白定量试剂盒为天根生化公司产品(Lot No. PA102);考马斯亮蓝(Amresco公司);EDTA、TEMED(Sigma公司);过硫酸铵、冰乙酸、甲醇购自国药集团化学试剂有限公司;噻唑蓝(MTT)和二甲基亚砜(DMSO)购自Amresco公司;胎牛血清FBS(Hyclone公司);青霉素、链霉素(Sigma公司)。
1.1.2 实验仪器:胶体磨(Lot No. KJM-50S,北京锟杰玉诚机械有限公司);旋转蒸发仪(BUCHI瑞士);高速冷冻离心机(GL-20G-H,上海安亭科学仪器厂);垂直电泳仪(Bio-Rad美国);G-Box凝胶成像系统(美国基因公司);扫描电子显微镜(S-3400N日本日立公司);酶标仪(Bio-Rad美国)。
1.2 方法
1.2.1 鹿茸蛋白提取方法
① 匀浆法提取鹿茸蛋白:将切成小块状的鲜鹿茸先用中药粉碎机粉碎成碎末,然后将粉碎的鹿茸在自来水下浸泡冲洗至无血色。取200 g鹿茸肉末浸泡于预冷至4 ℃的2 000 mL纯水溶液中,胶体磨匀浆8~10 h,每2小时旋转胶体磨一次减小粒径,以充分破碎细胞。匀浆结束后加入一定量的冰醋酸保持pH4于4 ℃过夜,5 000 r/min离心10 min分离上层清夜,收集上层清液于1 Kd透析袋用自来水透析脱盐,每4 h更换一次透析液,直至经pH试纸测量外部透析液为中性后,结束透析。透析袋内所得液体即为鹿茸蛋白溶液。将鹿茸蛋白溶液于55 ℃以下进行旋转蒸发浓缩至200 mL以内,5 000 r/min离心10 min除掉沉淀之后,冷冻干燥,称量干燥后粉末重量计算产率,4 ℃保存。
② 超微粉碎法提取鹿茸蛋白:鲜鹿茸先用粉碎机破碎成小块,然后液氮速冻后置入超微粉碎机中粉碎至肉糜状,粒径75 μm左右,200目以上。称取200 g鹿茸糜状物按照1:10(W/V)的比例加入水及适量的冰醋酸保持pH 4置于4 ℃过夜,3 000 r/min离心10 min分离上层清夜,将上层清液于1 Kd透析袋用自来水透析脱盐,每4 h更换一次透析液,直至经pH试纸测量外部透析液为中性后,结束透析。透析袋内所得即为鹿茸蛋白溶液。将鹿茸蛋白溶液55 ℃以下旋转蒸发浓缩至200 mL以内,冷冻干燥,称量干燥后粉末重量计算产率,4 ℃保存。
1.2.2 总蛋白含量的测定:参照Bradford(1976)[6]方法检测蛋白含量。按蛋白含量测定试剂盒要求操作,溶液样品与考马斯亮蓝溶液反应8 min后于595 nm测吸光度。根据绘制的标准曲线,计算鹿茸提取物蛋白含量。
考马斯亮蓝染液在使用前应平衡温度至室温并温和颠倒混匀,将蛋白标准品(BSA)标准溶液(1 mg/mL)标准品按0 μL,1 μL,2 μL,3 μL,4 μL,5 μL,6 μL的体积加到96孔板的标准品孔中,再加入PBS补足到10 μL,向孔中加入190 μL考马斯亮蓝染液,混匀,室温放置8 min。用酶标仪测定595 nm处的OD值。
1.2.3 SDS-PAGE电泳:配置10%分离胶和5%浓缩胶,样品上样量为20 μL。上样前12 000 r/min离心1 min。初始电压80 V,当溴酚蓝进入分离胶时电压设置为120 V,电泳后进行考马斯亮蓝染色45 min(染色液:0.25 g考马斯亮蓝+50 mL甲醇+7 mL冰乙酸+蒸馏水至100 mL)及脱色过夜(脱色液:10 mL甲醇+10 mL冰乙酸+蒸馏水至100 mL)。
1.2.4 扫描电镜检测:将鹿茸蛋白提取物干粉用导电双面胶粘在样品台上,喷金(60 s),用扫描电镜观察(×200,局部放大至×800,电压10 kV)。
1.2.5 SH-SY5Y细胞培养:液氮中取出冻存的细胞株,复苏培养,用DMEM完全培养基(含10% FBS,100 U/mL青霉素、链霉素,pH 7.4)培养,置37 ℃,5%CO2,95%湿度培养箱中培养,细胞为单细胞贴壁生长,当细胞贴壁数大于85%时(对数生长期)可传代培养。
1.2.6 MTT法检测鹿茸促细胞增殖作用:取对数生长期的 SH-SY5Y 细胞,以相同浓度的细胞接种于 96 孔板,待细胞贴壁。细胞贴壁后模型组以 1 000 μM MPP+作用于 SH-SY5Y 细胞。治疗组分别以15.625、31.25、62.5、125、250、500、1 000、2 000 μg/mL的8个不同浓度的2种鹿茸蛋白和 MPP+作用于SH-SY5Y细胞。对照组只加 SH-SY5Y 细胞,不加药物,分别检测不同方法提取的鹿茸蛋白对MPP+损伤48 h的SH-SY5Y细胞的保护作用。细胞给药时间结束前4 h,每孔加 20 μL浓度为5 mg/mL的MTT溶液。继续培养4 h后弃去培养液,每孔加入200 μL DMSO,震荡 2 min 后于酶标仪 490 nm 处检测吸光度值(A)。增值率=(OD给药-OD模型)/(OD正常-OD模型)×100%。
2 结果
2.1 蛋白质的提取方法比较 每250 g鲜鹿茸用2种方法可分别提取蛋白3.11 g(匀浆法)和6.21 g(超微粉碎法),匀浆法提取的鹿茸纯蛋白产率最高为0.08%,超微粉碎法提取的鹿茸纯蛋白产率最高为0.37%。对不同方法提取的总蛋白进行凝胶电泳结果如图1所示,发现匀浆法和超微粉碎法提取的蛋白质在蛋白凝胶电泳中有明显差别。匀浆法提取蛋白条带清晰度比较好;超微粉碎提取法不仅含有较多大分子蛋白也含有较多小分子蛋白,与匀浆法相比在35 kD左右多出一条蛋白条带,且在55 kD与250 kD附近蛋白含量较多。
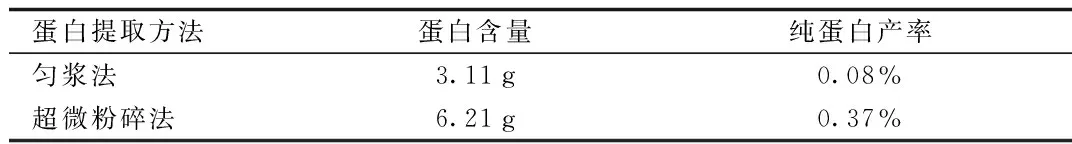
表1 不同提取方法获得梅花鹿鹿茸蛋白含量(g/250 g鲜鹿茸)Tab.1 Protein content of VAPs by two different methods (g/250 g flesh VA)
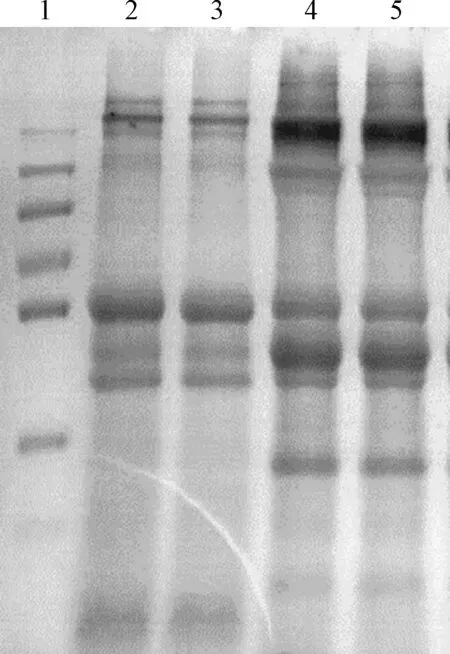
图1 不同提取方法所提取的鹿茸蛋白质SDS-PAGE图谱的比较1:marker;2、3:匀浆法;4、5:超微粉碎法Fig.1 Extracted by different extraction methods of velvet antler proteins sds-page map comparison1:maker; 2: homogenization; 3:micronization
2.2 鹿茸冻干粉的电镜检测 图2A所示,放大200倍后可见超微粉碎法得到的鹿茸干粉的结晶物表面光滑,局部放大800倍后仍未见明显颗粒。图2B所示,匀浆法得到的鹿茸干粉放大200倍后可见部分颗粒,局部放大800倍后颗粒呈圆形光滑,可能为未完全磨碎的细胞。表明超微粉碎法得到的蛋白干粉较细,细胞均已破壁。

图2 鹿茸冻干粉的电镜检测分析Fig.2 Electron microscopy analysis of antler freeze-dried powder
2.3 不同方法提取鹿茸蛋白对MPP+急性损伤SH-SY5Y细胞的保护作用比较 当鹿茸蛋白与 MPP+共孵育 48 h后,采用匀浆法提取的鹿茸蛋白从125 μg/mL浓度开始可显著提高1mM MPP+作用下SH-SY5Y 细胞的增殖率,而超微粉碎法提取的鹿茸蛋白的最低有效浓度为62.5 μg/mL,增殖率可达到25.45%。见表1。
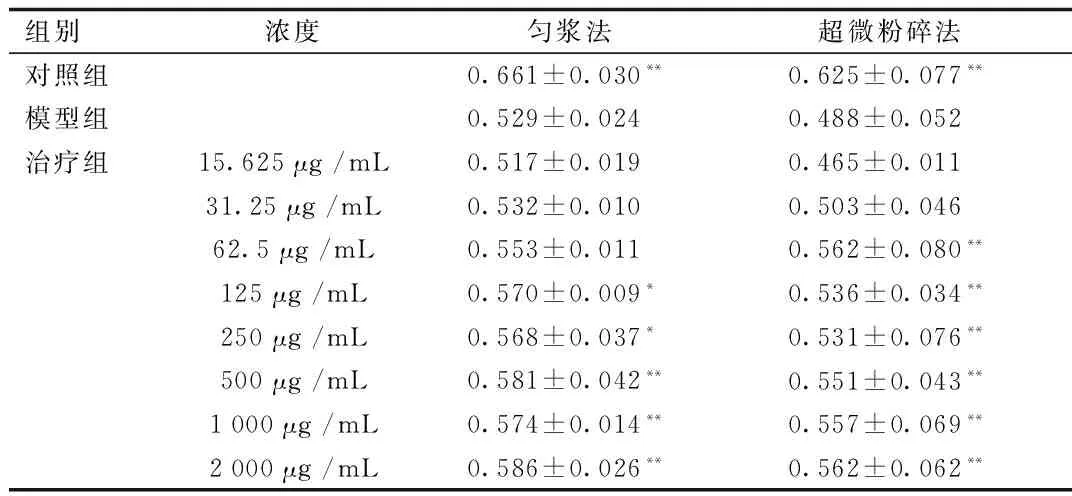
表2 不同提取方法提取鹿茸蛋白对MPP+损伤SH-SY5Y细胞 的保护作用比较 (n=5)Tab.2 The protective effect of different extraction methods of VAPs against MPP+-induced cytotoxicity in SH-SY5Y cell line(n=5)
*P<0.05,**P<0.01,与模型组比较,compared with model group
3 结论
鹿茸始载于汉代的《神农本草经》,具有“生精补髓,养血益阳,强筋健骨,治一切虚损、耳聋、目暗、眩晕虚痢”。鹿茸的再生、迅速增长是依赖于一系列内在激素和生长因子,现代药理学研究表明鹿茸的主要有效活性成分应为鹿茸中大量存在的蛋白类物质[7]。因此如何获得大量的鹿茸蛋白并保证其蛋白活性是确定其药理学作用的基础步骤,也是蛋白质组学研究中重要的一环[8]。
目前常用的蛋白提取方法主要有有机溶剂提取法、裂解液法、酶法、超声波萃取法、双水相萃取法和超临界萃取法等。其中,有机溶剂容易引起蛋白质变性失活,在提取蛋白质时比较少用。裂解液法提取蛋白的步骤相对较多、耗时长,可能引起蛋白的降解,同时裂解液法中所用到的助溶剂中的几种成分有细胞毒性,而除杂过程中用到的丙酮有剧毒,不适用于后续的动物和细胞实验[9-10]。双水相萃取法价格昂贵,限制了其在工业中大规模的应用;体系本身易乳化,使得萃取过程极不稳定;某些高聚合物双水相体系分相时间较长,大大降低了生产效率[11]。超临界萃取法所需设备昂贵,成本高。相比较而言,匀浆法和超微粉碎法提取工艺简单,步骤少,成本低,对活性无影响。
本研究采用匀浆法和超微粉碎法2种提取方法对鹿茸蛋白的提取方法进行比较发现,超微粉碎法提取的纯蛋白产率和含量均高于匀浆法。就蛋白电泳图可见超微粉碎法蛋白条带较多,且蛋白条带较粗。
2种提取方法中匀浆法是在酸性体系中提取鹿茸蛋白,所获得的鹿茸蛋白因为要保持其在溶液中的溶解度,使得体系中含盐量高,电泳条件不稳定,不利于电泳条带的观察。超微粉碎法步骤简单,无需特别前处理,产率较高,所得到的蛋白种类多,蛋白含量大,条带清晰、明确,且不改变蛋白结构,对活性无影响。电镜结果也显示超微粉碎法提取的鹿茸蛋白冻干粉已无细胞结构,且颗粒较细。因此,超微粉碎法能够获得大量鹿茸蛋白更适于后续对鹿茸蛋白药效学的研究。
运用MPP+诱导的急性损伤SH-SY5Y模型对2种方法提取的鹿茸蛋白活性的比较分析结果也表明,超微粉碎法提取的鹿茸蛋白具有较高的活性,其促进MPP+损伤后的SH-SY5Y细胞增殖率明显高于匀浆法,且最小有效浓度为62.5 μg/mL,低于匀浆法的125 μg/mL。
综上所述,在现有的研究阶段,由于口服鹿茸中发挥药效作用的活性成分和种类尚不明确,且蛋白类物质容易变性失活,为保证实验的可重复性和准确性,同时保证工作的高效进行,采用既能大量提取蛋白又能保证蛋白活性的超微粉碎法是较为理想的提取方式。
[1] 王本祥.鹿茸的研究[M].长春:吉林科学技术出版社,1993.96-105.
[2] 桂丽萍,郭萍,郭远强.鹿茸化学成分和药理活性研究进展[J].药物评价研究, 2010, 33(3):237-240.
[3] 刘琳玲,丛波,姜洪梅.鹿茸多肽功能的研究进展[J].特产研究,2009,31(2): 67-70.
[4] 范玉琳,邢增涛.鹿茸蛋白的提取分离及其抗肿瘤活性[J].经济动物学报, 1998,2(1):27-31.
[5] 段冷昕,李夏,王楠娅.鹿茸多肽促进肝细胞增殖及肝部分切除小鼠的肝再生[J].中国药学杂志,2008,43(1):27-30.
[6] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of proteins utilizing the principle of protein binding [J].Anal Biochem, 1976, 72:248-254.
[7] 吉静娴,钱璟,黄凤杰等.鹿茸的活性物质及药理作用的研究进展[J].中国生化药物杂志,2009,30(2),41-143.
[8] 杨颖,徐代勋,曲勃,邢秀梅,杨福合.梅花鹿鹿茸总蛋白的提取方法比较[J].特产研究,2011,33(2):11-12.
[9] 翁瑜,曾群力,姜槐,许正平. 双向凝胶电泳比较三种常用蛋白质提取方法[J].中国生物化学与分子生物学报,2005,21(5):690-693.
[10] 罗海波,陈伟,周静峰,等.茭白总蛋白质双向电泳技术体系的建立[J].食品与生物技术学报, 2013,32(6):581-585.
[11] 单佳莉,黄帮裕,麦霖霞.双水相萃取技术在生物技术上的应用[J].广东化工,2014,41(16):131-132.
(编校:谭玲)
Comparison of two protein extraction methods from velvetantler
LI Chao-hua1,2, WANG Yi2, HE Zhong-mei1Δ†, SUN Ya-nan2Δ†
(1.College of Chinese Medicine Materials, Jilin Agriculture University, Changchun 130118, China; 2.Experimental Research Center, China Academy of Chinese Medicine Science, Beijing 100700, China)
ObjectiveTo compare optimal protein extraction method of velvet antler(VA) and explore the repairmen activity of velvet antler proteins (VAPs) on 1-methyl-4-phenylpyridinium (MPP+) damaged nerve cell. MethodsVAPs was obtained from fresh velvet antler by homogenization and micronization method respectively. The protein content of VAPs was measured by Bradford and the molecular weight was identified by SDS-PAGE. Scanning electron microscope (SEM) was perfomed to observe the ultrastructure of VAPs. Neuroblastoma cell line (SH-SY5Y) damage was induced by MPP+, and activity of each compound was compared by the proliferation of damaged cell detected by MTT method. ResultsThe yield of micronization method of VAPs was higher than homogenization method and with better characters both in SDS-PAGE and SEM. Activity detection indicated that VAPs at the concentration of 125 μg/mL by homogenate method could significantly increase the proliferation rate of damaged SH-SY5Y cells. By contrast, VAPs by micronization method had more effective effect at 62.5μg/mL, and proliferation rate could reach 25.45%. ConclusionMicronization method does not only acquire more protein but also has cell proliferation activity, is a relatively ideal way of protein extraction of velvet antler.
velvet antler; protein extraction; SH-SY5Y
国家自然科学基金(81373884);中央级公益性科研院所基本科研业务费专项基金(ZZ2013005,ZZ0808011)
李超华,女,硕士在读,研究方向:生药学,E-mail:928191089@qq.com;何忠梅,通讯作者,女,博士,副教授,硕士生导师,研究方向:中药有效成分及作用机理研究,E-mail:435398002@qq.com;孙娅楠,共同通讯作者,女,博士,助理研究员,研究方向:生物光子学在中医药研究领域的应用,E-mail:23731787@qq.com。
R9
A
1005-1678(2015)09-0023-03

