慢病毒介导SiRNA沉默SGMS2基因的单克隆细胞系构建中最佳MOI值及筛选抗生素浓度
金小花,秦高
(1.苏州农业职业技术学院 食品科学系化学与生物技术教研室,苏州 215008;2.上海诺百生物科技有限公司,上海 200233)
慢病毒介导SiRNA沉默SGMS2基因的单克隆细胞系构建中最佳MOI值及筛选抗生素浓度
金小花1Δ,秦高2
(1.苏州农业职业技术学院 食品科学系化学与生物技术教研室,苏州 215008;2.上海诺百生物科技有限公司,上海 200233)
目的 探究慢病毒介导RNAi沉默SGMS2基因的单克隆细胞系构建中最佳感染复数(multiplicity of infection,MOI)及BSD基因筛选抗生素(blasticidin)浓度。方法 荧光标记小鼠SGMS2干扰阴性对照慢病毒并按照MOI值0、10、30、60、120(TU number/cell)分别侵染INS-1空白细胞,培养72 h后使用荧光显微镜拍照并计算细胞的荧光比率(%)及死亡率(%),以确定最佳MOI值。小鼠胰岛素瘤INS-1空白细胞中加入0、1、2、3 μg/mL blasticidin,第7天时采用MTT法检测细胞的死亡率,以确定细胞抗生素敏感浓度。使用SGMS2干扰阴性对照慢病毒及SGMS2干扰慢病毒(病毒滴度:1×108TU/mL)按照最佳MOI值侵染细胞,并用blasticidin敏感浓度进行阳性细胞筛选,获得混合系细胞。当细胞的荧光率达90%时,进行单克隆稳转细胞系的构建。结果 最佳MOI值为60,此时细胞的荧光率达100%,但细胞的死亡率<0.5%,细胞保持原有的形态。当blasticidin敏感浓度为2 μg/mL,此时空白细胞失去原有的贴壁性,全部死亡。INS-1-SEMS2细胞第2次检测的Ct值28.21大于第1次检测的Ct值27.58,且siRNA的干扰效率为77.78%,siRNA成功表达,混合稳转细胞系构建成功。成功构建小鼠胰岛素瘤INS-1-SEMS2单克隆细胞系。结论 慢病毒介导RNAi沉默基因SGMS2的单克隆细胞系构建成功。
小鼠胰岛素瘤INS-1细胞;感染复数;BSD基因筛选抗生素;细胞稳转株
在动物细胞学和分子学试验中,将外源目的基因通过病毒介质转入动物细胞中,是一个非常重要的试验步骤[1]。慢病毒直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNA研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)[2]。将目的基因构建到慢病毒载体中,通过慢病毒侵染细胞,将目的基因转入细胞中并表达基因产物。本试验通过测定小鼠胰岛素瘤INS-1空白细胞的最佳MOI值和抗生素敏感浓度,使用针对基因SGMS2的siRNA慢病毒载体侵染细胞,进行构建稳转细胞系,可在较短的时间内获得单克隆稳转细胞系。
1 材料与方法
1.1 材料
1.1.1 细胞及病毒:小鼠胰岛素瘤INS-1细胞(上海诺百生物科技有限公司);SGMS2干扰阴性对照慢病毒及SGMS2干扰慢病毒(病毒滴度:1×108TU/mL)(上海诺百生物科技有限公司)。
1.1.2 试剂与仪器:RPMI-1640细胞培养基、碘化丙锭(PI)试剂(Sigma);0.05%胰酶(Gibco);PBS(Beyotime);BSD基因筛选抗生素(blasticidin)(10 mg/mL,InvivoGen);DMSO(Beyotime);polybrene试剂。CO2培养箱(MCO-175型,SANYO);荧光显微镜(IX83,OLYMPUS);生物安全柜(BCG401,BAKER);QPCR仪(Mx3000P,Stratagene)。
1.2 方法 将小鼠胰岛素瘤INS-1冻存细胞取出放入水浴锅中复苏,后放入5%CO2培养箱中培养,当细胞培养皿中细胞数达到80%后,进行细胞铺板。
1.2.1 病毒侵染小鼠胰岛素瘤INS-1细胞的最佳感染复数(multiplicity of infection,MOI)值测定:病毒侵染细胞会对细胞膜造成一定损伤,MOI值(MOI值=病毒的用量/细胞的数量)过高使细胞膜的损伤超出细胞的自我修复功能,细胞的死亡率增大、形态发生改变[3]。在最佳MOI值,细胞有较高的荧光比率且病毒侵染对细胞的生长及形态影响较小,死亡率较低。设置MOI值梯度:0、10、30、60、120(TU number/cell),将小鼠胰岛素瘤INS-1空白细胞铺板于96孔板中,铺板细胞数为1.5×104个/孔[4],铺板第2天使用碘化丙锭(PI)荧光标记小鼠SGMS2干扰阴性对照慢病毒并按照上述各MOI值分别侵染INS-1空白细胞,使用polybrene试剂作为病毒助染剂[5-6],侵染后4 h换成新鲜培养基,培养72 h后使用荧光显微镜对设定MOI值分别拍照,每个MOI值拍3张分别为:荧光、荧光和白光叠加、白光。当细胞的荧光比率(%)(镜下荧光细胞数/细胞总数)在100%且细胞的死亡率(%)(死亡细胞数/细胞总数)小于2%,此时MOI值为细胞的最佳MOI值。每个MOI值设6个复孔。
1.2.2 小鼠胰岛素瘤INS-1细胞对BSD基因筛选抗生素(blasticidin)的敏感性测试:由于病毒侵染细胞后,SGMS2目的基因导入细胞并在细胞中表达产物。在构建表达载体时,添加一段BSD基因(抗生素blasticidin的抗性基因)。当在细胞培养基中加入一定浓度blasticidin时,由于空白细胞中不含抗性基因片段,因此会被杀死[7-8]。但当blasticidin浓度过高时,会造成阳性细胞表达下降,因此测定抗生素对空白细胞的最适作用浓度。
采用24孔细胞培养板,铺板细胞数为5×104个/孔,总体积为500 μL。向小鼠胰岛素瘤INS-1空白细胞中加入不同浓度blasticidin,使终浓度为0、1、2、3 μg/mL,每隔2 d观察1次并换液,在第7天时观察细胞的死亡率,使用荧光显微镜对每个blasticidin浓度各拍1张白光照片。死亡率达99%的BSD抗生素浓度为空白细胞的最佳敏感浓度。每个梯度设6个复孔。
1.2.3 稳转细胞系构建:将INS-1空白细胞培养至对数生长期,使用SGMS2干扰阴性对照慢病毒及SGMS2干扰慢病毒(病毒滴度:1×108TU/mL)按照上述实验中确定的最佳MOI值侵染细胞,侵染48 h后将细胞消化传至培养皿中扩大培养,经过扩大培养后,加入确定的最佳blasticidin浓度进行阳性细胞筛选2~3周(此后一直使用抗性培养基筛选),细胞株中阳性细胞的比率逐渐增加,获得混合系细胞。取培养细胞进行QPCR检测验证,要求第2次QPCR结果与第1次结果之差小于2个Ct,则视为稳转细胞系构建成功。INS-1空白细胞侵染后的细胞为INS-1-NC。
1.2.4 单克隆稳转细胞系构建:稳转细胞系的构建成功后,当细胞的荧光率达90%时,可进行单克隆稳转细胞系的构建[9]。将细胞消化、离心、重悬后,使用血球计数板对细胞进行计数,镜下在96孔细胞培养板中接种细胞,每孔细胞数为1个。接种24 h后,使用荧光显微镜镜检细胞,挑选出阳性细胞克隆的孔标记,继续培养至70%后[10],消化后传至3 cm细胞培养皿中,5%CO2培养箱扩大培养。
2 结果
2.1 小鼠胰岛素瘤INS-1细胞的最佳MOI值测定 随着MOI值的增加,干扰阴性对照慢病毒侵染INS-1空白细胞的荧光率越高,同时细胞经慢病毒侵染后的死亡率也会逐渐升高。MOI=60时细胞侵染后,此时细胞的荧光率达100%,但细胞的死亡率<0.5%,细胞保持原有的形态,无其他异常情况。当MOI=120时,细胞的荧光率达100%,细胞死亡率大于3%,细胞生长状态变差,逐渐变圆,失去原有的形态,由此可判断INS-1细胞的最佳MOI为60。见图1、表1。

图1 不同MOI值下小鼠胰岛素瘤INS-1细胞荧光率与死亡率的镜检结果(×200)Fig.1 Fluorescence and apoptosis of mice pancreatic insulinomas INS-1 cells at different MOI by microscopic examination(×200)
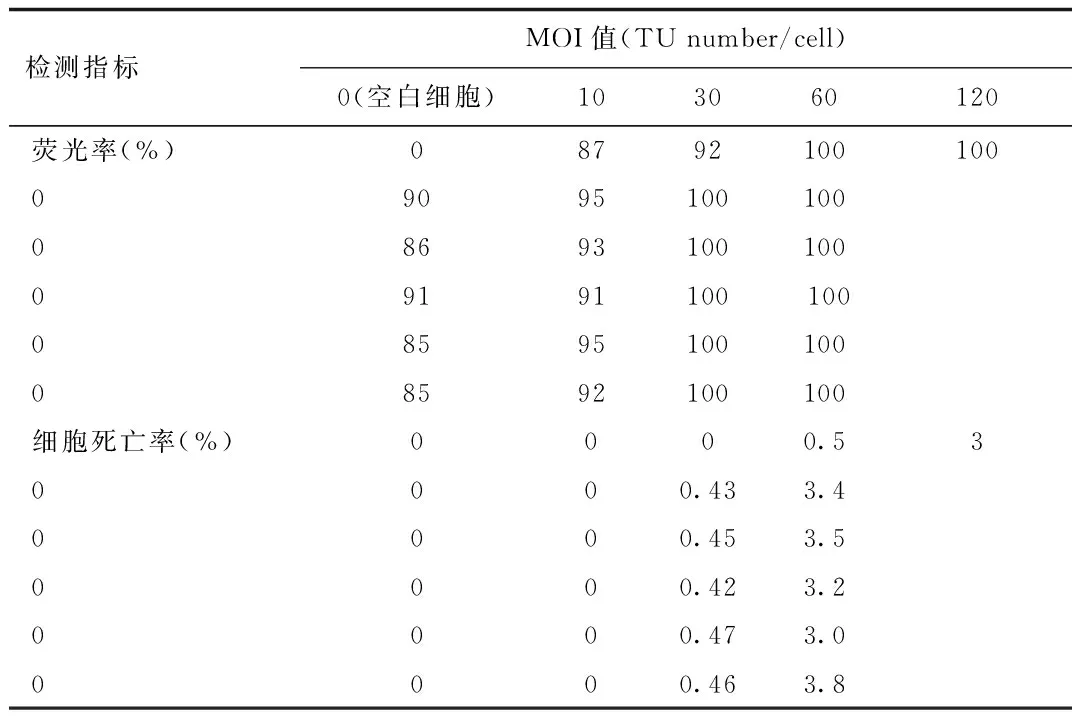
检测指标MOI值(TUnumber/cell)0(空白细胞)103060120荧光率(%)087921001000909510010008693100100091911001000859510010008592100100细胞死亡率(%)0000.530000.433.40000.453.50000.423.20000.473.00000.463.8
2.2 小鼠胰岛素瘤INS-1空白细胞对BSD抗生素的敏感性 当blasticidin浓度为0 μg/mL时,空白细胞密度为95%左右;当blasticidin浓度为1 μg/mL时,大于85%出现细胞生长状态变差,细胞的形态变圆,明显抑制了细胞的增殖,明显小于blasticidin浓度为1 μg/mL时的细胞密度;当blasticidin浓度为2 μg/mL时,空白细胞形态已全部变成圆形,细胞失去原有的贴壁性,细胞已全部死亡。因此可以得出:INS-1空白细胞对BSD抗生素的敏感浓度为2 μg/mL。见图2、表2。

图2 小鼠胰岛素瘤INS-1空白细胞对不同浓度blasticidin的敏感性镜检结果(×200)Fig.2 Blasticidin sensitivity of mice pancreatic insulinomas INS-1 cells at different concentrations by microscopic examination(×200)

检测指标BSD抗生素浓度(μg/mL)0123细胞生长密度(%)955000964800935200954500924600945000
2.3 稳转细胞系构建结果 INS-1-SEMS2细胞第2次检测的Ct值28.21大于第1次检测的Ct值27.58,且siRNA的干扰效率为77.78%,siRNA成功地在细胞中表达,混合稳转细胞系构建成功。见表3。

表3 稳转细胞系QPCR检测Tab.3 Construction of stable cell line detected by ±s)
2.4 单克隆稳转细胞系的构建 最终成功构建小鼠胰岛素瘤INS-1-SEMS2及INS-1-NC单克隆细胞系。见图3。

图3 小鼠胰岛素瘤INS-1-SEMS2及INS-1-NC单克隆细胞系(×200)Fig.3 Monoclonal cell line of mice pancreatic insulinomas INS-1-SEMS2 and INS-1-NC cells(×200)
3 讨论
3.1 单克隆稳转细胞系的构建 当慢病毒侵染细胞将目的基因转入细胞中,目的基因在细胞中转录表达出目的产物后,细胞克隆成功[11]。导入细胞的目的基因中载有特殊的抗性基因,产生的基因表达产物,使细胞具有对特定抗生素有抗性,而空白细胞中不含有抗性基因。因此,再加入抗生素后,空白细胞缺少抗性产物而被杀死。设定抗生素的加药浓度梯度,可测得空白细胞对抗生素的敏感浓度。
3.2 INS-1细胞的最佳MOI值测定 INS-1细胞的最佳MOI值测定时,可增设MOI值的梯度,使MOI值更加精确。在测定细胞最佳MOI值时,可增加一个对照组,完全培养基中添加polybrene和不添加polybrene作对照[12]。在侵染4 h后,换成完全培养基即可,在以后培养过程中不需要再换液。若期间换液,可能导致细胞生长过多,细胞之间的间距变小,细胞的形态不明显,影响细胞MOI值的判断。
通过试验可知当MOI值为60时,细胞的荧光率在100%,细胞的死亡率最低,病毒的侵染效果最佳;抗生素的浓度为2 μg/mL时,在7~8 d时,细胞死亡率达99%以上,杀灭空白细胞的效果最佳。经慢病毒侵染后的混合细胞株加入BSD抗生素,成功筛选出目的基因阳性表达的细胞,并建立稳定的单克隆细胞株。
[1] 李辉.乳腺表达人IFNα-2b转基因小鼠模型的构建[D].南宁:广西大学,2012:34-49.
[2] 熊晖.RNA干扰CYP17基因抑制前列腺癌细胞生长的试验研究[D].济南:山东大学,2012:42-65.
[3] 刘朋.细胞培养环境下的磷酸钙矿化及其对细胞活性的影响[D].浙江:浙江大学,2012:75-83.
[4] 王飞.血管外膜成纤维细胞microRNA-21在血管重构中的作用及其机制的研究[D].济南:山东大学,2012,21-40.
[5] 赵国栋.家蚕解毒酶基因表达调控研究[D].苏州:苏州大学,2013.35-52.
[6] 胡宗强.CTGF基因RNA干扰干细胞对大鼠肝纤维化的治疗作用[D].昆明:昆明医科大学,2013:115-136.
[7] 宋修光.1.3倍乙型肝炎病毒全基因质粒在SV40T永生化小鼠肝细胞中的表达[D].济南:山东大学,2012:66-81.
[8] 孟灵真.棉花Bt抗虫基因与bar抗除草剂基因的双价植物表达载体的构建及转化的研究[D].乌鲁木齐:新疆农业大学,2013:13-15.
[9] 刘健,王海娟,张金龙,等.以双质粒逆病毒载体系统快速建立梯度过表达hMTA1稳转单克隆细胞系的方法[J].癌症展,2012,10(3):205-210.
[10] 荆玉明.慢病毒法建立表达外源基因的人前列腺癌稳定细胞株[D].广州:南方医科大学,2012:4.
[11] 郝彦哲.慢病毒介导siRNA和细胞内抗病毒因子对HIV抑制作用研究[D].北京:北京工业大学,2013:86-94.
[12] 李宏云.Smad4基因小RNA干扰对小鼠骨骼肌急性钝挫伤愈合影响的研究[D].上海:复旦大学,2012:65-85.
(编校:王俨俨)
Optimize multiplicity of infection and selected concentration of antibiotics in construction of monoclonal stable cell line by lentivirus vector-mediated RNA interence silenced gene SGMS2
JIN Xiao-hua1Δ,QIN Gao2
(1.Teaching and Research Apartment of Chemistry and Biotechnology in Department of Food Science, Suzhou Polytechnic institute of Agriculture, Suzhou 215008, China;2.Shanghai Nuo Bai Biotechnology Limited Company,Shanghai 200233, China)
ObjectiveTo optimize multiplicity of infection (MOI) and antibiotics (blasticidin) concentration selecting BSD gene in construction of monoclonal stable cell line by lentivirus vector-mediated RNA interence silenced gene SGMS2. MethodsThe INS-1 cells were transfected by fluorescence labeled negative control SGMS2-siRNA lentivirus at MOI of 0, 10, 30, 60 and 120 TU number/cell. The cells were photographed under fluorescent microscopy after 72 h cultivation, then fluorescence ratio and apoptosis rate were calculated to determine optimal MOI. The INS-1 cells were treated by blasticidin with different concentrations of 0, 1, 2, and 3 μg/mL, and the apoptosis rate was observed to acquire optimal concentration of antibiotics. The INS-1 cells were transfected by negative control SGMS2-siRNA lentivirus and SGMS2-siRNA lentivirus (virus titer: 1×108TU/mL) at optimal MOI and positive-transfected cells were selected by blasticidin at optimal concentration, then mixed cell lines were acquired. The monoclonal cell line was constructed at fluorescence ratio of 90%. ResultsThe optimal MOI was 60 with 100% fluorescence ratio, less than 0.5% apoptosis rate and keep original cellular morphology. The optimal concentration of blasticidin was 2 μg/mL with cell adherence disappear and all cells apoptosis. The Ct value of INS-1-SEMS2 cells detected at the second time was 28.21, which was greater than 27.58 at the first time. The interfering efficiency of siRNA was 77.78% which indicated a successful expression of siRNA and construction of monoclonal stable cell line (INS-1-SEMS2). ConclusionThe monoclonal stable cell line was successfully constructed by lentivirus vector-mediated RNA interence silenced gene SGMS2.
mice pancreatic insulinomas INS-1 cells;multiplicity of infection;selecting antibiotic BSD gene;stable cell line
金小花,通讯作者,女,硕士,讲师,研究方向:生物制药,E-mail:junxiaohuadoc@163.com。
Q78
A
1005-1678(2015)09-0051-04

