造影超声心动图的现状及未来
张文 综述 黄鹤 审校
(四川大学华西医院心内科,四川 成都 610041)
左心室显影及心内膜边界界定已被认证可在临床上使用,心肌灌注造影和频谱多普勒信号增强的应用虽然超过了药品说明书使用范围,但对临床的指导也是非常有价值的。而造影超声心动图(又称心脏超声造影)操作的标准化需进一步统一,以提高其效率。超声造影剂的发展为造影超声心动图技术提供了更多的发展空间,如:检测异常微血管功能、心血管疾病分子成像、位点靶向递送治疗性基因或药物、冠状动脉超声促溶栓等,其安全性和临床可行性需进一步研究,因而这些新技术在临床上的应用将面临更艰巨的挑战。现将造影超声心动图现状及未来综述如下。
1 造影超声心动图物理学技术及原理
1.1 脉冲反转多普勒技术
此技术是一项组织消融技术,向心腔和心肌发送交替的多重脉冲以克服运动产生的伪影。脉冲反转多普勒技术通过只接收even-order 谐波而保证了极好的组织抑制性和图像的高分辨率,但却有显著的衰减效应,尤其在心尖切面的基底段[1]。
1.2 功率调制技术
此技术是一项在非常低的机械参数(0.05~0.20)条件下提高信噪比的技术,也是一种多脉冲组织消融技术。低功率脉冲使组织产生线性反应,稍高功率脉冲使机体组织产生线性反应的同时使微泡产生非线性反应,两种不同功率的脉冲所产生的线性反应相互抵消,因此传感器只能接收由微泡产生的非线性行为,实现抑制组织的信号。但该技术不能提高分辨率和图像质量[1]。
1.3 造影脉冲序列技术
通过脉冲间相位和幅度的调制而结合多重脉冲的技术,是一项更为复杂的技术,在低机械参数的情况下,增强来自微泡的非线性反应和抵消来自组织的线性反应。在非常低的机械参数(0.05~0.20)情况下,特殊的脉冲序列被用来造影显像,从而实现具有良好空间分辨率的实时左心室显影和心肌灌注造影[1]。
造影超声心动图运用了以上先进的技术,尽可能地放大微泡的非线性反应,消除自身组织的线性反应,形成对比,大幅度提高图像质量。在临床上,若没有条件调制非常低的机械参数(0.05~0.20),也可以用低机械参数(<0.3)替代。
2 造影超声心动图的禁忌证
(1)有明显右向左分流或双向分流患者。(2)对超声造影剂成分,如:全氟丙烷过敏的患者。(3)对血液、血制品或白蛋白过敏的患者(只针对Optison)。(4)妊娠或哺乳期女性。
3 造影超声心动图的安全性及特性
2007年10月,美国食品和药物管理局(FDA)对Optison (可注射全氟丙烷蛋白A 型微球悬浮液,英国)、Definity(可注射全氟丙烷脂质微球悬浮液,美国)等超声造影剂发出“黑匣子”警告。因为在超声造影剂使用期间有4 例死亡事件和190 例严重心肺反应事件的报道,这些事件与超声造影剂的使用有紧密的时间关系。即使无确切的因果关系,但重新完善的超声造影剂仍有“黑匣子”警告,限制了超声造影剂的使用,同时要求患者检查完后必须观察30 min[2]。尽管目前“黑匣子”警告仍然存在,但许多疾病不再是使用超声造影剂的禁忌证,检查完毕后也不再需要观察30 min[3]。
随着对造影超声心动图技术的深入探究,发现超声造影剂在许多疾病状态下使用是安全的。如:大量文献的回顾没有发现卵圆孔未闭患者形成系统性栓塞的风险与造影剂有关,且发现对可疑或明确诊断有心内分流的患者,使用超声造影剂也是安全的[4];FDA最初认为肺动脉高压是注射超声造影剂的禁忌证,而一项回顾性队列研究证实了在用三尖瓣反流压差估计的肺动脉高压患者中使用超声造影剂是安全的,主要是因为目前经FDA 认证的改良后超声造影剂是由高分子气体和多种类型的壳组成,在循环中大多数微泡的直径<10 μm,并处于相对的稳定状态[5]。
从2007年至今,基于许多同行对超声造影剂的安全性和功效性的研究,医学界(包括FDA)对超声造影剂的风险和收益比有了进一步的认识。近期Goldberg等发表于《Cardiology》的文章观察到:从2003年7月~2008年6月在布朗克斯的Montefiore 医疗中心,96 705例患者作了经胸超声心动图,其中2 518 例患者接受了静脉注射Definity。Definity 组一天总的病死率为0.44%,而没有注射Definity 组的病死率为0.45%(P=0.72)。在多变量的分析中,调整年龄、性别、住院与门诊、疾病状态、视力和左室射血分数等相关因素后,注射超声造影剂不增加病死率(调整后的比值比:1.18,95% CI 0.56~2.48,P =0.67)[3]。再一次证明了超声造影剂的安全性。
临床常用超声造影剂的特点比较[6](见表1)。
4 临床应用
4.1 左心室显影应用
目前在静息或负荷常规超声心动图诊断困难的情况下,左心室显影成为改善心内膜边界的支柱性方法。在声学领域中,微泡可在血液循环中产生很强的向后散射的信号,这样便能更好地界定左心室的心内膜边界。临床研究表明左心室显影有提高左心室容积和射血分数测量准确性的优势,同时在静息或负荷情况下对室壁运动的评估、心尖异常的评估等有积极的作用[7]。
操作方法:(1)注射前药物准备:①Optison:用手把小药瓶中的Optison 摇匀至微球状,约20 s。用30 mL 注射器抽取3 mL Optison 和27 mL 生理盐水,混匀。Optison 根据人体表面积的不同可持续7~8 min。②Definity:用Vialmix 把含Definity 的小药瓶振摇45 s后,用30 mL 的注射器抽取1.5 mL Definity 和28.5 mL生理盐水混匀。③Sonovue:将5 mL 生理盐水注入Sonovue 的小瓶中,用力振摇至冻干粉末完全分散。(2)在给药前先检查静脉通道是否通畅,将注射泵调为90 mL/h 并泵入稀释后超声造影剂,当左心室腔内充分显影后立即采集图像。也可人工缓慢推注0.5 mL稀释后的超声造影剂,至少超过10 s,根据图像情况可适当追加超声造影剂,检查完后用3~5 mL 的生理盐水冲洗管腔。(3)连接心电图,将iE33 调成Contrast 左心室显影状态,并用S5-1 探头或三维超声探头获取图像。(4)图像获取顺序:心尖四腔心切面、两腔心切面、三腔心切面、胸骨旁左室长轴和短轴切面,包括胸骨左室心尖短轴切面[1]。
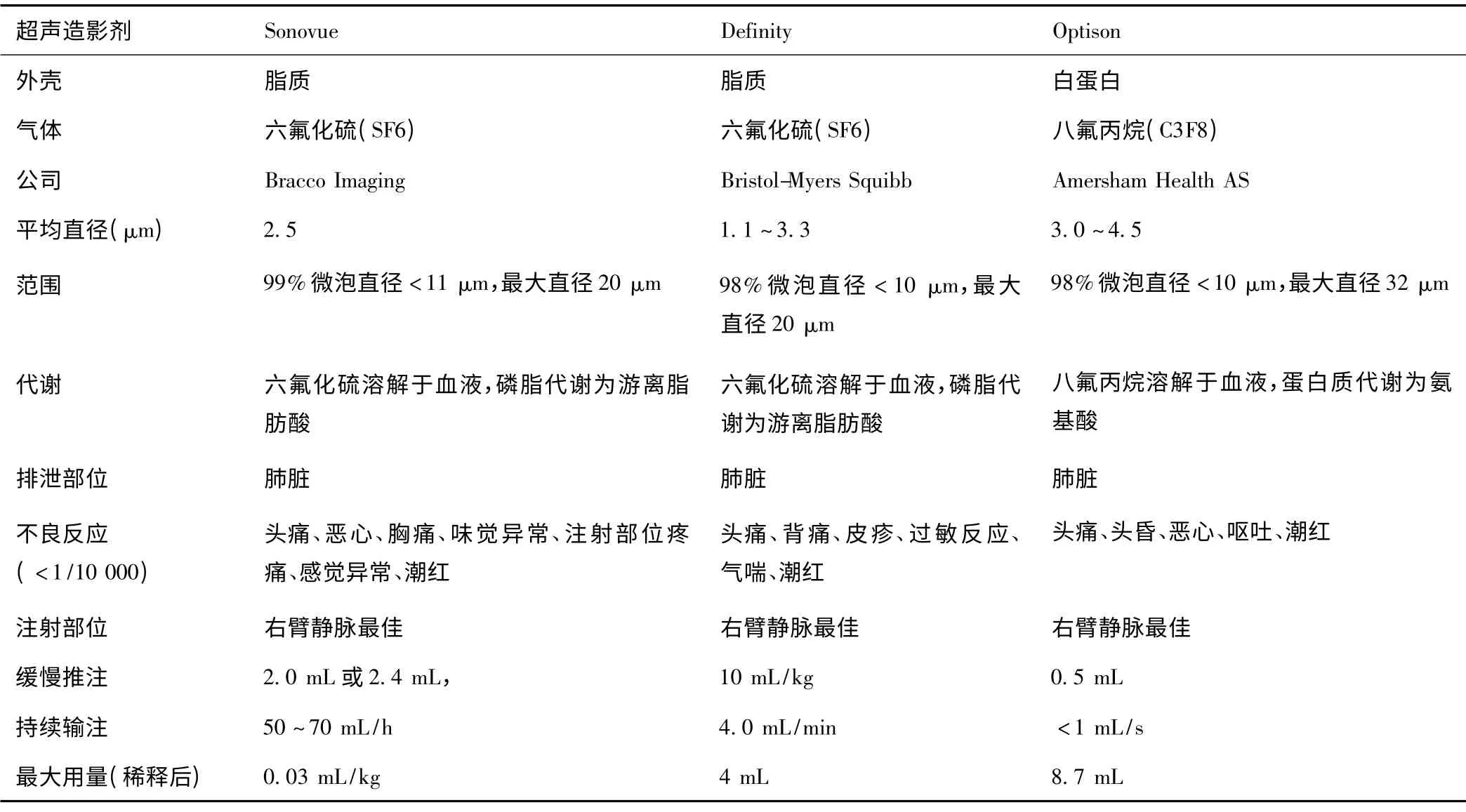
表1 临床常用的三种超声造影剂特性
4.1.1 心内膜的界定及心功能的评估
已证明第二代超声造影剂在界定心内膜方面优于第一代,以心脏核磁共振为参考标准,使用超声造影剂增强了对心内膜的界定,从而证实了使用超声造影剂能够让左心室容量和射血分数测值更准确。研究表明常规超声心动图较造影超声心动图低估左心室容量30%~40%、低估左室功能3%~6%。所以美国超声心动图协会[8]和欧洲超声心动图协会[9]达成了共识,在一定条件下,尽可能施行造影超声心动图,以避免对左心室容量及心功能的低估。
4.1.2 评估心脏结构
左心室心尖的图像往往被近场的伪影所干扰。左心室血栓常在左心室心尖区,而在左心室射血分数较低、心尖室壁瘤或血栓栓塞的患者中,用常规超声心动图检查,心尖区的血栓常常被忽视掉。一项回顾性的研究中409 例患者仅用组织谐波成像技术,46%的技师不能明确的诊断,在使用造影剂后,90%的技师能提供确切的诊断信息来排除或确诊血栓的存在[10]。
4.1.3 心尖肥厚型心肌病
肥厚型心肌病中约有7%的患者为心尖肥厚型心肌病,由于心尖区心内膜边界显示不清,所以常规的超声心动图很难检查出[8]。当高度怀疑心尖肥厚型心肌病,可行造影超声心动图,有助于诊断。造影后可见心尖肌壁明显增厚、左心腔内出现“铲样”特征性的图像。
4.1.4 左室室壁瘤和假性室壁瘤
左室室壁瘤是心肌梗死后常见无症状的并发症,最常表现为左心室心尖部异常[8],以薄壁和扩张的心尖为特征,并伴有运动障碍。虽然这些特征较容易被常规超声心动图所观察到,但在心尖短视时却不能充分显像,因此心尖的室壁瘤可能会被漏诊。而使用超声造影剂能减少短视,帮助观察心尖室壁运动异常,有助于诊断。对于假性室壁瘤,通过造影超声心动图能够清晰地显示颈部和收缩期充盈的瘤体,达到诊断和鉴别的目的[11]。
4.1.5 在重症监护室中的应用
重症监护室中,由于大多数患者体型肥胖、有严重的心肺疾病或使用机械通气,超过30%的患者常规超声心动图检查结果不准确[12]。美国超声心动图协会推荐使用超声造影剂并结合超声心动图专业的诊断标准[8],准确评估心脏的基本情况。研究发现对危重症住院患者行经胸超声心动图,用或不用造影剂的48 h 病死率分别为2.18%、2.97%[13]。因此应该在重症监护室积极地使用造影超声心动图。
4.2 心肌灌注造影的应用
造影剂中的微泡与红细胞的直径相近,可一直稳定地在血管中运行,所以它们是评估心肌灌注理想的示踪剂。心肌声学造影中,正常心肌中的微泡被高能量的脉冲波破坏后能够迅速再填充,一般为4 s;缺血区再灌注的速率会减慢或者不能完全填充,与正常心肌形成对比,有助于诊断[14]。
操作方法:(1)注射前药物准备:稀释方法已阐述。(2)通过可自动调节的注射泵泵入药物,不少于60 s,前8s 泵入速度为4 mL/min,之后速度为0.8 mL/min(用注射泵持续灌注的方法最佳,能使造影剂灌注心肌的速率恒定,便于分析)。(3)连接心电图:将iE33 调至Contrast Low MI 状态,并用S5-1 探头超声探头获取图像。(4)在收缩末期需用高机械参数的脉冲波,即通过闪烁显像(flash:机械参数为1.7 且持续四个心动周期突发的超声波,周期的数量根据超声心动图仪所运行的软件来设置,主要为了将已进入心肌中的微泡破坏得更彻底)来获取心肌重新灌注图像。(5)主要需获得左室壁17 节段的图像。
4.2.1 评估心肌缺血
与冠状动脉造影相比,负荷心肌声学造影的灵敏度和特异性分别为83%和80%[9],同时心肌声学造影具有快速、非侵入性等特点,因此可用于冠心病的筛查。回顾性研究观察到在诊断冠心病和多支血管病变上,心肌灌注比仅依靠室壁运动更敏感,心肌灌注对90%的患者诊断有帮助,同时显示心肌灌注有极好的临床可行性和可重复性,应该纳入日常检查[15]。
4.2.2 评价冠心病预后情况
冬眠心肌为通过治疗后,自然恢复或使用小剂量多巴酚丁胺后收缩功能提高功能障碍的心肌。一项前瞻性研究显示,对冬眠心肌的检测以及预测局部或整体心功能的恢复,心肌声学造影的定性定量都要优于单光子发射计算机断层成像技术[16]。而且心肌声学造影对于可逆性心肌缺血的检测更加实用、准确。特别是对于急性心肌梗死后病情稳定的患者,心肌声学造影可对左心室功能、存活心肌进行评估,而这些结果是强有力的预后标志物[17]。
4.2.3 在急诊室的应用
评估高度怀疑为心源性胸痛患者情况,心肌声学造影是一项理想的操作。它能直接评估微循环的灌注程度和室壁的异常运动,具有快速、高精度、安全和非侵入性等特点。其用于诊断和获得预后信息的价值超过了目前临床上常规的检查方式。同时能够准确地排除心源性胸痛,减少了不必要的住院治疗和心脏过度检查[18]。
4.2.4 血栓和肿瘤的鉴别
在条件允许的情况下可使用非常低机械指数(0.05~0.20)的实时灌注显影,并通过闪烁显像来鉴别。血栓是缺血性的,所以不会有超声造影剂进入,表现为充盈缺损。而肿瘤是有血液供应的,虽然有的含血管较少(良性间质瘤,例如黏液瘤),有的含血管丰富(恶性肿瘤),但都会按血供分布重新灌注显影,且显影程度和血供含量一致[1]。《欧洲心脏病学杂志》2013年报道了1 例运用造影超声心动图鉴别诊断心房肿块:1 例64 岁患有慢性肝脏疾病的男性患者,因呼吸困难入院,临床多考虑为肺栓塞,增强CT 却偶然发现心房肿块。且在扫描的早期阶段肿块的密度与心肌是相同的,CT 诊断为血栓。而后使用了心肌声学造影来观察肿块内是否能进入造影剂。结果表明肿块灌注速率与心肌灌注速率相等,因而证实了肿块有血供,提示为心脏肿瘤。在患者死后,尸检取出8 cm×7 cm×4 cm 右心房病变组织,组织病理学、免疫组织化学等证实为转移性胆管癌[19]。
5 未来
左心室显影在临床上被广泛应用的同时,研究者们也不断地开拓造影超声心动图技术新的发展领域,如:心肌灌注成像、冠状动脉血流储备量的测定、滋养血管的成像技术等。以下几个方面是造影超声心动图技术的新领域,在未来需要不断地对这些技术进行研发及测试,并确定其最佳的声学条件[20]。
5.1 检测异常微血管功能
微血管异常通常出现于高血压、糖尿病、扩张型心肌病的患者或者是伴有心绞痛而且负荷试验阳性但没有心外膜疾病的患者[21]。针对心脏的微血管,心肌声学造影已经用于评估儿茶酚胺过剩引起的应激性心肌病中微血管的异常。测定心外膜是通过测定冠状动脉血流速度而实现,因为超声造影剂能够增强频谱多普勒检测信号,所以提高了测定心外膜的能力,也可用来评估冠心病的严重程度。总的来说,造影超声心动图技术可间接识别主要冠状动脉并获得清晰而可靠的频谱多普勒信号,因此非常有可能将该技术用于微血管的检测[22]。
5.2 心血管疾病分子成像
分子和细胞内成像技术是伴随着超声造影剂的发展而产生的,尤其是靶向造影剂。这些“聪明”的微泡能在血液循环中靶向定位,然后通过超声心动图检测出来[23]。在心血管领域对造影分子成像技术潜在的应用主要包括:评估血栓形成、血管生成、炎症和缺血。例如微血栓的分子成像和靶向标志物的活化血小板可以反映心肌梗死患者溶栓后或支架术后的并发症(例如远端栓塞或无复流现象)[24];缺血期间组织器官高表达的血管内皮黏附分子,如P-选择素,靶向定位于P-选择素的微泡则可用来采集分子信号,这种信号在心肌缺血消除后会存在几小时(“缺血性记忆”成像)。临床医生可能借此诊断急诊室中近期发生心肌梗死的患者,他们具体表现为胸痛缓解、心电图阳性、生化标志物呈阴性[14],其安全性及有效性有待我们进一步探究。
5.3 位点靶向递送治疗性基因或药物
微泡可介导基因和药物,有靶向传递基因和药物的潜能。在超声中微泡介导的基因转染率最高,微泡和基因能不断地被送到特定的靶点[25]。猜想可能是振荡后的微泡改变了细胞膜通透性,从而提高了基因的转染率。介导药物的微泡可选择性在预测的病变处裂解、释放药物,使得病变处局部血药质量浓度升高而全身血药质量浓度维持在低水平,减少毒副作用,优化治疗方案[26]。多项研究表明这种能介导药物的微泡能兼顾造影剂和治疗载体二者的作用[27]。
5.4 冠状动脉超声促溶栓
经超声溶栓是声学介导的血栓溶解。不管微泡是否结合血栓溶解剂,都能增强溶栓作用。与单独运用血栓溶解剂相比,直接用微泡超声治疗增加了血栓溶解率,且降解得更充分。这种技术已经探索性地应用于心肌梗死、脑卒中、静脉血栓等疾病中,但需进一步的研究,以最佳的声学状态来实现治疗效果,且尽可能地避免不良生物学效应[27]。
6 总结与展望
造影超声心动图技术通过应用超声造影剂很大程度上提高了声学显像的能力,增加了疾病诊断的敏感性与特异性。但是在临床实践中使用造影超声心动图获得理想的图像在技术上仍然面临着显著的挑战。在过去的几十年里,左心室显影及心内膜边界界定已被认证可在临床上使用,但其规范性及效率性仍是关注的焦点。近期研究表明,在超声心动图室中,经过专业临床技能培训的超声医师能够提高造影超声心动图操作的时间效率[28]。但其具体操作的标准化仍需进一步探索。尽管很多临床研究证实了心肌灌注造影和频谱多普勒信号增强技术的应用价值与安全性,但要进一步获得FDA 的认证需要更多的努力。随着微泡造影剂的发展,造影超声心动图技术有更广阔的发展空间,比如心血管疾病分子成像、靶向递送治疗性基因或药物等,这都需要研究者们不断努力,将这些理论上可行的方案运用到临床上,使心血管疾病的诊断和治疗向前迈出一大步。
[1]Porter TR,Abdelmoneim S,Belcik JT,et al.Guidelines for the cardiac sonographer in the performance of contrast echocardiography:a focused update from the American Society of Echocardiography[J].J Am Soc Echocardiogr,2014,27(8):797-810.
[2]Main ML,Goldman JH,Grayburn PA.Thinking outside the“box”—the ultrasound contrast controversy[J].J Am Coll Cardiol,2007,50:2434-2437.
[3]Main ML.Contrast echocardiography:safety in numbers[J].Cardiology,2012,122:248-250.
[4]Parker JM,Weller MW,Feinstein LM,et al.Safety of ultrasound contrast agents in patients with known or suspected cardiac shunts[J].Am J Cardiol,2013,112:1039-1045.
[5]Abdelmoneim SS,Bernier M,Scott CG,et al.Safety of contrast agent use during stress echocardiography in patients with elevated right ventricular systolic pressure:a cohort study[J].Circ Cardiovasc Imaging,2010,3:240-248.
[6]Modonesi E,Balbi M,Bezante GP.Limitations and potential clinical application on contrast echocardiography[J].Curr Cardiol Rev,2010,6:24-30.
[7]Chahal NS,Senior R.Clinical applications of left ventricular opacification[J].JACC Cardiovasc Imaging,2010,3:188-196.
[8]Mulvagh SL,Rakowski H,Vannan MA,et al.American Society of Echocardiography consensus statement on the clinical applications of ultrasonic contrast agents in echocardiography[J].J Am Soc Echocardiogr,2008,21(11):1179-1201;quiz 1281.
[9]Senior R,Becher H,Monaghan M,et al.Contrast echocardiography:evidencebased recommendations by European Association of Echocardiography[J].Eur J Echocardiogr,2009,10(2):194-212.
[10]Thanigaraj S,Schechtman KB,Perez JE.Improved echocardiographic delineation of left ventricular thrombus with the use of intravenous second-generation contrast image enhancement[J].J Am Soc Echocardiogr,1999,12:1022-1026.
[11]Moreno R,Zamorano JL,Almeria C,et al.Usefulness of contrast agents in the diagnosis of left ventricular pseudoaneurysm after acute myocardial infarction[J].Eur J Echocardiogr,2002,3:111-116.
[12]Kurt M,Shaikh KA,Peterson L,et al.Impact of contrast echocardiography on evaluation of ventricular function and clinical management in a large prospective cohort[J].J Am Coll Cardiol,2009,53:802-810.
[13]Main ML,Hibberd MG,Ryan A,et al.Acute mortality in critically ill patients undergoing echocardiography with or without an ultrasound contrast agent[J].JACC Cardiovasc Imaging,2014,7:40-48.
[14]Ducas R,Tsang W,Chong AA,et al.Echocardiography and vascular ultrasound:new developments and future directions[J].Can J Cardiol,2013,29:304-316.
[15]Shah BN,Chahal NS,Bhattacharyya S,et al.The feasibility and clinical utility of myocardial contrast echocardiography in clinical practice:results from the incorporation of myocardial perfusion assessment into clinical testing with stress echocardiography study[J].J Am Soc Echocardiogr,2014,27:520-530.
[16]Chelliah RK,Hickman M,Kinsey C,et al.Myocardial contrast echocardiography versus single photon emission computed tomography for assessment of hibernating myocardium in ischemic cardiomyopathy:preliminary qualitative and quantitative results[J].J Am Soc Echocardiogr,2010,23:840-847.
[17]Hayat SA,Senior R.Myocardial contrast echocardiography in ST elevation myocardial infarction:ready for prime time?[J].Eur Heart J,2008,29:299-314.
[18]Wei K.Utility contrast echocardiography in the emergency department[J].JACC Cardiovasc Imaging,2010,3:197-203.
[19]Gaibazzi N,Giumelli C,Martella EM,et al.Contrast-echocardiography for the differential diagnosis of atrial masses[J].Eur Heart J,2013,34:1957.
[20]Davidson BP,Lindner JR.Future applications of contrast echocardiography[J].Heart,2012,98:246-253.
[21]Moir S,Hanekom L,Fang ZY,et al.Relationship between myocardial perfusion and dysfunction in diabetic cardiomyopathy:a study of quantitative contrast echocardiography and strain rate imaging[J].Heart,2006,92:1414-1419.
[22]Rigo F,Richieri M,Pasanisi E,et al.Usefulness of coronary flow reserve over regional wall motion when added to dual-imaging dipyridamole echocardiography[J].Am J Cardiol,2003,91:269-273.
[23]Leong-Poi H.Molecular imaging using contrast-enhanced ultrasound:evaluation of angiogenesis and cell therapy[J].Cardiovasc Res,2009,84:190-200.
[24]Wang X,Hagemeyer CE,Hohmann JD,et al.Novel single-chain antibody-targeted microbubbles for molecular ultrasound imaging of thrombosis:validation of a unique noninvasive method for rapid and sensitive detection of thrombi and monitoring of success or failure of thrombolysis in mice[J].Circulation,2012,125:3117-3126.
[25]Phillips LC,Klibanov AL,Bowles DK,et al.Focused in vivo delivery of plasmid DNA to the porcine vascular wall via intravascular ultrasound destruction of microbubbles[J].J Vasc Res,2010,47:270-274.
[26]Xiong X,Zhao F,Shi M,et al.Polymeric microbubbles for ultrasonic molecular imaging and targeted therapeutics[J].J Biomater Sci Polym Ed,2011,22:417-428.
[27]Martin KH,Dayton PA.Current status and prospects for microbubbles in ultrasound theranostics[J].Wiley Interdiscip Rev Nanomed Nanobiotechnol,2013,5(4):329-345.
[28]Tang A,Chiew SK,Rashkovetsky R,et al.Feasibility of sonographer-administered echocontrast in a large-volume tertiary-care echocardiography laboratory[J].Can J Cardiol,2013,29:391-395.

