乙氧基白屈菜红碱与人血清白蛋白的相互作用
潘先良, 钟 明, 冯务群
(1. 岳阳新华达制药有限公司, 湖南 岳阳 414000; 2. 湖南理工学院化学化工学院, 湖南 岳阳 414006; 3. 湖南中医药高等专科学校, 湖南 株洲 412012)
乙氧基白屈菜红碱与人血清白蛋白的相互作用
潘先良1,2, 钟 明2, 冯务群3
(1. 岳阳新华达制药有限公司, 湖南 岳阳 414000; 2. 湖南理工学院化学化工学院, 湖南 岳阳 414006; 3. 湖南中医药高等专科学校, 湖南 株洲 412012)
采用荧光光谱法研究了乙氧基白屈菜红碱(ECHE)与人血清白蛋白(HSA)相互作用的机制. 在模拟人体生理条件下, 根据二者相互作用的光谱学特征, 采用Lineweaver-Burk双倒数方程和热力学方程计算了三个温度下ECHE与HAS的结合参数. 结果表明: 在290K, 300K, 310K时ECHE与人血清白蛋白的结合常数分别为1.595×105L·mol-1, 1.718×105L·mol-1, 1.680×105L·mol-1; 结合位点数分别为1±0.06; 二者之间的主要作用力为静电作用力. 研究表明ECHE与人血清白蛋白之间作用生成了无荧光效应的复合物, 属静态猝灭.
乙氧基血根碱; 人血清白蛋白; 荧光猝灭
白屈菜红碱(Chelerythrine, CHE) 是一种具有抗菌、抗病毒及抑制肿瘤细胞等活性的苯并菲啶类生物碱[1], 通常可从罂粟科植物如白屈菜、血水草、博落回中提取出来, 其分子式为C21H18NO4+, 结构式如图1A所示. CHE是蛋白激酶C(PKC)的选择性抑制剂, 它的许多生物学活性都与PKC有关[2~7], 宗永立等人的研究也表明[3], CHE体外抗肿瘤作用较强, 能明显抑制宫颈癌细胞、癌肉瘤、食道癌WHC-05、白血病HL-60细胞、鼻咽癌KB细胞、L1210细胞、P388细胞和胃癌细胞等的生长, 其作用机理是抑制细胞周期、抑制细胞中蛋白激酶C活性、并能诱导细胞凋亡等, 因此它也是一种很有前途的细胞毒性抗肿瘤化合物. 由于乙醇是CHE重结晶过程中的常用溶剂, 而乙醇中的乙氧基在结晶过程中易于接到CHE分子的六号位上, 故大多数情况下所得的CHE实为其乙氧基化合物(Ethoxychelerythine, ECHE), 其分子结构见图1B. 二者结构上的差异使得ECHE的生物活性较CHE的性质会发生相应的改变. 由于药物在人体中的运输主要是借助人体血浆中的血清白蛋白(HSA)实现的, 因此深入探讨ECHE与HSA的相互作用对于研究白屈菜红碱的抗肿瘤机制具有极为重要的意义[8~10].
本实验在模拟人体生理条件(pH值为7.4)下, 采用荧光光谱研究了ECHE与HSA结合作用的光谱特征, 获得了二者相互结合的热力学参数. 可为乙氧基白屈菜红碱在人体内的运输和代谢过程及药理药效研究提供有益的参考.
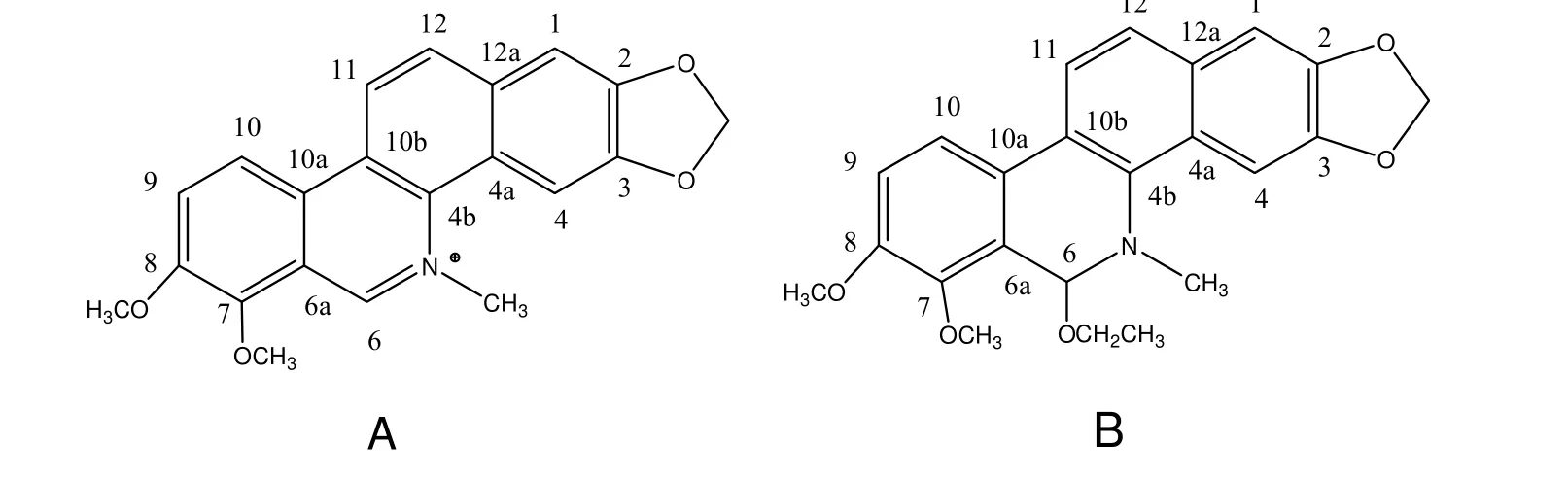
图1 CHE(A)与ECHE(B)的分子结构式
1 实验部分
1.1 仪器与试剂
主要仪器为LS-55荧光分光光度计(美国珀金埃尔默公司, PerkinElmer)及金坛市天竟实验仪器公司的高精度超级恒温循环水浴锅, 梅特勒精密电子分析天平. 上海精密仪器厂生产的PH-3S型pH计. CHE标准品及实验用的ECHE样品均为湖南理工学院化学化工学院天然药物实验室提供, 被配制成浓度为1.0×10-3mol/L的储备液, 于4℃的暗处保存. 配制浓度为0.1mol· L-1的Tris-HC1缓冲溶液, pH为7.4, 并以此溶液配制浓度为1×10-5mol/L的HAS储备液, 储存在冰箱中备用. 其它试剂均为分析纯.
1.2 实验方法
控制温度为290K, 用移液管精密移取3ml 2×10-6mol/L的HSA溶液于比色皿中, 加入5 Lμ的ECHE待测液, 混匀, 反应5min后测定其荧光, 并在同步扫描模式下记录. 然后再通过微量进样器加入5 Lμ的ECHE待测液, 处理同上, 共加入9次的ECHE待测液. 设置激发波长为280nm, 记录发射光谱的扫描范围为200~500nm. 仪器的荧光同步扫描波长差 (λΔ)分别设置15nm和60nm, 扫描范围调整为240~320nm. 用同样的方法扫描在300K, 310K时反应产物的发射光谱及同步荧光, 记录相应的荧光光谱.
2 结果与讨论
2.1 ECHE对HSA 的荧光猝灭光谱
HAS是人血清中最重要的载体蛋白,它的分子中含有三种具有荧光效应的氨基酸残基, 包括色氨酸(Trp), 酪氨酸(Tyr)和苯丙氨酸(Phe). HSA的内源荧光主要是由这三种蛋白引起的, 但由于Phe残基的量子产率很低, Tyr残基易电离或遇到-NH2、-COOH时易猝灭, 因此Trp残基荧光对HSA的内源荧光贡献最大. 由于药物与HSA 结合的时候可以形成无荧光效应的复合物, 因此随着药物的不断加入, HSA分子的荧光能被显著地猝灭. 图2是按1.2节的实验方法测得ECHE对HSA 的荧光猝灭光谱(310K).
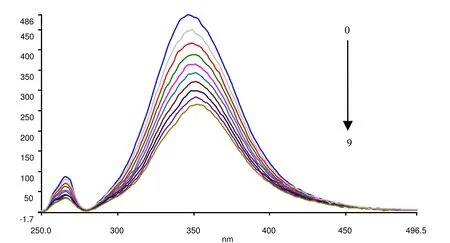
图2 ECHE对HSA 的荧光猝灭光谱(310K)
由图2可见, 随着ECHE浓度的增加, HSA的荧光强度从到486减弱到266, 显示出ECHE对HAS分子的荧光具有强烈的猝灭作用. 随着ECHE浓度的增加, 荧光强度的降低越来越小, 但ECHE不能完全猝灭HSA的荧光, 却使得其荧光发射峰的位置稍稍红移. 由于分子构象与荧光发射峰的性质直接相关, 由此可见, ECHE与HSA的结合影响了HAS的分子构象, 使得HAS的荧光特性发生了相当的改变.
药物对HAS荧光的猝灭可能是动态猝灭, 也可能是静态猝灭. 如果是动态猝灭, 则遵循Stem-volmer方程[7]:

其中Kq为双分子猝灭过程速率常数, τ0为猝灭剂不存在时物质的荧光寿命, 生物大分子的动态猝灭常数最大为2×1010L/mol-1s-1, Ksv为动态猝灭常数, [Q]是ECHE的浓度, F0和F分别为未加ECHE和加入ECHE时HSA的荧光强度. 图3为对[Q]所作的Stem-Volmer曲线, 计算出的直线斜率即为K.
sv
对图3中的三条直线进行拟合, 得到290K, 300K, 310K时的速率常数分别为1.202×1013, 1.015×1013, 1.049×1013, 通过Stern-Volmer方程得出的HSA与ECHE非共价结合的猝灭常数随温度升高呈下降趋势,且远大于生物大分子的最大动态猝灭常数, 这表明ECHE对HSA的猝灭过程不是动态猝灭过程, 而是静态猝灭.
2.2 结合常数和结合位点数的确定
对于静态猝灭过程[8], HAS的荧光激发强度与药物浓度的关系可通过方程式(2)来描述:

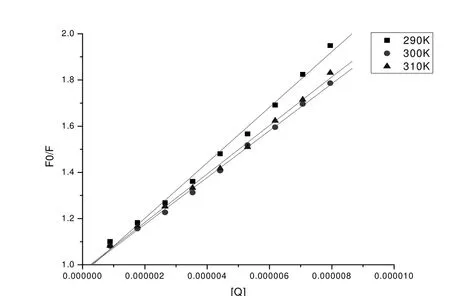
图3 不同温度下ECHE与HSA 相互作用的Stem-Volmer图
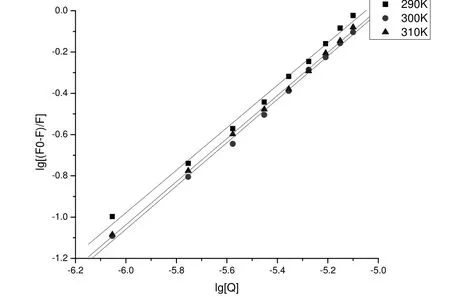
图4 不同温度下ECHE猝灭HSA的双对数方程图
根据图4中三条直线的截距和斜率可以求算不同温度下的K和n值, 见表1. 由表1可以知ECHE与HSA有较强的结合力. 二者结合位点数为1±0.06, 可认为二者之间的结合方式为1:1 结合.

表1 不同温度下ECHE与HSA的结合常数与结合位点数
2.3 ECHE与HSA之间作用力的确定
小分子药物与蛋白的结合可能存在着多种作用力, 如范德华力、疏水作用, 还有静电作用及氢键等等,通过药物—蛋白结合反应的热力学参数可以衡量二者之间的作用力类型. Ross[10]等人根据反应前后热力学熵变ΔS和焓变ΔH的相对大小, 得出了可以判断药物与蛋白质之间的主要作用力类型的热力学规律:当ΔH>0, 且ΔS>0时, 是疏水作用力; 当ΔH<0, 且ΔS>0时, 是静电作用力; 当ΔH<0, 且ΔS<0时, 是范德华力和氢键.
由于本实验所选温度范围在290~310K之间, 这个温差之内的HAS在结构上的改变可完全忽略, 故ΔH 可看作常数, 根据范德霍夫方程


可计算不同温度下药物与HSA结合的ΔH与ΔS. 其中K1、K2分别为T1、T2下对应的结合常数. 结果见表2.
由表2中数据可以看出ECHE与HSA之间的作用力主要为静电作用力, 反应过程是一个放热的过程, 温度的升高不利于反应的进行.ΔG<0说明ECHE与HSA的结合反应是自发的.
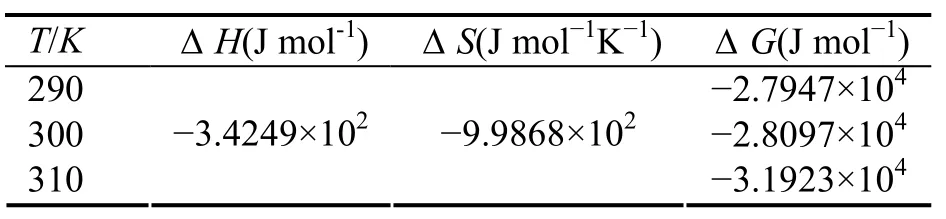
表2 ECHE与HSA相互作用的热力学参数
2.4 同步荧光测定药物ECHE构象的影响
HAS周围环境的极性变化对其荧光效应影响很大, 通常若色氨酸残基附近的极性增大, 则HSA的疏水性降低, 蛋白的结构就变得疏松, 导致荧光发射光谱红移; 如果残基所处环境的极性降低, 则荧光效应相反. 因此环境的极性变化会影响蛋白质的构象, 并直接体现在HAS残基的最大发射波长的变化. 当选择波长差Δλ=15nm 时, 测得的是Try残基的荧光光谱, 而选择波长差Δλ=60nm 时只表现色Trp的光谱特征. 由图5(A)、图5(B)可以看出, 由于ECHE与HSA分子的作用, Trp残基和Tyr残基所处的环境疏水性降低, 这可能是ECHE分子中的苯环插入到了HAS的疏水性空腔中, 使得HSA链有所伸展所致.
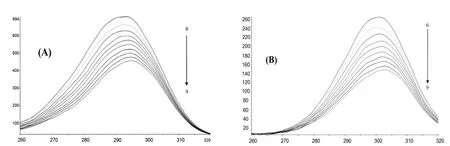
图5 ECHE猝灭HSA的同步荧光光谱λΔ=60nm(A), λΔ=15nm(B)
3 结论
考察了三个温度下ECHE与HSA相互作用方式, 利用荧光光谱得到了ECHE与人血清白蛋白的结合常数()Ka, 分别为1.595×105L·mol-1(290K), 1.718×105L·mol-1(300K), 1.680 ×105L·mol-1(310K), 结合位点数()n是1±0.06; 二者靠静电作用力结合; 反应的GΔ<0, 说明结合过程是自发的. 实验证明, ECHE与HSA结合生成了无荧光效应的基态复合物, 导致了HSA内源荧光的猝灭, 该猝灭属于静态猝灭. 同步荧光结果表示, ECHE与HSA降低了HSA中Trp残基周围环境的极性, 增强了疏水性, 使其蛋白结构就变得疏松. 随着ECHE浓度的增大, HAS中肽链的伸展程度也增大. 本研究为ECHE的药理研究提供了可靠的实验依据.
[1] 刘素彦, 祝仕清, 牛长群. LC-MS法测定犬血浆中白屈菜红碱的浓度[J]. 中国临床药学杂志, 2006, 15(6): 377~379
[2] 宗永立, 刘艳平. 白屈菜红碱诱导细胞凋亡的机理综述[J]. 时珍国医国药, 2006, 17(10): 2068~2071
[3] 宗永立, 刘艳平. 白屈菜红碱对人胃癌BGC823细胞的增殖抑制和凋亡诱导作用[J]. 中草药, 2006, 36(7): 1054~1056
[4] John T. Fong, Wutigri Nimlamool, Matthias M. Falk. EGF induces efficient Cx43 gap junction endocytosis in mouse embryonic stem cell colonies via phosphorylation of Ser262, Ser279/282, and Ser368[J]. FEBS Letters, 2014, 588(5): 836~844
[5] 郭 明, 何 玲, 鲁小旺. 5-羟甲基糠醛与不同血清白蛋白的结合反应机制研究[J]. 药学学报, 2012, 47 (3): 385~392
[6] Savina A A,Tolkachev O N, Sheichenko V I. Disproportionation of the alkaloid sanguinarine on silica gel[J]. Pharmaceutical Chemistry Journal, 1999, 33(4): 196~199
[7] F Martín, L Mora, ML Laorden and MV Milanés. Protein kinase C phosphorylates the cAMP response element binding protein in the hypothalamic paraventricular nucleus during morphine withdrawal [J]. BRITISH JOURNAL OF PHARMACOLOGY, 2011, 163(4): 857~875
[8] 刘雪雪. 光谱法研究小分子与核酸的相互作用及同时测定酚类物质[D]. 郑州: 郑州大学硕士学位论文, 2013
[9] Zhang Q Z. Study of interaction between the nucleobase-modified nucleoside and serum albumin[D].Xinxiang: HenanNormal University, 2008(in Chinese).
[10] Ni Yongnian, Lin Daiqin, Serge K. Synchronous Fluorescence and UV-vis Spectrometric Study of the Compitive Interaction of Chlorpromazine Hydrochloride and Neutral Redwith DNA Using Chemometrics Approaches [J]. Talanta, 2005, 65: 1295~1302
The Interaction of Human Serum Albumin with Ethoxychelerythine
PAN Xian-liang1,2, ZHONG Ming2, FENG Wu-qun3
(1.Yueyang Xinhuada Pharmaceuticals Ltd. Yueyang, 414000, China 2. College of Chemistry and Chemical Engineering, Hunan Institute of Science and Technology, Yueyang, 414006, China 3. Hunan Traditional Chinese Medical College, Zhuzhou412012, China)
Fluorescence spectrophotometry was employed to investigate the interaction of human serum albumin (HSA) with ethoxysaguinarine (ECHE). According to Lineweaver-Burk equation and thermodynamic equation, the binding constants and binding sites at different temperatures for the interaction of HSA with ethoxysaguinarine were obtained. The binding constants at three temperatures were 1.595×105Lmol-1(290K), 1.718×105L·mol-1(300K) and 1.680×105L·mol-1(310K) respectively. The binding-site was about 1±0.06. The intermolecular forces between them were electrostatic forces. It was shown that ECHE quenches the fluorescence of HAS by forming the ECHE-BSA complex. The quenching mechanism in the experiment was mainly attributed to static quenching.
ethoxysanguinarine; human serum albumin; fluorescence quenching
O561.3; O629.7
A
1672-5298(2015)03-0069-04
2015-07-02
国家自然科学基金项目(21276071); 湖南省科技计划项目(2013FJ3007); 湖南省教育厅高校创新平台开放基金项目(2015); 岳阳市产学研结合创新平台立项建设科技攻关项目(2013)
潘先良(1966- ), 男, 湖南岳阳人, 岳阳新华达制药有限公司研发中心工程师. 主要研究方向: 新产品开发
钟 明(1966- ), 男, 湖南岳阳人, 湖南理工学院化学化工学院教授. 主要研究方向: 天然产物

