高浓度尿素诱导人脑微血管内皮细胞系产生炎性因子
王 琦,王弘凯,刘丽君,何 菲,汪克建,李晋芳,冉建华*
(重庆医科大学:1基础医学院 解剖学教研室;2神经科学研究中心;3附属第二医院 神经内科 重庆400016)
高浓度尿素诱导人脑微血管内皮细胞系产生炎性因子
王 琦1,2,王弘凯1,2,刘丽君1,2,何 菲1,2,汪克建1,李晋芳3,冉建华1,2*
(重庆医科大学:1基础医学院 解剖学教研室;2神经科学研究中心;3附属第二医院 神经内科 重庆400016)
目的研究高浓度尿素诱导人脑微血管内皮细胞系(HBMECs)产生炎性因子及其机制。方法以相同渗透压的甘露醇为对照,高浓度尿素(25 mmol/L)干预 HBMECs 3、6、12和24 h后,免疫荧光法观察细胞内肿瘤坏死因子α(TNF-α)和诱导型一氧化氮合酶(iNOS)的表达。蛋白免疫印迹法(Western blot)检测TNF-α、iNOS、环氧合酶- 2(cycloxygenase- 2,COX- 2)、核因子κB(NF-κB) /P65和p-P65的表达水平。一氧化氮(NO)试剂盒检测细胞NO含量。结果高浓度尿素增强细胞内TNF-α和iNOS表达。细胞 TNF-α、COX- 2 和p-P65蛋白水平在3和6 h明显高于对照组(P<0.01);iNOS蛋白水平持续增高(P<0.01)。NO含量在3 h明显增多(P<0.05)。结论高浓度尿素诱导人脑微血管内皮细胞产生炎性因子。
尿素;人脑微血管内皮细胞;肿瘤坏死因子α;一氧化氮;核因子-κB
尿毒症性脑病是尿毒症最常见的并发症之一,表现以抑郁为主的神经精神症状,其病理机制复杂,可能与血液内尿素及胍类等毒性物质蓄积和体内外活性氧(reactive oxygen species,ROS)增加导致的血脑屏障(blood-brain barrier, BBB)结构及功能损伤有关,但尚缺乏分子机制的研究[1]。高浓度尿素是重要的致病因素,其可诱导动物体内外ROS大量产生,导致慢性肾衰竭、氧化应激、胰岛素抵抗和动脉粥样硬化等多种病理改变[2- 3]。本研究组曾报道,尿素通道蛋白敲除小鼠海马中高浓度尿素与其抑郁样行为密切相关,并伴随着ROS水平增加[4],提示高浓度尿素刺激产生的ROS可能在尿毒症性脑病发病过程中具有重要作用。氧化应激和神经炎性反应所引起的神经血管功能失调及BBB高通透性是抑郁发病的病理基础[5]。本实验拟研究高浓度尿素对脑血管内皮细胞炎性因子的表达及相关机制,为揭示尿毒症性脑病的病理机制提供实验依据。
1 材料与方法
1.1 材料
人脑微血管内皮细胞系(human brain microvascular endothelial cells,HBMECs)(ScienCell公司)。主要试剂:RPMI 1640培养基和胰蛋白酶(Gibco公司);胎牛血清(Hyclone公司);二甲基亚砜、甘露醇和尿素(Sigma公司);BCA 蛋白浓度测定试剂盒(Thermo公司);PVDF 膜(Milipore公司);COX- 2、iNOS、NF-κB/p65、p-P65 抗体(CST公司);第8因子抗体(FVIII)、TNF-α抗体、β-actin 抗体(Santa公司);CCK- 8 检测试剂盒(Dojindo公司);NO测试盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 细胞系的培养: HBMECs 置于含10%胎牛血清和1%双抗(青霉素和链霉素)的 RPMI 1640细胞培养基中,在37 ℃和5% CO2恒温箱内培养。细胞正常状态下每2天换液1次,待细胞增殖至70%~80%汇合后,用0.25%胰蛋白酶消化传代。
1.2.2 实验分组: 高浓度尿素(25 mmol/L)刺激组、甘露醇相同渗透压对照组,每组又分为不同时间(3、6、12和24 h)干预组(n=3)。
1.2.3 细胞免疫荧光技术检测 FVIII/TNF-α/iNOS: 细胞完成相应处理后,用4%多聚甲醛室温固定,0.3% T riton X- 100打孔,然后10%山羊血清室温封闭30 min。再加相应稀释浓度的一抗(对照组用 PBS 代替),4 ℃ 孵育过夜。次日 PBS 洗涤3× 10 min,按稀释浓度1∶200滴加相应的荧光二抗,注意避光。Hochest 染核后 PBS 充分洗涤,用防猝灭封片剂封片,在荧光显微镜下拍照。
1.2.4 细胞活力检测: 取增殖状态良好的人脑微血管内皮细胞,用0.25%胰蛋白酶消化后,细胞计数获得约为4×104个/mL 细胞悬液,接种于96孔板,每孔加入含10%胎牛血清的 RPMI 1640培养液0.1 mL,置于37 ℃,5% CO2细胞恒温箱中孵育24 h。然后弃掉旧的培养液,按实验分组加入不同浓度(0、1.56、6.25、25、100和400 mmol/L)的尿素,每种浓度设置3个复孔,并设空白对照,放入培养箱中孵育24 h。然后向每孔中加入10 μL CCK- 8溶液(注意避免生成气泡),在培养箱中孵育1 h 后,用酶标仪测定在450 nm处测每孔的吸光度值。
1.2.5 Western blot对TNF-α、COX- 2、iNOS、NF-κB/P65和p-P65蛋白的检测: HBMECs 经不同时间点高浓度尿素和甘露醇刺激后,提取细胞总蛋白。按 Western blot 相应步骤检测细胞中TNF-α、COX- 2、iNOS、NF-κB/P65和p-P65 蛋白的变化。
1.2.6 NO含量测定: 取不同时间尿素和甘露醇刺激的各组细胞培养液,按NO检测盒说明书操作,采用酶标仪检测550 nm处每孔的吸光度值,根据公式计算NO含量。
1.3 统计学分析
2 结果
2.1 人脑微血管内皮细胞的鉴定
脑血管内皮细胞活性好,细胞呈梭形或多角形,胞核清晰,胞质丰富。实验组胞质中FVIII呈红色荧光的阳性表达,PBS对照组无荧光呈阴性表达(图1,2)。
图1 倒置显微镜下正常的人脑微血管内皮细胞Fig 1 Normal human brain microvascular endothelial cells in inverted microscope(×100)
2.2 不同浓度尿素对细胞活力的影响
400 mmol/L尿素可明显抑制人脑微血管内皮细胞增殖(P<0.05),对细胞有毒性作用(图3)。
2.3高浓度尿素刺激对人脑微血管内皮细胞中TNF-α和iNOS表达的影响
25 mmol/L尿素刺激3 h后,实验组细胞中TNF-α及iNOS的绿色荧光阳性表达明显强于对照组(图4)。
2.4高浓度尿素刺激对人脑微血管内皮细胞中炎性因子TNF-α、COX-2及iNOS的影响
与对照组相比,25 mmol/L尿素刺激3及6 h组细胞中TNF-α和COX- 2 蛋白表达水平明显增加(P<0.01);高浓度尿素刺激组细胞中iNOS的表达水平在各个时间点(3、6、12和24 h)较对照组均增高(P<0.01)(图5,表1)。
2.5高浓度尿素对人脑微血管内皮细胞中NF-κB/P65通路的影响
25 mmol/L尿素刺激组细胞中p-P65蛋白表达水平在3及6 h较对照组明显增加(P<0.001)(图6)。
2.6 高浓度尿素不同时间刺激对细胞NO影响
25 mmol/L尿素刺激3 h细胞NO产量较对照组明显增多(P<0.05)(图7)。
3 讨论
脑血管内皮细胞是BBB的重要组成部分,参与维持脑组织内环境的稳定,内皮细胞的炎性反应是多种神经精神疾病的关键病理环节[6]。研究高浓度尿素是否诱导内皮细胞的炎性反应可为探讨尿毒症性脑病的病理机制提供基础。
在抑郁症等多种神经精神疾病中,前炎性因子TNF-α通过诱导细胞骨架重排和黏附因子产生等破坏内皮的屏障功能[7]。激活的小胶质细胞可促进COX- 2的高表达,进而诱导iNOS表达而增加iNO的合成,iNO与O2-结合形成ONOO-可损伤血管内皮细胞并破坏BBB的完整性[7- 8]。TNF-α可诱导iNOS的表达上调或活性增加,导致iNO产量增加而加重内皮的损伤[9]。本研究采用25 mmol/L尿素(人体正常尿素浓度约为5 mmol/L,尿毒症患者体内尿素浓度20~80 mmol/L[2])刺激人脑微血管内皮细胞发现,细胞中炎性因子TNF-α、COX- 2和iNOS蛋白表达上调,提示炎性反应的发生;TNF-α和COX- 2在3、6 h均较对照组明显升高,而12和24 h无明显差异,这可能与后期抗炎分子的抑制作用有关;细胞中iNOS蛋白表达水平受TNF-α及COX- 2的调节而持续升高。P65是NF-κB家族中具有转录激活结构域的重要成员之一,脂多糖等外源性刺激信号可通过磷酸化P65调控TNF-α及iNOS的表达[10]。脑血管内皮细胞中p-P65表达水平上调,提示NF-κB信号通路参与了尿素刺激内皮细胞分泌炎性因子的过程。
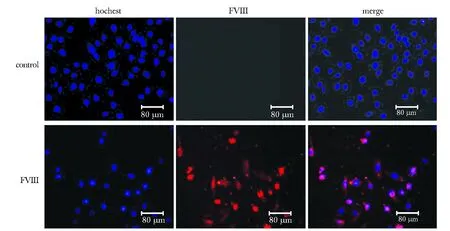
Immunofluorescence showed FVIII (red, Cy3-labeled) localized in HBMECs, with cell nuclei stained (blue, Hochest stain)
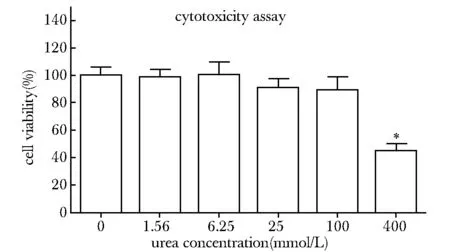
HBMECs viability detected by CCK- 8; *P<0.05 compared with 0图3 不同浓度的尿素对人脑微血管内皮细胞活力的影响Fig 3 Effects of different concentrations of urea on HBMECs viability(n=3)
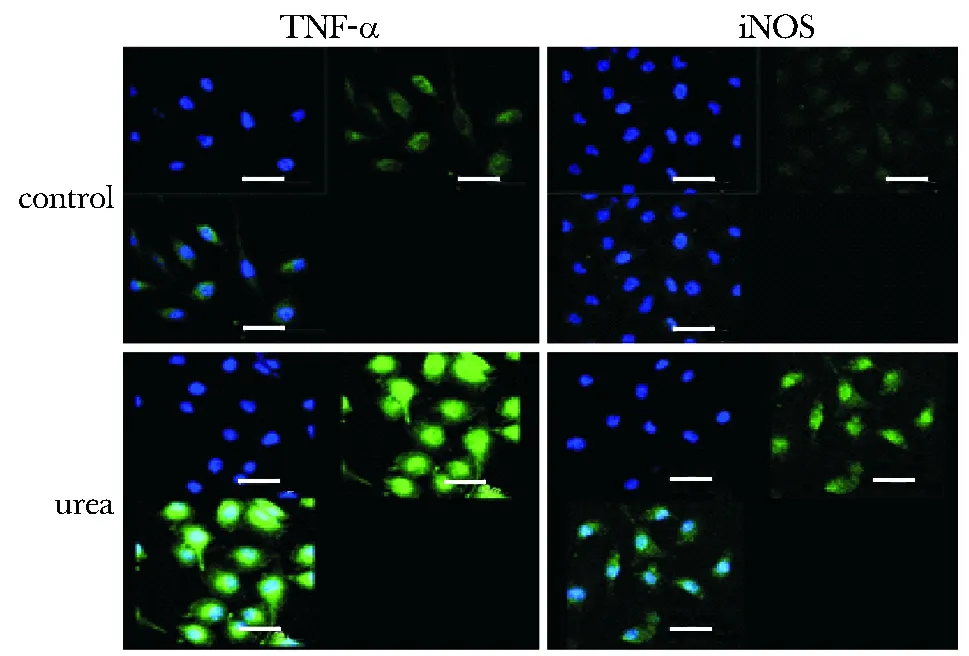
Immunofluorescence showed TNF-α and iNOS(green, FITC-labeled) localized in HBMECs, with cell nuclei stained (blue, Hochest stain)图4 高浓度尿素刺激对人脑微血管内皮细胞中TNF-α、iNOS表达的影响Fig 4 Effects of 25 mmol/L concentrations of urea on TNF-α(left) and iNOS(right) expression in HBMECs(scale bar, 100 μm)
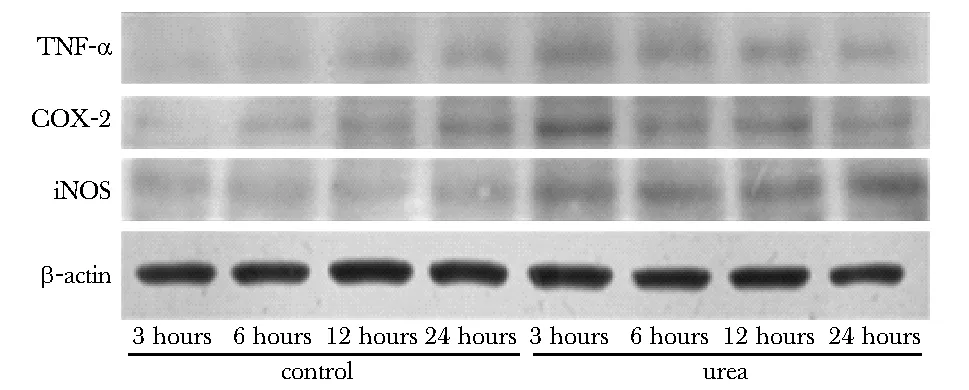
Western blot analysis for TNF-α, COX- 2 and iNOS protein expression was performed图5 高浓度尿素刺激对人脑微血管内皮细胞中TNF-α、COX- 2 及iNOS蛋白表达的影响Fig 5 Effects of 25 mmol/L concentrations of urea on TNF-α, COX- 2 and iNOS protein expression in HBMECs
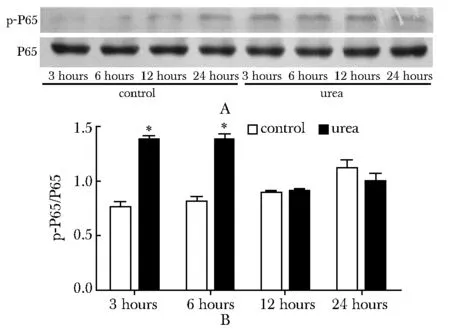
Western blot analysis for P65 and p-P65 protein expression was performed; A.graph showed the representative films; Bar graph B.showed the density ratio between P65 and p-P65; *P<0.001 compared with control group (mannitol)图6 高浓度尿素刺激对人脑微血管内皮细胞中P65、p-P65 蛋白表达的影响Fig 6 Effects of 25 mmol/L concentrations of urea on P65 and p-P65 protein expression in HBMECs(n=3)
表1 不同时间高浓度尿素刺激人脑微血管内皮细胞对炎性因子蛋白表达的影响
*P<0.01,**P<0.001 compared with control group.
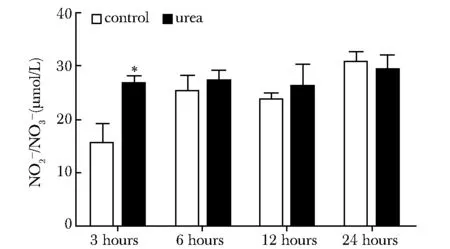
NO concentration in supernatant of HBMECs culture was determined by a commercial NO assay kit; *P<0.05 compared with control group图7 高浓度尿素刺激对人脑微血管内皮细胞中NO含量的影响Fig 7 Effects of 25 mmol/L concentrations of urea on NO content in HBMECs(n=3)
iNOS的诱导性表达可加重多种病理因素引发的神经功能损伤[8]。本研究中高浓度尿素刺激组细胞总NO水平在3h升高可能与iNOS的高表达相关,而3 h后NO水平的变化可能与eNOS表达下调导致eNO水平降低有关(结果未显示)。研究发现,ROS能诱导eNOS解偶联,降低eNO的合成,并与内皮细胞功能紊乱、血管氧化应激和炎性反应有关[11]。因此,尿素刺激可能通过诱导iNOS的大量产生和eNOS的解偶联,导致iNO增加和eNO减少来共同加重血管内皮细胞结构和功能的损害。
综上所述,高浓度尿素经NF-κB信号通路引起脑血管内皮细胞中炎性因子TNF-α、COX- 2和iNOS表达水平上调;iNOS的诱导性表达增加脑血管内皮细胞中iNO的含量,通过损伤BBB而引发后续病理过程。而尿素对星形胶质细胞等其他血-脑脊液屏障结构的影响还有待进一步研究。
[1] Liu M, Liang Y, Chigurupati S,etal. Acute kidney injury leads to inflammation and functional changes in the brain [J]. J Am Soc Nephrol, 2008,19: 1360- 1370.
[2] Zhang Z, Dmitrieva NI, Park JH,etal. High urea and NaCl carbonylate proteins in renal cells in culture andinvivoand high urea causes 8-oxoguanine lesions in their DNA [J]. PNAS,2004, 101: 9491- 9496.
[3] Supachai T, Joan DF, Jinxi L,etal. High NaCl-and urea-induced posttranslational modifications that increase glycerophosphocholine by inhibiting GDPD5 phosphodiesterase [J]. PNAS,2013, 110:7482- 7487.
[4] Li X, Ran JH, Zhou H,etal. Mice lacking urea transporter UT-B display depression-like behavior[J]. J Mol Neurosci,2012, 46:362- 72.
[5] Souhel N, Daniel MP, Orrin D,etal. Neurovascular unit dysfunction with blood-brain barrier hyperpermeability contributes to major depressive disorder: a review of clinical and experimental evidence [J]. J Neuroinflammation, 2013, 10:142- 143.
[6] Doughs BC, Heanor S, Pollak,etal. Endothellan cells in physiology and in the pathophysiology of vascular disorders [J]. Blood, 1998, 91:3527- 3561.
[7] Pun PB, Lu J. Moochhala S: Involvement of ROS in BBB dysfunction [J]. Free Radic Res, 2009, 43:348- 364.
[8] Stuehr DJ, Santolini J, Wang ZQ,etal. Update on mechanism and catalytic regulation in the NO synthases [J]. J Biol Chem, 2004, 279:36167- 36170.
[9] Chuang YC. Mitochondrial dysfunction and oxidative stress in seizureinduced neuronal cell death [J]. Acta Neurol Taiwan, 2010, 19:3- 15.
[10] Matsuda N,Hattori Y. Systemic inflammatory response syndrome(SIRS):molecular pathophysiology and gene therapy[J]. J Pharmacol Sci, 2006, 10l:189- 198.
[11] Danielle LM, Karen LA. Endothelial dysfunction in hypertension: The role of arginase [J]. Bioscience, 2011, S3: 946- 960.
High concentrations of urea induce human brain microvascular endothelial cell line to produce inflammatory cytokines
WANG Qi1,2, WANG Hong-kai1,2, LIU Li-jun1,2, HE Fei1,2, WANG Ke-jian1, LI Jin-fang3, RAN Jian-hua1,2*
(1.Dept. of Anatomy, College of Medicine; 2.Neuroscience Research Center; 3.Dept. of Neurology, the Second Affiliated Hospital, Chongqing Medical University, Chongqing 400016,China)
ObjectiveTo explore high concentrations of urea-induced human brain microvascular endothelial cell line(HBMECs) to produce inflammatory cytokines and possible mechanism.MethodsHBMECs were incubated in high concentrations of urea or mannitol(as osmotic control) for 3,6,12 and 24 hours. Expression of TNF-α and iNOS was observed by immunofluorescence. Western blot analysis was employed to assess the protein expressions of TNF-α, iNOS, COX- 2, NF-κB/P65 and p-P65. NO concentration was determined by a commercial NO assay kit.ResultsImmunofluorescence showed high positive immunostaining of TNF-α and iNOS after incubation in high concentration of urea stimulued as compared with control group.The protein expressions of TNF-α, COX- 2 and p-P65 were significantly increased at 3 and 6 hours after high urea treatment (P<0.01), and iNOS was continued to increase from 3 to 24 hours (P<0.01).Moreover, NO content was increased at 3 hours after high urea treatment (P<0.05).ConclusionsHigh concentration of urea can induce HBMECs to produce inflammatory cytokines.
urea; human brain microvascular endothelial cells; TNF-α;NO;NF-κB
2014- 09- 01
:2014- 10- 23
国家自然科学基金(30500171);重庆市教委项目(KJ120330,KJ120314);重庆市卫生局项目(2012- 1- 038);重庆市渝中区科委项目(20120202);重庆市科委项目(stc2011 JJA10030);重庆医科大学大学生科学研究与创新实验项目(201403);国家(市)级大学生创新创业训练计划项目(201410631003)
*通信作者(correspondingauthor):1315038024@qq.com
1001-6325(2015)02-0152-05
研究论文
R 364.5
:A

