葡萄糖6磷酸异构酶和烯醇化酶1可预测人类精子冷冻复苏后活力*
蒋旭平 王尚乾 王 巍 徐 杨 汤井源 徐 震 周伟民 张 炜**.南京医科大学第一附属医院泌尿外科(南京 20029);2.宜兴市人民医院泌尿外科
葡萄糖6磷酸异构酶和烯醇化酶1可预测人类精子冷冻复苏后活力*
蒋旭平1,2王尚乾1王 巍1徐 杨1汤井源1徐 震1周伟民2**张 炜1**
1.南京医科大学第一附属医院泌尿外科(南京 210029);2.宜兴市人民医院泌尿外科
目的 比较葡萄糖6磷酸异构酶(GPI)和烯醇化酶1(ENO1)在人类精子中不同耐冻能力组之间表达的差异,寻找预测人类精子冻融后活力可能的标志物。方法 收集42例合格供精志愿者的新鲜精液样品,依据冻融后精子活力的不同,将符合条件的样品分为耐冻组和不耐冻组,应用蛋白质印迹(Western blot)技术比较两组样品GPI和ENO1蛋白在表达量上的差异,利用免疫荧光技术验证Western blot结果并观察两种蛋白在精子中的分布。结果 在两组样品之间,GPI和ENO1都表现出明显的差异。GPI和ENO1在耐冻组的表达量均高于不耐冻组(分别为P<0.01,P<0.05),而蛋白在精子中的分布未见明显组间差异。结论 GPI和ENO1可以作为标志物在冻存前预测人类精子冷冻复苏后的活力。
精液保存; 葡糖-6-磷酸异构酶; 磷酸丙酮酸水合酶
**共同通讯作者: 周伟民, E-mail: staff551@yxph.com; 张炜, E-mail: zhangwei@medmail.com.cn受能力的强弱还不能被成功预测,因此,精子库的每个捐精志愿者需要先经过评估,合格捐精者的首要条件是精子质量正常和冻存后精子质量下降较少,并且冻融后的精子活力达到40%。如果寻找到精子耐冻性的标志物,捐精的过程将可以变得简化而高效,减少不必要的资源浪费。为此,已有很多研究者致力于寻找在冻存前预测精子耐冻能力的标志物。
精子成熟度被认为是精子抵抗冷冻损伤的主要因素,但研究证明其在预测冻融后精子活力方面并没有很大价值,而精子密度和正常形态率具有相对较好的预测作用[6,7]。精子活力是指精子向卵子的运动能力,包括线性和环绕运动,不论运动的速度[8],这种形式的活力是决定精子授精成功率最重要的因素之一[9]。在精子冷冻领域,精子活力也被考虑为精子耐冻性可能的标志物。有研究报道,能够预测精子冷冻成功性的一个指标是精子在离体后1h具有较高的活力(≥55%)并且大部分精子能够前向运动[10]。
男科学领域中,蛋白组学技术得到广泛应用,在寻找男性不育的标志物方面取得了一定的进展[11,12]。蛋白组学技术同样被应用于动物研究中,并且已经寻找到一些蛋白可以作为预测冻融后精子活力的标志物,如顶体素结合蛋白(ACRBP)、磷酸丙糖异构酶(TPI)[13]和热休克蛋白AA1 (HSP90AA1)[14]等。这些结果提示我们可以通过对冷冻前的人类精子样品进行特定蛋白的测定,以寻找精子耐冻能力的标志物。
GPI和ENO1与精子活力有一定的相关性[15,16],因此我们选取这两个蛋白作为研究对象,寻找精子耐冻性可能的标志物。在这项实验中,我们用蛋白质印迹(Western blot)技术比较耐冻组和不耐冻组中这两种蛋白表达的差异,并用免疫荧光辅助验证。
资料与方法
一、研究对象
本研究通过了南京医科大学伦理委员会的批准并按照国家和国际准则执行。研究中的42例供精志愿者均来自南京医科大学第一附属医院人类精子库,为同批初筛者。42例志愿者的年龄为20~33周岁,平均年龄23.1周岁。所有供精者都签署了知情同意书。按照要求,供精者在禁欲3~5d后通过手淫方式收集精液。样品均按照第四版世界卫生组织(WHO)人类精液检查和处理实验室手册中的实验流程,在精子库内接受临床和实验评估。我们用WLJY-9000型伟力彩色精子质量检测系统测定精子密度及活力,精液合格的标准为精液量>2mL;液化时间<1h;精子密度>20×106/mL;活力[(a级+b级)精子比率]>60%;正常形态>5%。液化的精液样品与冻存保护剂混合后冻存7d,再进行下一步的研究。按照冻融后活力>40%的标准,新鲜精子样品被分为耐冻组(活力>40%)和不耐冻组(活力≤40%)。
二、材料
超声波破碎仪(Model 300,美国Fisher Scienti c公司);电泳仪及凝胶成像系统(美国Bio-Rad公司);荧光显微镜(LSM 710,德国Carl Zeiss公司);冷冻管(德国Greiner Bio-One公司);BWW液购于美国GenMed Scientifics公司;1%蛋白酶抑制剂购于美国Thermo Scientific公司;聚偏二氟乙烯(PVDF)膜购于美国GE Healthcare公司;兔抗人GPI多克隆抗体购于美国Abgent公司;兔抗人ENO1多克隆抗体、小鼠抗人β-actin单克隆抗体购于美国Abcam公司;免疫荧光小鼠抗人GPI单克隆抗体购于美国Santa Cruz公司;免疫荧光二抗购于美国Jackson公司。
三、精子冷冻和复苏
每份新鲜精液样品被分为3份,第一份进行常规冷冻复苏过程,第二份用于精子蛋白的提取行Western blot检测,第三份用于免疫荧光染色。我们将第一份的精子样品与等量的10%甘油-卵黄冷冻液混合,然后将混合液转移到冷冻管中并存入程序化冷冻室使温度从20℃降到-80℃。随后冷冻管被转移到-196℃的液氮中保存7d。最后,精子样品被置于恒温器中37℃水浴7 min进行复苏。
四、精子蛋白的提取
第二份的新鲜精子样品完全液化后加入60% Percoll溶液洗涤,800 ×g,离心7 min,弃上清液,收集沉淀精子;BWW液洗涤2次,加入适量裂解液和1%蛋白酶抑制剂提取精子蛋白。精子用超声波粉碎仪降解,20焦耳,2s×10次,间隔15s。样品置于冰盒中1h并且每15min涡旋一次。然后样品置于4℃,20 000×g,低温离心1h去除杂质,蛋白浓度用染色法测定。所有样品被转移到冻存管保存于-196℃的液氮中。
五、Western blot检测
按每孔50 μg 蛋白上样,10%聚丙烯酰胺凝胶(SDS-PAGE)120 V电压下分离,再用30 V电压将凝胶上的蛋白湿转至PVDF膜上。用5%脱脂牛奶封闭2h,裁剪目的蛋白条带后加入对应的一抗(兔抗人GPI多克隆抗体,1:200稀释;兔抗人ENO1多克隆抗体,1:1000稀释;小鼠抗人β-actin单克隆抗体,1:10 000稀释。其中β-actin被用作内参),4℃孵育过夜。TBST洗膜3×10min,然后用辣根过氧化物酶标记的二抗(羊抗兔IgG或羊抗小鼠IgG,1:2000稀释)孵育1h。TBST洗膜3次,最后用ChemiDoc XRS+成像系统曝光显影,所得图像均用Image Lab 软件分析灰度值。
六、免疫荧光染色
第三份精子样品加入PBS 300 ×g,离心5min后重悬,重复3次。接种于多聚赖氨酸处理后的无菌载玻片上,晾干后用4%多聚甲醛室温固定1h,PBS洗涤3次。0.5% Triton X-100处理15min,洗涤后用1%牛血清室温封闭2h,加入一抗(小鼠抗人GPI单克隆抗体,1:100稀释;兔抗人ENO1多克隆抗体,1:200稀释),4℃孵育过夜。PBS洗涤后加入二抗,室温孵育1h。PBS洗涤4次,每次5min。荧光封片剂封片,避光4℃保存,荧光显微镜下观察。
七、统计学分析
使用SPSS17.0统计软件进行统计分析。所得数据均以均数±标准差标示,检验前均进行方差齐性和正态分布检验,均数间的比较采用独立样本 t 检验,P<0.05视为差异具有统计学意义。
结 果
一、精子样品的分组及参数分析
42份合格的样品根据冻融后精子的活力和密度,27份样品被归类为耐冻组,另外15份归为不耐冻组。冻融前两组精子样品的各项参数均没有明显差异(包括精液量、液化时间、精子密度、活力和正常形态率等)(表1)。冻融后,两组间的活力差异具统计学意义(P<0.01),而精子密度、正常形态率等没有明显差异(图1-3)。
表1 冷冻前和冷冻后两组精子参数比较()
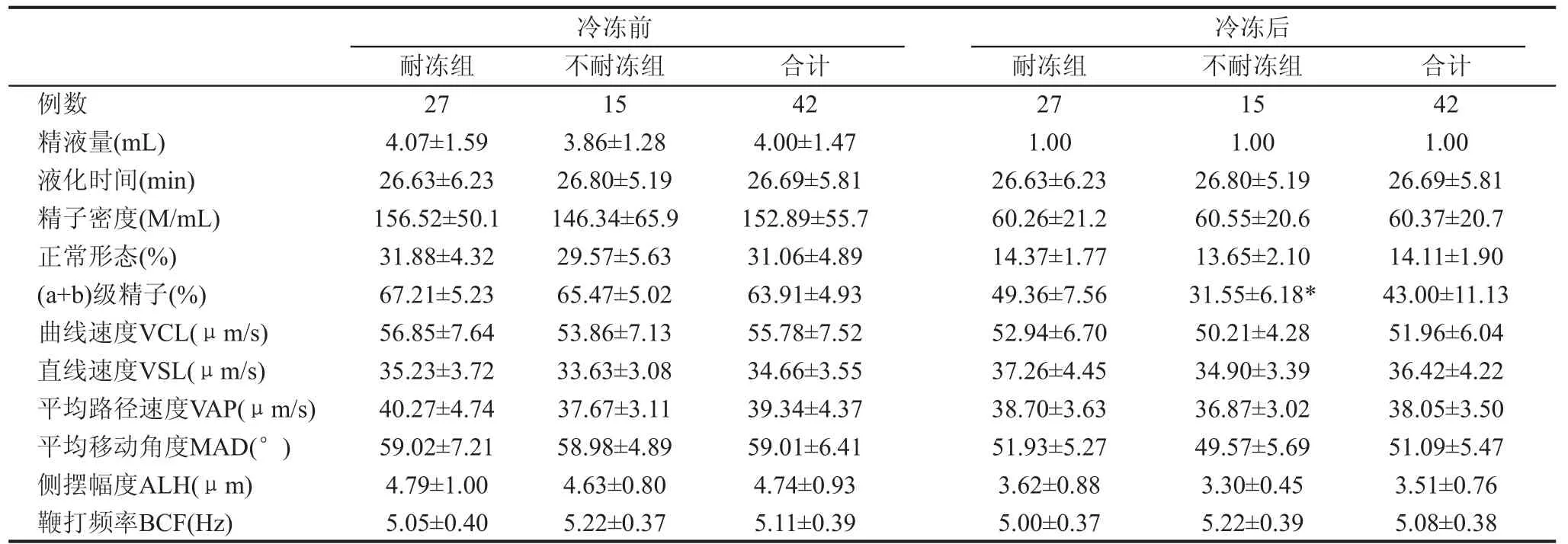
表1 冷冻前和冷冻后两组精子参数比较()
与耐冻组比较, * P为<0.01
冷冻前 冷冻后耐冻组__________不耐冻组______ ______合计 耐冻组 不耐冻组 合计例数 27 15 42 27 15 42精液量(mL) 4.07±1.59 3.86±1.28 4.00±1.47 1.00 1.00 1.00液化时间(min) 26.63±6.23 26.80±5.19 26.69±5.81 26.63±6.23 26.80±5.19 26.69±5.81精子密度(M/mL) 156.52±50.1 146.34±65.9 152.89±55.7 60.26±21.2 60.55±20.6 60.37±20.7正常形态(%) 31.88±4.32 29.57±5.63 31.06±4.89 14.37±1.77 13.65±2.10 14.11±1.90 (a+b)级精子(%) 67.21±5.23 65.47±5.02 63.91±4.93 49.36±7.56 31.55±6.18* 43.00±11.13曲线速度VCL(μm/s) 56.85±7.64 53.86±7.13 55.78±7.52 52.94±6.70 50.21±4.28 51.96±6.04直线速度VSL(μm/s) 35.23±3.72 33.63±3.08 34.66±3.55 37.26±4.45 34.90±3.39 36.42±4.22平均路径速度VAP(μm/s) 40.27±4.74 37.67±3.11 39.34±4.37 38.70±3.63 36.87±3.02 38.05±3.50平均移动角度MAD(°) 59.02±7.21 58.98±4.89 59.01±6.41 51.93±5.27 49.57±5.69 51.09±5.47侧摆幅度ALH(μm) 4.79±1.00 4.63±0.80 4.74±0.93 3.62±0.88 3.30±0.45 3.51±0.76 __鞭打频率BCF(Hz) 5.05±0.40_________5.22±0.37__________5.11±0.39_________ ______________________________________________ 5.00±0.37__5.22±0.39__5.08±0.38

图1 冻融前后两组精子密度的比较冷冻前和复苏后, 两组间精子密度均没有差异, 但冻融明显降低了各组的精子密度, **P<0.01

图2 冻融前后两组精子正常形态率的比较冷冻前和复苏后,两组间精子正常形态率均没有差异, 但冻融明显降低了各组的精子正常形态率, ** P<0.01
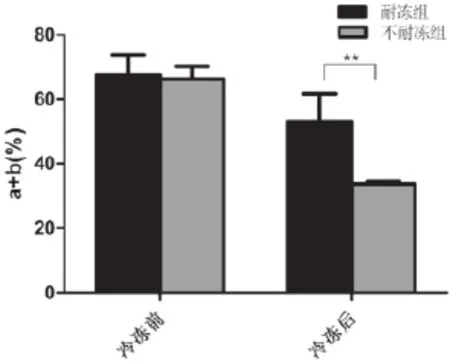
图3 冻融前后两组精子活力的比较** P<0.01
二、Western印迹结果
两个目的蛋白的分析均以β-actin为内参。GPI 和ENO1的标准化蛋白量在耐冻组和不耐冻组间有明显的差异,两者在耐冻组的表达均明显高于不耐冻组(GPI和ENO1分别为P<0.01,P<0.05)(图4,图5)。

图4 Western blot 检测GPI及ENO1蛋白的表达

图5 两组精子GPI及ENO1蛋白表达量的比较*P<0.05, **P<0.01
以冻融后精子的活力作为评估精子耐冻性的指标,我们发现精子耐冻性和GPI的标准化蛋白量存在明显正相关(r = 0.959;P<0.01);与ENO1的标准化蛋白量同样呈正相关性(r = 0.926;P<0.01)。
三、免疫荧光结果
结果显示两种蛋白在精子中具有不同的位置分布。根据免疫荧光,我们发现GPI主要定位于精子的尾部中段,即线粒体所在部位,而且在耐冻组中的表达量明显高于不耐冻组;ENO1定位于精子尾部的中段和主段,其表达量在耐冻组也明显高于不耐冻组(图6)。免疫荧光结果证实了Western blot分析的正确性。
讨 论
人类精子冷冻技术已有70多年的历史,是将精子于-196℃或以下低温保存的一种技术。在此温度下,所有生命活动理论上都会停止,包括一些导致细胞死亡的生物化学活动。这为一些生殖系统有缺陷者、接受放化疗者、少精和弱精者等提供了生育的机会。但是冷冻复苏过程会对精子的DNA完整性、精子的活力和存活率等产生影响[3,4],从而降低精子的生育力。很多研究者致力于寻找预测精子对抗冻存损伤能力的方法,并已取得一定的成果。本研究的主要目的是从蛋白方面寻找人类精子耐冻性可能的生物标志物。
我们根据冻融后精子的活力将新鲜精液中提取的蛋白样品分为耐冻组和不耐冻组,对两组样品进行蛋白分析,检测GPI和ENO1在两组间表达的差异。Western blot技术显示GPI和ENO1在耐冻组的表达均明显高于不耐冻组,免疫荧光分析得到了相同结果,说明这两种蛋白可以作为精子耐冻性的指标。以Western blot分析中的标准化蛋白量和精子耐冻性为参数做皮尔森相关性分析,结果显示GPI和ENO1的表达量与精子耐冻性均存在正相关关系,说明了这两种蛋白作为精子耐冻能力标志物的可靠性。
GPI是指葡萄糖6磷酸异构酶,又名磷酸己糖异构酶,是一种广泛存在的胞质酶,在糖酵解和糖异生途径中起关键作用,催化6磷酸果糖和6磷酸葡萄糖的相互转化[17],同时还具有其他重要的生理生化功能[18]。一些具有抗精子发生作用的化合物能抑制精子活力,并且降低睾丸中和精子中GPI的活性[16,19],提示GPI活性与精子活力可能存在一定相关性。在哺乳动物的精子中,GPI是一种松散地结合于线粒体的可溶性酶[20],很容易从精子中流失[21,22]。当经历冷冻过程或处于低渗透压的应激条件下,精子会释放大量的GPI到胞外培养液中[23],这可能是冻存对精子产生损伤的机制之一,最终导致精子活力降低。我们的结果显示,耐冻组和不耐冻组的精子在冷冻前具有不同的GPI表达量,说明GPI是影响精子冻融后活力的一个重要因素,可以作为预测精子耐冻性的良好指标。

图6 免疫荧光检测GPI及ENO1蛋白的表达A,B分别为GPI在耐冻组和不耐冻组的免疫荧光成像;D,E分别为ENO1在耐冻组和不耐冻组的免疫荧光成像;C,F为阴性对照
ENO1即烯醇化酶1,也被称为磷酸丙酮酸水合酶,是在哺乳动物中发现的3种烯醇化酶之一。它是糖酵解过程的中的一个关键酶,能够催化2-磷酸甘油酸转化为磷酸烯醇式丙酮酸[24]。在机体中,ENO1具有多种生物学功能,如促进肌生长、调控细胞凋亡以及肿瘤发生、调控纤溶活性等[25]。在成熟精子中,ENO1表达于精子的尾部,它通过调节酶的活性在微管中产生能量并可以保护精子免受氧化应激损伤[15],在精子成熟的过程中,它还参与蛋白的转录后修饰[26]。Park等通过比较高生育率和低生育率公牛精子的蛋白表达,发现ENO1可能是精子生育力的一个理想标志物[27]。在我们的研究中,ENO1在耐冻组中的表达量明显高于不耐冻组,而且,其表达量与精子耐冻性呈明显的正相关性。这些结果提示,ENO1也可以作为精子耐冻性的理想标志物。
不管使用何种技术,冷冻复苏都会对精子产生一定的损害。为了使冻存对精子质量的损伤最小化,我们需要做更多的研究来提高冻存技术。同时,我们可以寻找精子耐冻性的标志物,优化精子冻存的过程。在本研究中,我们分析冻存前精子的GPI和ENO1蛋白含量,证明了在未受冷冻影响的情况下,精子之间就存在GPI和ENO1表达量的差异,说明我们可以通过检测这两种蛋白来预测精子对冷冻损伤的抵抗能力。综上所述,GPI和ENO1可以作为预测人类精子冻融后活力的标志物。
1 张静雯, 马文敏, 赵军, 等. 自精保存在辅助生殖技术中的应用与意义. 中国妇幼保健 2014; 29(12): 1885-1888
2 朱晓斌, 冯云, 吴铃, 等. 自精保存在辅助生殖技术中的意义: 附74例分析. 中国优生与遗传杂志 2012; 20(3): 118-119
3 Donnelly ET, Mcclure N, Lewis SE. Cryopreservation of human semen and prepared sperm: effects on motility parameters and DNA integrity. Fertil Steril 2001; 76(5): 892-900
4 Darvishnia H, Lakpour N, Lahijani M S, et al. Effects of very rapid versus vapor phase freezing on human sperm parameters. Cell Tissue Bank 2013; 14(4): 679-685
5 马春杰, 文任乾, 唐运革, 等. 冷冻保存对人精子运动特征的影响. 中国男科学杂志 2008; 22(12): 19-21
6 Yogev L, Kleiman SE, Hauser R, et al. Assessing the predictive value of hyaluronan binding ability for the freezability potential of human sperm. Fertil Steril 2010;93(1): 154-158
7 张欣宗, 熊承良. 精子浓度及活力对精子冷冻复苏率的影响. 中国男科学杂志 2013; 27(5): 45-47, 53
8 World Health Organization, Department of Reproductive Health and Research. WHO laboratory manual for the examination and processing of human semen. (Fifth edition). http://www.who.int/reproductivehealth/ publications/infertility/9789241547789/en/[Z]. 2014: 2014
9 Donnelly ET, Lewis SE, Mcnally JA, et al. In vitro fertilization and pregnancy rates: the in uence of sperm motility and morphology on IVF outcome. Fertil Steril 1998; 70(2): 305-314
10 Yavetz H, Yogev L, Homonnai Z, et al. Prerequisites for successful human sperm cryobanking: sperm quality and prefreezing holding time. Fertil Steril 1991; 55(4): 812-816
11 de Mateo S, Martinez-Heredia J, Estanyol J M, et al. Marked correlations in protein expression identi ed by proteomic analysis of human spermatozoa. Proteomics 2007; 7(23): 4264-4277
12 Martinez-Heredia J, de Mateo S, Vidal-Taboada J M, et al. Identi cation of proteomic differences in asthenozoospermic sperm samples. Hum Reprod 2008; 23(4): 783-791
13 Vilagran I, Castillo J, Bonet S, et al. Acrosin-binding protein (ACRBP) and triosephosphate isomerase (TPI)are good markers to predict boar sperm freezing capacity. Theriogenology 2013; 80(5): 443-450
14 Casas I, Sancho S, Ballester J, et al. The HSP90AA1 sperm content and the prediction of the boar ejaculate freezability. Theriogenology 2010; 74(6): 940-950
15 Gitlits VM, Toh BH, Loveland KL, et al. The glycolytic enzyme enolase is present in sperm tail and displays nucleotide-dependent association with microtubules. Eur J Cell Biol 2000; 79(2): 104-111
16 Kanwar U, Chadha S, Batla A, et al. Effect of selected metal ions on the motility and carbohydrate metabolism of ejaculated human spermatozoa. Indian J Physiol Pharmacol 1988; 32(3): 195-201
17 Harrison RA. The detection of hexokinase, glucosephosphate isomerase and phosphoglucomutase activities in polyacrylamide gels after electrophoresis: a novel method using immobilized glucose 6-phosphate dehydrogenase. Anal Biochem 1974; 61(2): 500-507
18 韩龙, 杜翠红. 葡萄糖-6-磷酸异构酶研究进展. 药物生物技术 2012; 19(6): 561-564
19 Ranga A, Kalla NR, Kanwar U. Effect of gossypol on the fertility of male rats. Acta Eur Fertil 1990; 21(1): 7-15
20 Sidhu KS, Guraya SS. Glycolytic, Krebs cycle and pentose phosphate cycle enzymes in spermatozoa of the buffalo (Bubalus bubalis). J Reprod Fertil 1979; 57(1): 205-208
21 Harrison RA. Glycolytic enzymes in mammalian spermatozoa. Activities and stabilities of hexokinase and phosphofructokinase in various fractions from sperm homogenates. Biochem J 1971; 124(4): 741-750
22 Storey BT, Kayne FJ. Energy metabolism of spermatozoa. V. The Embden-Myerhof pathway of glycolysis: activities of pathway enzymes in hypotonically treated rabbit epididymal spermatozoa. Fertil Steril 1975; 26(12): 1257-1265
23 Harrison RA, White IG. Glycolytic enzymes in the spermatozoa and cytoplasmic droplets of bull, boar and ram, and their leakage afte shock. J Reprod Fertil 1972;30(1): 105-115
24 Babbitt PC, Hasson MS, Wedekind JE, et al. The enolase superfamily: a general strategy for enzyme-catalyzed abstraction of the alpha-protons of carboxylic acids. Biochemistry 1996; 35(51): 16489-16501
25 姜冬梅, 康波, 马容, 等. 烯醇化酶1的生物学功能. 动物营养学报 2014; 26(1): 69-73
26 Baker MA, Witherdin R, Hetherington L, et al. Identi cation of post-translational modifications that occur during sperm maturation using difference in two-dimensional gel electrophoresis. Proteomics 2005; 5(4): 1003-1012
27 Park YJ, Kwon WS, Oh SA, et al. Fertility-related proteomic profiling bull spermatozoa separated by percoll. J Proteome Res 2012; 11(8): 4162-4168
(2015-03-24收稿)
Glucose-6-phosphate isomerase (GPI) and Enolase1 (ENO1)predict the motility of cryopreserved spermatozoa*
Jiang Xuping1,2, Wang Shangqian1, Wang Wei1, Xu Yang1,Tang Jingyuan1, Xu Zhen1, Zhou Weimin2**, Zhang Wei1**
1.Department of Urology, the First Af liated Hospital of Nanjing Medical University, Nanjing, 210029, China;
2.Department of Urology, Yixing People's Hospital
Zhou Weimin, E-mail: staff551@yxph.com; Zhang Wei, E-mail: zhangwei@medmail.com.cn
Objective To explore the probable biomarker of human sperm to predict the motility of cryopreserved spermatozoa. Methods 42 semen samples from 42 donors satisfied the minimal values of sperm quality before cryopreservation and were divided into good freezability ejaculates and poor freezability ejaculates according to progressive motility of the sperm after thawing. The level of glucose-6-phosphate isomerase (GPI) and enolase1 (ENO1) in semen samples from each group before cryopreservation were comparatively analyzed by western blot. Immunofluorescence staining was also performed for validation and distribution of GPI and ENO1. Results Levels of GPI (P<0.01) and ENO1 (P<0.05) in semen samples were both signi cantly higher in GFE than that in PFE. There was no difference in location of the two proteins in sperm between two groups. Conclusion GPI and ENO1 can be used as markers to predict sperm freezability before starting the cryopreservation procedure.
semen preservation; glucose-6-phosphate isomerase; phosphopyruvate hydratase
10.3969/j.issn.1008-0848.2015.08.006
R 321.1
精子冷冻是保持精子无限期存活并保存男性生育力的一项技术,被广泛应用于人类辅助生殖。这对于一些不能生育的病人非常重要,如需要接受放疗和化疗的癌症病人、生殖器有缺陷的病人和少精、弱精的病人等[1,2]。但是,冷冻复苏过程会对精子的功能和生育能力产生影响[3-5]。迄今为止,精子对冷冻耐
资助: 国家自然科学基金面上项目(81370781)

