牛磺熊去氧胆酸减轻TGF-β1诱导的MRC- 5纤维化表型
朱锦东,杜涧超,李 宁,蒋澄宇
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 生物化学与分子生物学系, 北京 100005)
研究论文
牛磺熊去氧胆酸减轻TGF-β1诱导的MRC- 5纤维化表型
朱锦东,杜涧超,李 宁,蒋澄宇*
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 生物化学与分子生物学系, 北京 100005)
目的研究牛磺熊去氧胆酸(TUDCA)对肺纤维化防治作用。方法建立转化生长因子-β1(TGF-β1)诱导的人胚肺成纤维细胞(MRC- 5)肺纤维化细胞模型。用MTS法测定TUDCA的安全实验剂量后,用实时定量-PCR和Western blot检测α-平滑肌动蛋白(α-SMA)和纤连蛋白的mRNA和蛋白表达。 结果1)TUDCA对MRC- 5细胞无明显细胞毒作用。2)TUDCA显著缓解TGF-β1诱导的α-SMA和纤连蛋白的表达。结论TUDCA可以缓解TGF-β1诱导的肺纤维化表型。
牛磺熊去氧胆酸;肺纤维化;转化生长因子β1
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是以进行性呼吸困难及肺功能下降为主要临床表现的慢性弥漫性肺间质病[1]。IPF患者确诊后5年生存率仅为20%~40%[2- 3],而目前尚无有效的IPF防治药物,亟待新类抗肺纤维化药物应对IPF的临床需求。
转化生长因子(transforming growth factor,TGF)-β1在肺纤维化进程中起关键性作用, 抑制TGF-β1表达如氯喹(chloroquine,CQ),或阻断其下游信号通路可有效缓解肺纤维化[4- 5]。近年研究发现,IPF患者肺泡上皮细胞内质网应激(ER stress)明显增加, 表明内质网应激在IPF进程中发挥重要作用[6]。牛磺熊去氧胆酸 (tauroursodeoxycholic acid,TUDCA)作为内质网应激抑制剂,可以改善内质网应激参与的多种病理过程[7- 8]。本研究拟通过TGF-β1诱导的肺纤维化细胞模型来探讨内质网应激抑制剂TUDCA是否具有抗肺纤维化的作用。
1 材料与方法
1.1 材料
人胚肺成纤维细胞(human fetal lung fibroblast,MRC- 5)(协和细胞资源中心);MEM/EBSS培养基(HyClone公司);胎牛血清(Gibco公司);TUDCA和氯喹(Sigma-Aldrich公司);细胞增殖与毒性检测试剂盒(MTS,Cell titer 96 Aqueous One Solution,Cell Proliferation Assay,Promega公司);TGF-β1(PeproTech公司);ABI High-Capacity cDNA Reverse Transcription Kits 和Trizol(Invitrogen公司);SYBR Green Master Mix(Roche公司);抗α-平滑肌动蛋白小鼠单克隆抗体和抗纤连蛋白小鼠单克隆抗体(Abcam公司);抗GAPDH小鼠单克隆抗体(联科生物公司)等。
1.2 方法
1.2.1 细胞培养及分组:MRC- 5细胞在含有10% FBS、1×105U/L青霉素和100 g/L链霉素的MEM/EBSS培养基中,于37 ℃、5% CO2培养箱中培养。采用3 μg/L TGF-β1诱导的MRC- 5细胞作为肺纤维化细胞模型。CQ干预肺纤维化细胞模型建立:分别在加入TGF-β1前1 h及后6 h加入CQ(3、10和30 μmol/L),并于TGF-β1处理后24和48 h时分别收取RNA及蛋白样本。TUDCA干预肺纤维化模型建立:分别在加入TGF-β1前12、1 h和后3 h及后6 h加入TUDCA(100、300和1 000 μmol/L),并于TGF-β1处理后48 h收取RNA和蛋白样本。
1.2.2 TUDCA对MRC- 5细胞毒性检测:将培养的MRC- 5细胞用培养基重悬成单细胞溶液,并以每孔100 μL体积、1×108个/L细胞种于96孔板,继续于37 ℃、5% CO2培养箱中培养。在检测TUDCA对MRC- 5细胞的毒性时,向96孔板中分别加入100、300、1 000及3 000 μmol/L的TUDCA,对照用同样体积的PBS替代。给药后60 h进行MTS检测:分别向上述预防给药组细胞和治疗给药组细胞中加入20 μL MTS试剂,在37 ℃孵育1~2 h后,在490 nm下检测吸光度值。
1.2.3 实时定量PCR: 弃除细胞培养基,用1 mL PBS漂洗两次后加入1 mL Trizol,吹打混匀,移至1.5 mL离心管中。每管加入200 μL三氯甲烷,充分振荡,室温静置5 min后,4 ℃、12 000 r/min离心10 min。吸取上层液体500 μL移至新的离心管,加入400 μL预冷异丙醇,颠倒混匀。-20 ℃放置20 min后,4 ℃、12 000 r/min离心10 min。弃上清,用75%乙醇洗涤沉淀后将RNA溶于11 μL的Nuclease-free水中。调RNA浓度至150 mg/L后以20 μL体系做反转录(ABI公司High-Capacity cDNA Reverse Transcription Kits),按说明书操作获得cDNA。采用实时定量PCR检测肌成纤维细胞标志物α-平滑肌动蛋白(α-SMA)和纤连蛋白的mRNA表达量(以GAPDH为内参)。所用引物:α-SMA 正向引物:5′-TTCCAGCCATCCTTCATC-3′,α-SMA反向引物:5′-ATTGTTAGCATAGAGGTCCTT-3′; 纤连蛋白正向引物:5′-TGCTCAACAGACAACCAA-3′, 纤连蛋白反向引物:5′-CACCAGGACAGTAGAATCAG-3′;GAPDH 正向引物:5′-CGGAGTAACGGATTTGG TC-3′,GAPDH 反向引物:5′-TGGGTGGAATCATATT GGAACAT-3′,用2-ΔΔCt来计算结果,目的基因与内参的比值来表示目的基因的相对表达水平。
1.2.4 Western blot:弃培养基,加入1 mL PBS 漂洗两次后,加入75 μL RIPA裂解细胞,4 ℃、12 000 r/min离心10 min后取上清,BCA法测蛋白浓度。取10 μg蛋白样本进行8% SDS-PAGE电泳。通过Image J软件分析条带密度,并以目的蛋白/内参蛋白的比值代表该目的蛋白的相对表达水平。
1.3 统计学分析
2 结果
2.1 氯喹(CQ)对肺纤维化表型的影响
在TGF-β1造模后24 h,不同浓度的CQ对纤维化标志物α-SMA和纤连蛋白的抑制作用较弱;在TGF-β1造模后48 h,10与30 μmol/L CQ组均对TGF-β1诱导的α-SMA和纤连蛋白上调的纤维化表型有明显的预防(-1 h)(P<0.01)和治疗(6 h)(P<0.05)效果,以30 μmol/L CQ预防(-1 h)效果最优(P<0.01)(图1)。
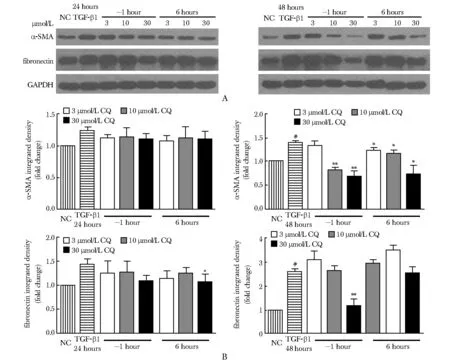
A.Western blot results; B.statistical analysis of Western blot results; NC.negative control;#P<0.01 compared with NC;*P<0.05,**P<0.01 compared with TGF-β1
图1 氯喹(CQ)干预TGF-β1诱导的MRC- 5肺纤维化细胞模型中α-SMA 和纤连蛋白表达
Fig 1 Effect of chloroquine (CQ) on the protein expression of α-SMA and fibronectin in TGF-β1-induced MRC- 5 pulmonary fibrosis cells
2.2 TUDCA对MRC- 5细胞毒性检测
TUDCA仅在3 000 μmol/L时对MRC- 5细胞有明显的细胞毒作用(P<0.01),细胞存活率低于对照组50%(图2)。

*P<0.01 compared with NC图2 MTS检测TUDCA对MRC- 5的细胞毒作用Fig 2 Cytotoxicity of TUDCA on MRC- 5 by MTS
2.3 TUDCA对肺纤维化表型的影响
与TGF-β1组相比,100、300与1 000 μmol/L TUDCA对TGF-β1引起的MRC- 5细胞α-SMA mRNA高表达均有明显的预防(-12 h,-1 h)与治疗(3 h,6 h)作用(P<0.01),以1 000 μmol/L TUDCA的治疗效果最为显著(P<0.01)(图3)。与TGF-β1处理组相比,100与300 μmol/L TUDCA对TGF-β1引起的纤连蛋白 mRNA高表达均没有明显的预防(-12 h,-1 h)与治疗(3 h,6 h)作用,而1 000 μmol/L TUDCA对TGF-β1引起的纤连蛋白mRNA高表达在晚期预防(-1 h)与治疗(3 h,6 h)中抑制作用显著(P<0.01)(图4)。1 000 μmol/L TUDCA对TGF-β1引起的MRC- 5细胞α-SMA及纤连蛋白高表达有明显的预防(-12 h,-1 h)与治疗(3 h,6 h)作用(图5)。

#P<0.01 compared with NC; *P<0.01 compared with TGF-β1图3 TUDCA干预TGF-β1诱导的MRC- 5肺纤维化细胞模型中α-SMA mRNA的表达Fig 3 Effect of TUDCA on α-SMA mRNA expression in TGF-β1-induced MRC- 5 pulmonary fibrosis cells

#P<0.01 compared with NC;*P<0.05, **P<0.01 compared with TGF-β1图4 TUDCA干预TGF-β1诱导的MRC- 5肺纤维化细胞模型中纤连蛋白 mRNA的表达Fig 4 Effect of TUDCA on fibronectin mRNA expression in TGF-β1-induced MRC- 5 pulmonary fibrosis cells

A.Western blot results; B.statistical analysis of Western blot results; #P<0.01 compared with NC; *P<0.05,**P<0.01 compared with TGF-β1
3 讨论
IPF的病因及发病机制尚不明确,随着病情的发展,呼吸困难等症状进行性加重,严重影响患者的生活质量。目前中国IPF发病率逐年上升,并因其进展快、预后差,致死性极高,患者平均寿命为诊断后的3~5年。IPF临床治疗手段匮乏,尚无预防方法或除肺移植以外的国际公认的有效治疗方法。随着对IPF发病机制的深入解析,临床上急需从各个病理生理环节干预IPF的防治药物。除了pirfenidone和nintedanib可以延缓IPF进程外,更期待可以弥补临床上逆转肺纤维化药物的空白。近年研究发现内质网应激参与IPF的进程,IPF患者肺泡上皮细胞内质网应激明显增强。而TUDCA作为内质网应激的抑制剂早已在临床上用于治疗肝胆系统及2型糖尿病等多种疾病。本研究发现,TUDCA还可以对TGF-β1导致的MRC- 5细胞纤维化标志物α-SMA和纤连蛋白的mRNA和蛋白高表达有明显预防和治疗作用,提示TUDCA具有潜在的抗肺纤维化的药物应用价值。内质网应激如何介导IPF,TUDCA是否通过调节内质网应激发挥抗肺纤维化的作用机制仍需更多体内、外实验验证。因TUDCA已在临床应用数年,临床用药安全性好,不良反应少,其对肺纤维化的防治作用值得进一步深入探讨及临床推广应用。
[1] Tzouvelekis A, Bonella F, Spagnolo P. Update on therapeutic management of idiopathic pulmonary fibrosis[J]. Ther Clin Risk Manag, 2015, 11:359- 370.
[2] Kim H, Perlman D, Tomic R. Natural history of idiopathic pulmonary fibrosis[J]. Respir Med, 2015, doi:10.1016/j.rmed.2015.02.002.
[3] Loveman E, Copley V, Colquitt J,etal. The clinical effectiveness and cost-effectiveness of treatments for idiopathic pulmonary fibrosis: a systematic review and economic evaluation[J]. Health Technol Assess, 2015, 19:1- 336.
[4] Ahn J, Park S, Yun Y,etal. Inhibition of type Ⅲ TGF-beta receptor aggravates lung fibrotic process[J]. Biomed Pharmacother, 2010, 64:472- 476.
[5] Perkett E, Ornatowski W, Poschet J,etal. Chloroquine normalizes aberrant transforming growth factor beta activity in cystic fibrosis bronchial epithelial cells[J]. Pediatr Pulmonol, 2006, 41:771- 778.
[6] Tanjore H, Blackwell T, Lawson W. Emerging evidence for endoplasmic reticulum stress in the pathogenesis of idiopathic pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302:L721- 729.
[7] Malo A, Krüger B, Seyhun E,etal. Tauroursodeoxycholic acid reduces endoplasmic reticulum stress, trypsin activation, and acinar cell apoptosis while increasing secretion in rat pancreatic acini[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299: G877- 886.
[8] Lee Y, Hong S, Lee Y. Tauroursodeoxycholate (TUDCA), chemical chaperone, enhances function of islets by reducing ER stress[J]. Biochem Biophys Res Commun, 2010, 397:735- 739.
Tauroursodeoxycholic acid alleviates TGF-β1-induced pulmonary fibrosis phenotype in MRC- 5 cells
ZHU Jin-dong, DU Jian-chao, LI Ning, JIANG Cheng-yu*
(Dept. of Biochemistry and Molecular Biology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences &School of Basic Medicine Peking Union Medical College, Beijing 100005, China)
Objective To investigate the prophylactic and therapeutic effects of tauroursodeoxycholic acid (TUDCA) on transforming growth factor-β1 (TGF-β1)-induced fibrosis in MRC- 5 cells. Methods Establish TGF-β1-induced MRC- 5 pulmonary fibrosis model. Determine cytotoxicity of TUDCA on MRC- 5 cells by MTS. Real-time PCR and Western Blot were applied to quantify the expression of fibrosis biomarker α-SMA and fibronectin. Results 1) TUDCA was well tolerated by MRC- 5 cells. 2) TUDCA significantly alleviates the expression of α-SMA and fibronectin induced by TGF-β1 in MRC- 5 cells. Conclusions TUDCA alleviates TGF-β1-induced pulmonary fibrotic phenotype of MRC- 5 cells.
tauroursodeoxycholic acid; pulmonary fibrosis; TGF-β1
2015- 02- 02
2015- 04- 14
公益性行业科研专项(201302017);协和青年基金资助及中央高校基本科研业务费专项资金(3332013132)
1001-6325(2015)06-0767-05
R34
A
*通信作者(corresponding author):chengyujiang@gmail.com

