不同LED光源对碧玉兰组培苗淀粉含量的影响
王亚沉 王玉英 徐诗涛 李枝林
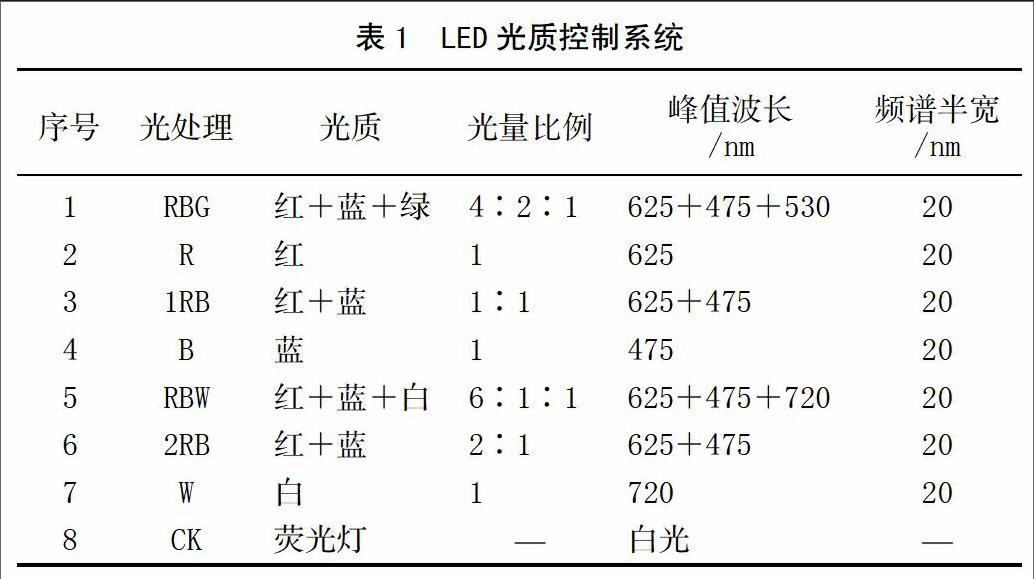
摘 要 采用LED光源单色红光、蓝光、绿光及白光不同光质配比7种组合处理,以荧光灯为对照,研究其对野生碧玉兰组培苗叶片淀粉含量的影响。结果表明:在红蓝绿复合光(RBG)下,组培苗的淀粉含量最高,为9.977 8 mg/g,极显著高于荧光灯处理。在单色蓝光(B)下,组培苗的淀粉含量最低,为3.684 5 mg/g,极显著低于荧光灯(CK)和单色红光(R)处理,说明蓝光会明显抑制碧玉兰组培苗的淀粉合成。因此,在碧玉兰组培苗培育过程中,利用LED红蓝绿复合光源(RBG)取代传统的荧光灯光源是值得推荐的。
关键词 LED光源 ;碧玉兰 ;组培苗 ;淀粉含量
分类号 S682. 31
Abstract The seven kinds of light qualities were designed with red LED, blue LED, green LED and white LED. The study on amylum content of C. lowianum plantlets under the seven treatments, compared to fluorescent lamp. As the results showed that: amylum content of the plantlets is the highest under red-blue-green LED light (RBG), which is 9.9778 mg/g, significantly utmost higher than other processing. Amylum contents of the plantlets is the lowest under monochromatic blue light (B), which is 3.6845 mg/g, significantly utmost lower than fluorescent lamp (CK) and monochromatic red light(R), blue LED light restrains contents of amylum obviously. Therefore, in the process of cultivating C. lowianum plantlets,it is recommended that the red-blue-green LED light (RBG) source replace the traditional fluorescent light source.
Keyworlds light-emitting diode source ; Cymbidium lowianum ; tissue culture ; amylum content
碧玉兰(Cymbidium lowianum)为兰科兰属多年生草本植物,亚热带兰,附生与地生中间类型,生于海拔1 300~1 900 m山地林中树上或溪谷岩壁上,属于国家二级濒危植物[1-2]。碧玉兰花型奇特、花色艳丽、花姿优美,观赏价值很高。且全草入药,用于跌打、骨折、扭伤、外伤出血、筋伤等,但野生自然资源稀缺,分株繁殖速度较慢,繁殖系数低[3]。碧玉兰种子极小,且种子内的胚多半不成熟或发育不完全,没有胚乳,用常规方法播种不能萌发。组织培养是碧玉兰高效繁育的有效方法。
LED(light-emitting diodes),即发光二极管,是一种可以有效地把电能转变成电磁辐射的装置[4]。LED光源能区分出不同的光质,不同的光质对植物生长的影响显著不同[5-7]。国内外已有一些科学家尝试用LED光源作为组织培养光源来提高培养效果[8-10]。光质对植物的生长、形态建成、光合作用以及物质代谢具有调控作用[11]。许多研究表明,植物光合器官的发育长期受光调控,红光对光合器官的正常发育至关重要,它可通过抑制光合产物从叶中输出来增加叶片的淀粉含量[12]。不同光质对组织培养中愈伤组织的增殖、光合速率、植物的形态指标及内含物质等均有不同的影响。最新研究结果表明,光质比例和光照强度可调的LED光源比荧光灯更能有效地促进组培苗的光合作用[13]。
近年来,光质对植物光合作用的影响已引起研究人员的广泛重视,并开展了多方面的研究,取得了大量的试验成果。但采用LED不同光质对碧玉兰组培苗淀粉含量影响研究未见报道。本研究采用LED光源发射的单色光谱红光、蓝光、绿光等,进行不同光质配比组合,以荧光灯为对照,研究不同光质对碧玉兰组培苗淀粉含量的影响,以期为碧玉兰组培苗培育提供一定的理论指导,也为植物组培专用新型LED光源的研发提供理论支持。
1 材料与方法
1.1 材料
试验材料为野生碧玉兰(C. lowianum)组培苗。
1.2 方法
1.2.1 光照处理
选择长势基本一致的组培苗接种到生根培养基中,生根培养基的配方为1/2 MS+NAA 1.5 mg/L+6-BA 0.3 mg/L+20 g/L蔗糖+7.5 g/L琼脂(经前期试验筛选出此较好的生根配方)。预培养7 d后随机分8组,分别置于7种LED光源区和1个荧光灯对照区,LED光质控制系统见表1。调节电流、占空比以及光源与植株的距离,使光强保持一致(800 lx)。培养室的空气相对湿度为(75±5)%,温度(25±2)℃,14 h/d光照周期。培养100 d后测定各处理组培苗的淀粉含量。
1.2.2 淀粉的提取
每个处理取剪碎的组培苗鲜叶片0.5 g,放入大试管中,加入10 mL蒸馏水于沸水浴中加热30 min,不时摇动,冷却后过滤。把残渣放入试管中,加入20 mL蒸馏水,放入沸水浴中煮沸15 min,再加入9.2 mol/L高氯酸2 mL提取15 min,待冷却后摇匀,将提取液过滤转入到25 mL容量瓶中并用蒸馏水定容,此为淀粉样品提取液。每组样品重复3次。
1.2.3 样品的测定
取待测样品提取液与蒽酮试剂混合后,用分光光度计测定各样品吸光度值。空白对照组用蒸馏水代替提取液。
2 结果与分析
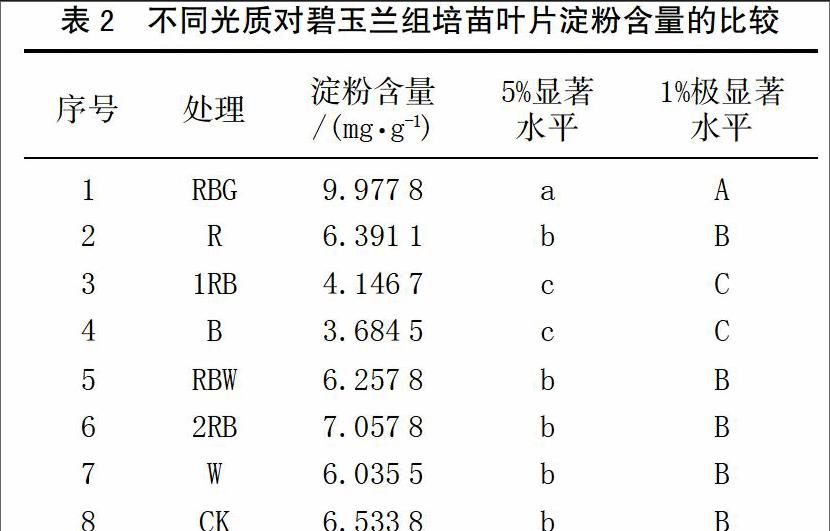
淀粉中的一部分作为叶片光合产物暂时贮于叶绿体中,大部分作为植物永久性贮存物,贮于种子、块茎、块根等器官中。从表2可看出,不同光质对碧玉兰组培苗叶片淀粉含量的影响显著。其中以红蓝绿复合光(RBG)处理的叶片淀粉含量最高,达9.977 8 mg/g,极显著高于其它处理组。单色蓝光(B)处理的叶片淀粉含量最低,为3.684 5 mg/g,极显著低于对照荧光灯(CK)和单色红光(R),说明蓝光抑制淀粉的合成。红蓝复合光(1RB)处理的叶片淀粉含量较低,为4.146 7 mg/g,极显著低于其它处理组。其余各组淀粉含量差别不大。淀粉含量变化规律为:RBG>2RB>CK>R>RBW>W>1RB>B。
3 讨论与结论
已有的研究表明,光质对整株植物的碳水化合物和蛋白质代谢有重要的调节作用,红光促进碳水化合物的积累,而蓝光促进新合成有机物中蛋白质的积累,郑洁[14]和李承志等[15]试验也得出相同的结论。本试验结果发现,单色红光(R)处理的叶片淀粉含量较高,为6.391 1 mg/g,极显著高于单色蓝光(B),说明红光有利于淀粉的合成,这与前人的研究结果相似。
本试验还发现,红蓝绿复合光(RBG)处理的叶片淀粉含量最高,达9.977 8 mg/g;红蓝复合光(2RB)处理的叶片淀粉含量较高,为7.057 8 mg/g,二者均极显著高于单色蓝光(B)处理,说明在红光中补充一定量的蓝光或绿光更有利于淀粉的积累。此外,碧玉兰组培苗叶片的淀粉含量在红蓝复合光(2RB)下极显著高于红蓝复合光(1RB)处理,其原因可能是复合光中较高红光的比例的光质更有利于碧玉兰组培苗淀粉的积累,具体原因和机理有待于进一步探究。
本研究结果表明,在红蓝绿复合光(RBG)下的碧玉兰组培苗淀粉含量最高,极显著高于荧光灯处理。在单色蓝光(B)下的组培苗淀粉含量最低,为 3.684 5 mg/g,极显著低于荧光灯(CK)和单色红光(R)处理,说明蓝光会明显抑制碧玉兰组培苗的淀粉合成。因此在碧玉兰的组培苗培育过程中,利用LED红蓝绿复合光源(RBG)取代传统的荧光灯光源是值得推荐的。
参考文献
[1] 杨 云. 滇兰初鉴[M]. 昆明:云南科技出版社,1992.
[2] 杨静坤,黄丽萍,唐 敏,等. 碧玉兰试管植株辐射诱变初探[J]. 现代园艺,2008(10):6-9.
[3] 陈心启,吉占和,罗毅波. 中国野生兰科植物彩色图鉴[M]. 科学出版社, 1999.
[4] 杨雅婷, 肖 平,胡永连,等. LED在植物组织培养中的应用[J]. 农业工程技术·温室园艺,2009(7):13-14.
[5] Moe R, Morgan L, Grindal G. Growth and plant morphology of Cucumis sativus and Fuchsia hybrid are influenced by light quality during the photoperiod and by temperature alternations[J]. Acta Horticulturae, 2002, 580: 229-234.
[6] Escobar M A, Franklin K A, Svensson A S, et a1. Light regulation of the Arabidopsis respiratory chain multiple discrete photoreceptor responses contribute to induction of type II NAD (P) H dehydrogenase genes[J]. Plant Physiology, 2004, 136: 2 710-2 721.
[7] 诸葛强,关亚丽,施季森,等. 组培新技术及其在桉树快繁中的应用[J]. 林业科技开发,2003,17(6):37-38.
[8] Jao Rueychi,Fang Wei. An adjustable light source for photo-phyto related research and young plant production[J]. Applied Engineering in Agriculture, 2003, 19(5): 601-608.
[9] Jao Rueychi, Lai Chienchou, Fang Wei. Effects of red light on the growth of Zantedeschia plantlets in Vitro and tuber formation using light-emitting diodes[J]. HortSci, 2005, 40(2): 436-438.
[10] Nhut D T, Takamura T, Watanabe H, et a1. In vitro growth of cymbidium plantlets cultured under superbright red and blue light-emitting diodes (LEDs)[J]. horticultural science & biotechnology, 1998, 73: 39-44.
[11] Batschauer A. Photoreceptors of higher plants[J]. Planta,1998,206(4):479-492.
[12] Saebo A, Krekling T,Appelgren M. Light quality affects photosynthesis and leaf anatomy of birch plantlets in vitro[J]. Plant Cell,Tissue andOrgan Culture,1995,41(2):l77-l85.
[13] 岳 岚,张玉芳,何松林,等. 植物组织培养新技术的应用现状与发展趋势[J]. 现代园林,2008(3):48-51.
[14] 郑 洁,胡美君,郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报,2008,19(7):1 619-1 624.
[15] 李承志,廉世勋,张华京,等. 光合仿生农膜的作物栽培试验[J]. 湖南农业科学,2001(5):22-23.

