己醛熏蒸对脐橙果实侵染性病害和生理性病害的影响
赵一洁,王建军,邓丽莉,2,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2. 重庆市特色食品工程技术研究中心,重庆 400715)
己醛熏蒸对脐橙果实侵染性病害和生理性病害的影响
赵一洁1,王建军1,邓丽莉1,2,曾凯芳1,2,*
(1.西南大学食品科学学院,重庆400715;2. 重庆市特色食品工程技术研究中心,重庆400715)
以脐橙为原料,研究了不同剂量的己醛熏蒸对采后脐橙果实常见侵染性病害和生理性病害的影响。果实损伤接种的实验结果表明,与对照组相比,先己醛熏蒸后接种病原菌对脐橙果实采后侵染性病害的控病效果不显著;而先接种病原菌后己醛熏蒸对侵染性病害的控制效果与己醛剂量有关。50、100 μL/L己醛熏蒸能显著降低果实青霉病、绿霉病、炭疽病的发病率和病斑直径,其中100 μL/L的己醛效果最好。同时100 μL/L的己醛也可以显著抑制脐橙果实自然发病率的上升。果实生理性病害的研究表明,低剂量(50、100 μL/L)己醛熏蒸与对照相比差异不显著,而高剂量(150 μL/L)的己醛熏蒸会促进酚类物质的氧化,造成果皮的褐变和塌陷,加重果实生理性病害的发生。
己醛;侵染性病害;生理性病害;贮藏
柑橘是世界上产量最多的水果之一,也是我国最有竞争力的优势农产品。但是在柑橘贮藏的过程中会发生侵染性病害和生理性病害,不仅会损害果实的食用价值,也严重降低果实的经济价值。柑橘果实侵染性病害主要是由病原微生物的侵染引起,常见的有青霉病(Penicillium italicum)、绿霉病(Penicillium digitatum)和炭疽病(Colletotrichum gloeosporides),这几种病害造成的损失约占贮藏期间果实总腐烂率的70%~80%[1-6];而生理性病害主要由 不良贮藏条件引起,主要有褐斑病、油胞病、枯水病,会影响果实的外观形态,其中塌陷指数和变色指数可以很好地反映生理病害的发病情况。同时,生理病害的发生也使果实更容易受到病原菌的侵染。因此在柑橘贮藏过程中控制果实的侵染性病害和生理性病害十分重要[7]。
柑橘采后病害的防治主要有物理防治、生物防治和化学防治。物理方法主要是调节贮藏的环境条件,如湿度、温度、气体组成等[8-12],但成本一般过高[13-14]。生物方法方面利用拮抗微生物控制采后病害逐渐成为近几年的热点。目前主要的拮抗微生物有:细菌、酵母和小型丝状真菌[15-19],但是生物方法的效果受多方面的因素限制,且商业化应用不够成熟[20]。化学方法作为目前最主要的病害控制方法,具有高效、迅速、经济、方便使用等优点[21-23],但随着化学杀菌剂的长期大量使用,病原菌产生抗药性,同时也造成果实农残超标、环境污染等问题[24-27]。因此,研究新型、安全的化学抑菌剂是十分有必要的。
科研人员已经寻找了许多代替化学杀菌剂来控制不同果蔬采后腐烂的方法,例如热处理、臭氧处理、电晕放电、高CO2处理、伽玛射线、生物防治剂[28-33]。使用具有生物活性的自然挥发物控制真菌生长也引起了研究人员的兴趣,若干可以减少采后果蔬腐烂的挥发物已有报道,如乙醛、乙酸、(E)2-己烯醛、茉莉酸甲酯[34-36]。研究发现己醛对革兰氏阳性菌和革兰氏阴性菌都有较强的抑制作用[37]。而且亚致死剂量己醛能够显著改变4 种病原细菌细胞膜及其挥发性物质的组成。还有研究发现12.5 μL/L的己醛熏蒸24 h可有效抑制苹果青霉菌(Penicillium expansum),并降低苹果和梨中棒曲霉素含量。也有研究发现己醛对大豆病原真菌刺盘孢(Colletotrichum truncatum)、立枯丝核菌(Rhizoctonia solani)和齐整小核菌(Sclerotium rolfsii)的生长有抑制作用[38]。Song等[39]研究发现己醛熏蒸对真菌病原体灰霉病、褐腐病菌、油菜菌核病菌、链格孢和炭疽病菌具有抑制效果。Fan等[40]发现经40 μmol/L的己醛熏蒸24 h可减少94%扩展青霉的孢子活力。己醛已经通过美国食品和药物管理局批准作为食品添加剂使用[41],但是己醛熏蒸对不同种类果蔬贮藏品质的影响有较大差异,较大用量的己醛熏蒸会造成果实的植物毒性症状,引起果实的生理性病害。
本实验主要研究了己醛熏蒸对脐橙贮藏期常见侵染性病害和生理性病害的控制效果,并通过改变病原菌接种顺序,探讨其控病机理,为柑橘采后保鲜及病害控制的应用提供理论依据。
1 材料与方法
1.1材料
材料所用脐橙果实材料购于2012年11月,产地为重庆璧山县,果实为成熟果实,色泽为黄色,剔除病、伤果,挑选大小均匀,成熟度相对一致,无病虫害、机械伤以及无病斑的果实。果实采收后立即运回实验室。
己醛(98%纯度)成都格雷西亚化学技术有限公司。
1.2仪器与设备
SW-CJ-1F超净工作台苏净集团安泰有限公司;DHP-9082电热恒温培养箱上海齐欣科学仪器有限公司;PSX-280A手提式高压灭菌锅上海申安医疗器械厂;UV1000单光束紫外-可见分光光度计上海天美科学仪器有限公司;HunterLab UltraScan PRO色差仪上海信联创作电子有限公司。
1.3方法
1.3.1己醛熏蒸对脐橙果实常见侵染性病害的控制效果
1.3.1.1先己醛熏蒸后接种病原菌对脐橙青绿霉病以及炭疽病的控制效果
参照Song等[39]的方法进行。经表面消毒后的果实被随机的分成4 组:A:蒸馏水;B:50 μL/L己醛;C:100 μL/L己醛;D:150 μL/L己醛,熏蒸24 h;己醛熏蒸后用灭菌打孔器在果实赤道部位等距离刺2 个孔(深4 mm,直径4 mm)。伤口分别接种30 μL,1×108CFU /L青绿霉、炭疽孢子悬浮液;待菌液吸收后,将果实用厚度0.015 mm的聚乙烯袋单果包装,贮藏在20 ℃,相对湿度85%~90%的恒温贮藏箱中,每天统计发病率和病斑直径,发病率计算式(1)。每个处理9 个果实,重复3 次。

1.3.1.2先接种病原菌后己醛熏蒸对脐橙青绿霉病以及炭疽病的控制效果
参照Gardini等[42]的方法进行并作修改。经表面消毒后的果实被随机的分成4 组,用灭菌打孔器在果实赤道部位等距离刺2 个孔(深4 mm,直径4 mm)。伤口分别接种30 μL,1×108CFU /L青绿霉、炭疽孢子悬浮液,待菌液吸收后,各组分别用A:蒸馏水(对照);B:50 μL/L己醛;C:100 μL/L己醛;D:150 μL/L己醛,熏蒸24 h;之后将果实用厚度0.015 mm的聚乙烯袋单果包装,贮藏在20 ℃,相对湿度85%~90%的恒温贮藏箱中,每天统计发病率和病斑直径。每个处理9 个果实,重复3 次。发病率和病斑直径方法同1.3.1.1节。
1.3.2己醛熏蒸对脐橙果实自然发病率的控制效果
经表面消毒后的果实被随机的分成4 组: A:蒸馏水;B:50 μL/L己醛;C:100 μL/L己醛;D:150 μL/L己醛,熏蒸24 h;己醛熏蒸后,将果实用厚度0.015 mm的聚乙烯袋单果包装,贮藏在20 ℃,相对湿度85%~90%的恒温贮藏箱中30 d,并每隔5 d进行观察并记录贮藏果实的自然发病率。每个处理12 个果实,重复3 次。自然发病率计算方法见式(2):1.3.3己醛熏蒸对脐橙果实常见生理性病害的控制效果

经表面消毒后的果实被随机的分成4 组:A:蒸馏水;B:50 μL/L己醛;C:100 μL/L己醛;D:150 μL/L己醛,熏蒸24 h;熏蒸后,将果实用厚度0.015 mm的聚乙烯袋单果包装,在20 ℃,相对湿度85%~90%的恒温贮藏箱中贮藏30 d,每隔5 d进行观察。取样时切取果实赤道部的中果皮置于液氮中速冻,于-80 ℃低温冰箱中保存。
1.3.3.1果皮塌陷指数和褐变指数的测定
参照Knight等[43]的评定方法进行评价,评价标准如表1所示,计算见式(3)、(4):


表1 果皮塌陷指数和变色指数评分标准Taabbllee 11 EEvvaalluuaattiioonn ccrriitteerriiaa ffoorr ccoollllaappssee aanndd ddiissccoolloorraattiioonn ooff ppeeeell rriinndd
1.3.3.2脐橙果实果皮色差值的测定
参照Mcguire[44]的方法,采用色差仪测定果皮颜色,每处理组取10 个脐橙,在每个脐橙赤道部位测定3 次,以L、a、b值表示果实颜色,H值表示色度角,H=arctanb*/ a*×180º/π。H值为评价果实颜色的综合指标(H从0~180依次为紫红、红、橙、黄、黄绿、蓝绿色,其中H=0,紫红色;H=90,黄色;H=180,蓝绿色)。
1.3.3.3脐橙果实果皮总酚含量和类黄酮含量测定
参照Pirie等[45]的方法并改进。准确称取1.0 g样品,立即加入5 mL经4 ℃预冷的1% HCl-甲醇溶液,冰浴条件下研磨匀浆后,转入离心管中于12 000×g,4 ℃条件下离心20 min,上清液直接用于比色。重复3 次。总酚含量以OD280 nm/g表示,类黄酮含量以OD325 nm/g表示
1.3.3.4脐橙果实果皮多酚氧化酶(polyphenol oxidase,PPO)活性测定
称取1.0 g新鲜样品于研钵中,立即加6 mL 0.1 mol/L磷酸缓冲液(pH 6.8)和0.2 g聚乙烯吡咯烷酮,冰浴条件下迅速研磨,匀浆液以12 000×g,4 ℃条件下离心30 min,上清液为酶提取液。PPO活性测定参照Srivastava等[46]的方法并改进。加入2 mL 0.1 mol/L、pH 6.8磷酸缓冲液、0.9 mL 50 mmol/L邻苯二酚和0.1 mL酶提取液。测定室温条件下420 nm波长处反应液10 min内吸光度的变化。以每分钟吸光度变化0.01为一个酶活力单位(U)。
1.4数据分析
Excel 2003统计分析所有数据,计算标准误差并制图;应用SPSS 11.5软件进行方差分析(ANOVA),利用邓肯式多重比较对差异显著性进行分析。P<0.05表示有显著性差异。
2 结果与分析
2.1己醛熏蒸对脐橙果实常见侵染性病害的控制效果
2.1.1先己醛熏蒸后接种病原菌对脐橙果实青绿霉病、炭疽病的控制效果
如图1所示,先己醛熏蒸再接种病原菌的脐橙在贮藏期间,果实发病率和病斑直径随着时间的延长而增加。在贮藏过程中,己醛处理后脐橙果实的青绿霉病及炭疽病发病率和病斑直径与对照相比均无显著性差异(P>0.05),说明先进行己醛处理对后接种的侵染性病害无控制作用。
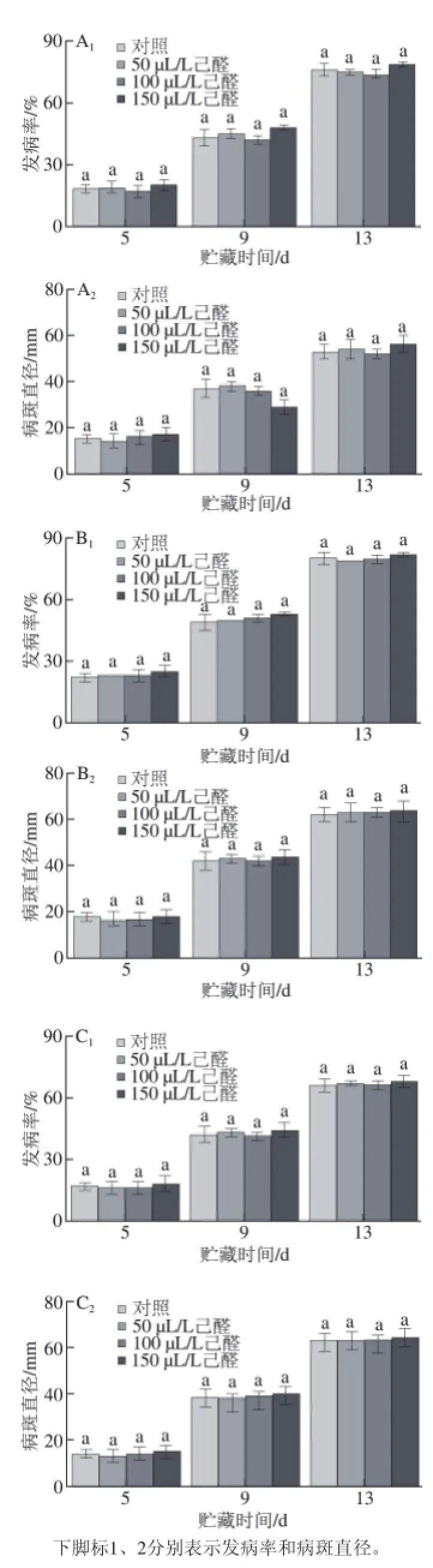
图 1 先己醛熏蒸后接种病原菌对接种青霉菌(AA1、AA2)、绿霉菌(BB1、BB2)、炭疽菌(CC1、CC2)脐橙果实发病率和病斑直径的影响Fig.1 Effect of hexanal vapour treatment before artifi cial inoculation with P. italicum (A1, AA2), P. digitatum (B1, BB2) and C. gloeosporioides (C1, CC2)on disease incidence and lesion diameter of navel orange
2.1.2先接种病原菌后己醛熏蒸对脐橙果实青绿霉病、炭疽病的控制效果
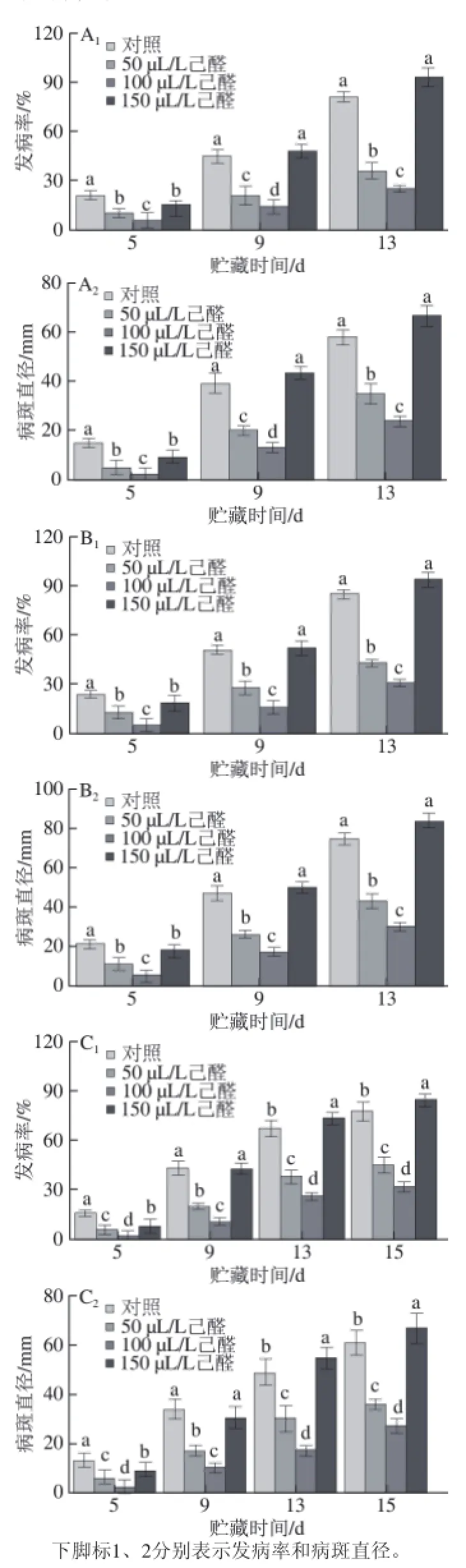
图 2 先接种病原菌后己醛熏蒸对接种青霉菌(AA1、AA2)、绿霉菌(BB1、BB2)、炭疽菌(CC1、CC2)的脐橙果实发病率和病斑直径的影响Fig.2 Effect of hexanal vapour treatment after artifi cial inoculation with P. italicum (A1, AA2), P. digitatum (B1, BB2), and C. gloeosporioides (C1, CC2) on disease incidence and lesion diameter of navel orange
如图2所示,先接种病原菌后己醛熏蒸的脐橙在贮藏期间,果实发病率和病斑直径随着时间的延长而增加。50 μL/L和100 μL/L的己醛熏蒸能显著抑制贮藏期间脐橙侵染性病害发病率和病斑直径的上升(P<0.05),150 μL/L的己醛熏蒸前期能够控制病害发生,后期反而加速了病害的发展。接种青霉菌和绿霉菌的脐橙在高剂量己醛(150 μL/L)处理的第5天可以显著降低发病率和病斑直径(P<0.05),在第9、13天与对照无显著性差异(P>0.05);接种炭疽病菌的脐橙在高剂量己醛(150 μL/L)处理的第5天可以显著降低果实发病率和病斑直径(P<0.05),在第9天与对照无显著性差异,在第13、15天发病率和病斑直径明显增大,分别比对照组增大9.1%和9.84%。
整体来看,100 μL/L的己醛熏蒸控制侵染性病害的效果最好。在贮藏末期(接种青绿霉孢子悬浮液第13天和果实接种炭疽孢子悬浮液第15天),100 μL/L己醛熏蒸组与对照组相比明显降低,青霉病、绿霉病和炭疽病的发病率分别比对照组降低66%、64%、58%;病斑直径分别降低59%、60%、56%。
2.2己醛熏蒸对脐橙果实自然发病率的控制效果
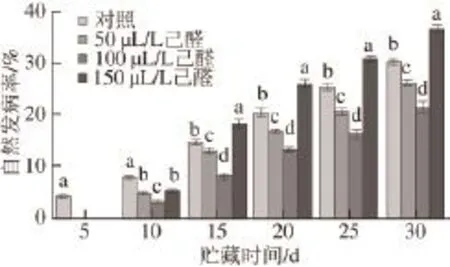
图 3 己醛熏蒸对脐橙果实自然发病率的影响Fig.3 Effect of hexanal vapour treatment on natural disease incidence of navel orange
如图3所示,经过己醛熏蒸的脐橙在贮藏期间,果实发病率和病斑直径随着时间的延长而增加。在整个贮藏过程中50 、100 μL/L己醛熏蒸的脐橙果实的腐烂率明显低于对照果实(P<0.05),且100 μL/L明显优于50 μL/L,在果实贮藏第30天,经100 μL/L己醛处理的果实腐烂率比对照果实的腐烂率降低了40.58%。150 μL/L的己醛熏蒸前期具有控制病害发生,后期反而加速了病害的侵染。说明低剂量己醛熏蒸能有效控制采后果实贮藏过程中微生物、致病菌等的发生,抑制果实腐烂,起到贮藏保鲜的效果。
2.3己醛熏蒸对脐橙果实常见生理性病害的控制效果及机理
2.3.1己醛熏蒸对脐橙果皮变色指数和塌陷指数的影响如图4所示,经过己醛熏蒸的脐橙在贮藏期间,果皮变色指数和塌陷指数随着贮藏时间的延长而增加,50、
100 μL/L己醛熏蒸对果实变色指数、塌陷指数影响不明显(P>0.05)。但150 μL/L己醛熏蒸可使果皮明显变化和塌陷,在贮藏温度贮藏末期(第30天)果皮变色指数和塌陷指数为对照组的2.86、2.77 倍,显著降低果实外观品质,影响其商品价值。
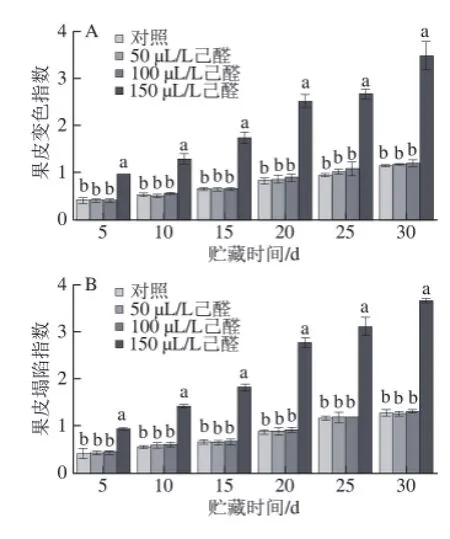
图 4 己醛熏蒸对脐橙果皮变色指数(A)和塌陷指数(B)的影响Fig.4 Effect of hexanal vapour treatment on rind collapse and discolouration of navel orange
2.3.2己醛熏蒸对脐橙果皮色差值的影响
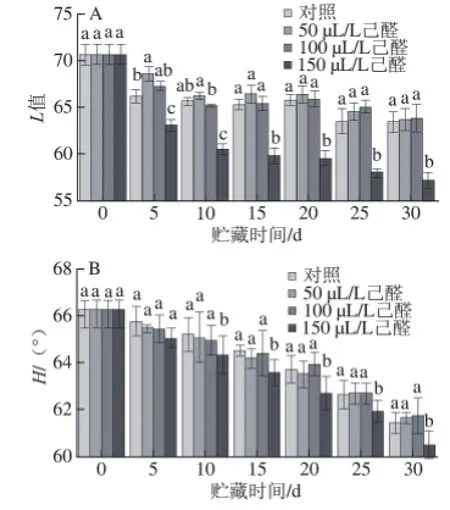
图 5 己醛熏蒸对脐橙果皮L值(AA) 和H值(BB)的影响Fig.5 Effect of hexanal vapour treatment on L and H values of navel orange peel
如图5所示,经过己醛熏蒸的脐橙在贮藏期间,果实的L值和H值随着贮藏时间的延长而下降。其中50、100 μL/L己醛熏蒸果实L值和H值与对照无显著性差异(P>0.05),150 μL/L己醛熏蒸会显著降低果实的L值和H值,在贮藏末期,较对照组分别降低了7.19%和2.49%,表明常温贮藏下,150 μL/L己醛熏蒸显著降低果实外观品质,使果实失去光泽,并导致果皮褐变。所以高剂量的己醛处理会加大生理性病害发病的几率。
2.3.3己醛熏蒸对脐橙果皮总酚、类黄酮含量和PPO活性的影响
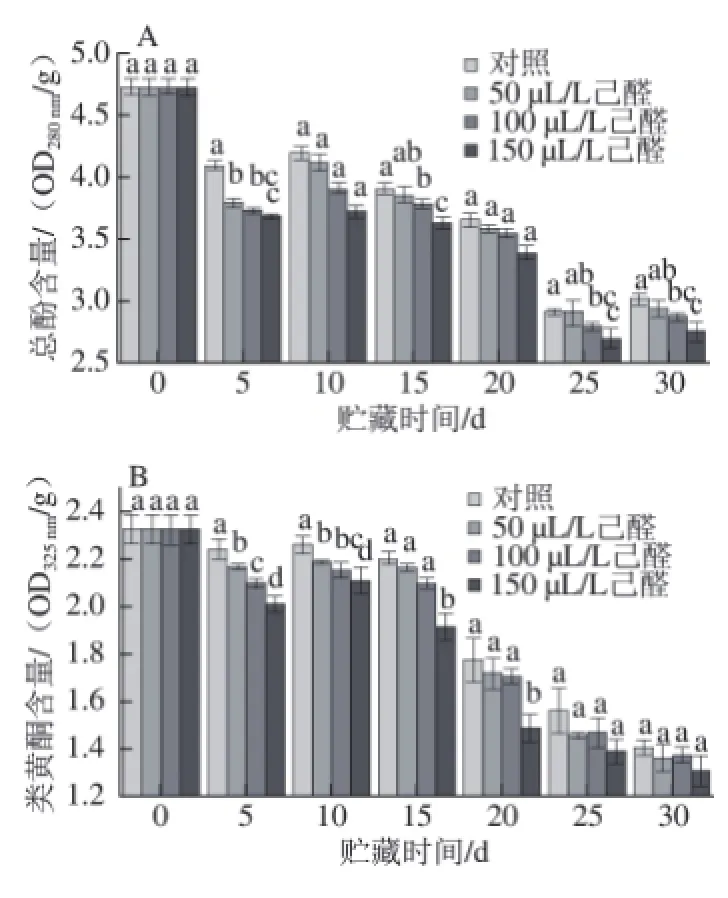
图 6 己醛熏蒸对脐橙果皮总酚(A)和类黄酮(B)含量的影响Fig.6 Effect of hexanal vapour treatment on total phenolic andfl avonoid contents of navel orange peel
如图6A所示,经过己醛熏蒸的脐橙在贮藏期间,果皮中总酚含量呈现先下降后上升再下降的趋势,且对照组果皮总酚含量高于所有处理组,在贮藏末期50 μL/L己醛熏蒸与对照组无显著性差异(P>0.05),而100 μL/L和150 μL/L己醛熏蒸与对照组有显著性差异(P<0.05),其中150 μL/L能明显降低果皮总酚的含量,在贮藏末期(第30天),150 μL/L己醛处理组的总酚含量比对照组低8.25%。
由图6B可知,在贮藏过程中,柑橘果皮中类黄酮类物质含量与总酚含量具有基本一致的变化趋势,即贮藏过程中柑橘果实中类黄酮含量亦呈现先下降后上升再下降的趋势,且对照组的果皮类黄酮含量高于所有处理组。其中150 μL/L能明显降低果皮类黄酮的含量,在贮藏第5、10、15、20天,150 μL/L己醛熏蒸与对照有显著性差异(P<0.05),分别比对照组低10.37%、10.89%、13.26% 和15.93%,但到贮藏末期,其果皮类黄酮含量和对照组无显著性差异(P>0.05)。
如图7所示,经过己醛熏蒸的脐橙在20 ℃贮藏温度条件下贮藏期间,脐橙果皮PPO活性呈现出先升高后降低再升高的趋势。经己醛熏蒸的果实果皮PPO活性要高于对照组,且随着己醛剂量的增加这种效应更为明显。150 μL/L己醛熏蒸在贮藏前期,即贮藏第5、10、15天时与对照组有显著性差异(P<0.05),而到贮藏后期果皮的PPO含量与对照组无显著性差异(P>0.05)。
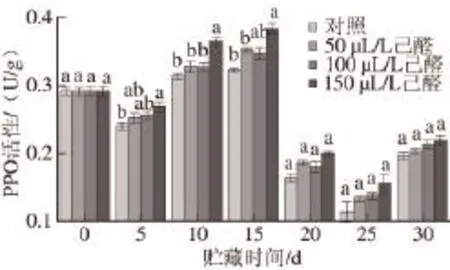
图 7 己醛熏蒸对脐橙果皮PPO活性的影响Fig.7 Effect of hexanal vapour treatment on PPO activity of navel orange peel
3 讨 论
果蔬在贮藏中因腐烂所造成的损失占20%~25%,其中最主要的是由病原菌侵染引起的腐烂[1]。近年来,许多研究发现果实本身自然挥发物可以有效控制采后由致病微生物所引起的果蔬腐烂。研究发现,(E)-2-己烯醛在抑制无核鲜食葡萄灰霉病方面具有很好的效果[47],25 μL/L和125 μL/L甲醛可完全抑制灰霉病菌和褐腐菌的孢子萌发[48-49],利用含有低剂量乙醇气体的缓释剂处理草莓,能够有效防止其在室温贮藏条件下的果实软化及由病原微生物引起的腐烂[50]。本实验中先接种病原菌再进行100 μL/L的己醛熏蒸可以显著抑制青绿霉病和炭疽病,与Song等[39]和Fan等[40]研究结果一致。先接种病原菌后己醛熏蒸处理 果实侵染性病害的发病率和病斑直径与对照组相比有显著性差异,说明己醛对病原菌有直接抑制作用,而先己醛熏蒸处理后接种病原菌与对照组相比无显著性差异,说明己醛对脐橙果实无抗病诱导性。本实验中150 μL/L己醛熏蒸处理抑制病原菌发病率和病斑直径的效果效果不及1 00 μL/L己醛熏蒸处理,是因为己醛用量过高,会造成果实的植物毒性伤害,从而加重侵染性病害的发生。
近年来,研究发现己醛处理对不同的果实贮藏品质的影响是不同的,目前尚无统一结论。有的研究表明己醛可以增加果蔬品质,如Paz等[51]研究表明己醛处理可增强蓝莓、番茄、梨等果实的感官品质。有些研究表明己醛会对果蔬产生不利影响,如Avissar等[47]研究发现己醛会诱导果实产生植物毒性症状并降低果实感官品质。目前的研究并无具体的反应机理。本实验发现高剂量的己醛(150 μL/L)熏蒸24 h会造成脐橙果皮塌陷指数和变色指数的升高,亮度和色度的降低,PPO活性的升高,以及总酚和类黄酮的降解从而导致脐橙果实果皮的褐变并引发生理性病害,而低剂量的己醛(50、100 μL/L)熏蒸24 h与对照无显著性差异。与Paligath等[52]的研究结果一致。
4 结 论
以上实验结果表明,与对照相比,先己醛熏蒸后接种对脐橙果实的控病效果差异不显著;而先接种后进行己醛熏蒸则表现出对病害的控制或促进作用,50、
100 μL/L己醛处理控制侵染性病害效果显著,100 μL/L己醛熏蒸效果最好,而150 μL/L己醛熏蒸在脐橙贮藏后期加重了侵染性病害的发生;100 μL/L己醛熏蒸也可以显著抑制常温条件下脐橙果实的自然发病率。另外,关于对脐橙果皮生理性病害的影响,50、100 μL/L的己醛熏蒸与对照相比差异不显著,而高剂量(150 μL/L)的己醛熏蒸会促进酚类物质的氧化,造成果皮的褐变和塌陷,加重果实生理性病害的发生。说明低剂量的己醛能显著抑制脐橙侵染性病害的发生,又不会引发生理性病害,故在柑橘果实保鲜上有着良好的应用前景。
[1]邓雨艳, 曾凯芳. 柑橘果实采后侵染性病害防治技术研究进展[J].食品科技, 2008, 33(4): 211-214.
[2]赖传雅. 农业植物病理学[M]. 北京: 科学出版社, 2003: 281.
[3]刘艳. 柑橘贮藏期侵染性病害的发生及防治[J]. 农技服务, 2009,26(1): 79-80.
[4]余建. 柑橘贮藏病害及防腐保鲜[J]. 云南农业科技, 2007(6): 50-52.
[5]谢昌平, 郑服从. 热带果树病理学[M]. 北京: 中国农业科学技术出版社: 2010, 102-105.
[6]李怀方, 刘凤权, 郭小密. 园艺植物病理学[M]. 北京: 中国农业大学出版社, 2001: 76.
[7]黄振东, 陈国庆, 浦占湑, 等. 柑橘贮藏过程主要病害的发生规律及防治对策[J]. 浙江柑桔, 2006(3): 20-23.
[8]SALVATORE D, ANGELA F, ANTONIO B, et al. Combined effects of potassium sorbate, hot water and thiabendazole against green mould of citrus fruit and residue levels[J]. Food Chemistry, 2013, 141(2): 796-801.
[9]LORENTE D, ZUDE M, REGEN C, et al. Early decay detection in citrus fruit using laser-light back scattering imaging[J]. Postharvest Biology and Technology, 2013, 86: 424-430.
[10] WANG Jingqiu, HAO Haohao, LIU Runsheng, et al. Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and ‘Newhall' navel orange (Citrus sinensis) from the perspective of crystal morphology, chemical composition and key gene expression[J]. Food Chemistry, 2014, 153: 177-185.
[11] NAOKI Y, KOHTARO T, MASAYOSHI S, et al. Control of degreening in postharvest green sour citrus fruit by electrostatic atomized water particles[J]. Food Chemistry, 2014, 156: 160-164.
[12] GEORGINA S, DIEGO H M, SERGIO G, et al. Automatic recognition of quarantine citrus diseases[J]. Expert Systems with Applications,2013, 40(9): 3512-3517.
[13] 邓伯勋. 园艺贮藏运销学[M]. 北京: 中国农业出版社, 2002: 7.
[14] 连喜军, 鲁晓翔, 高攀攀. 柑橘的贮藏与保鲜[J]. 农产品加工,2005(10): 44-45.
[15] SHARMA R R, DINESH S, RAJBIR S. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: a review[J]. Biological Control, 2009, 50(3): 205-221.
[16] DAVIDE S, MARIA L G. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology, 2004, 91(2): 185-194.
[17]LU Huangping, LU Laifeng, ZENG Lizhen, et al. Effect of chitin on the antagonistic activity of Rhodosporidium paludigenum against Penicillium expansum in apple fruit[J]. Postharvest Biology and Technology, 2014, 92: 9-15.
[18] HONG P, HAO W N, LUO J J, et al. Combination of hot water,Bacillus amyloliquefaciens HF-01 and sodium bicarbonate treatments to control postharvest decay of mandarin fruit[J]. Postharvest Biology and Technology, 2014, 88: 96-102.
[19] REN Xueyan, KONG Qingjun, WANG Huili, et al. Biocontrol of fungal decay of citrus fruit by Pichia pastoris recombinant strains expressing cecropin A[J]. Food Chemistry, 2012, 131(3): 796-801.
[20] DROBY S, WISNIEWKI M, MACARISIN D, et al. Twenty years of postharvest biocontrol research: is it time for a new paradigm[J]. Postharvest Biology and Technology, 2009, 52(2): 137-145.
[21] SPADARO D, GULLINO M L. State of the art and future prospects of the biological control of postharvest fruit diseases[J]. International Journal of Food Microbiology, 2004, 91(2): 185-194.
[22] ZHANG Jiuxu, TIMMER L W. Preharvest application of fungicides for postharvest disease control on early season tangerine hybrids in Florida[J]. Crop Protection, 2007, 26(7): 886-893.
[23] PRUSKY D, BAZAK M, BENARIE R. Development, persistence, survival and strategies for control of thiabendazole-resistant strains of Penicillium expansum on pome fruits[J]. Phytopathology, 1985, 75(8): 877-882.
[24] SMIEK J. Biological control of postharvest disease studies[J]. Citrograph, 1992, 78: 16-18.
[25] WILSON C L, WISNIEWSKI M E, BILES C L. Biological control of postharvest diseases of fruits and vegetable: altematives to synthetic fungieides[J]. Crop Protection, 1991, 10: 171-172.
[26] GIUSEPPE A, GIOVANNI C D, FRANCESSO G, et al. A new method for the postharvest application of imazalil fungicide to citrus fruit[J]. Biosystems Engineering, 2013, 115(4): 434-443.
[27] KANETIS L, FORSTER H, ADASKAVEG J E. Optimizing effi cacy of new postharvest fungicides and evaluation of evaluation of sanitizing agent for managing citrus green mold[J]. Plant Disease,2008, 92(2): 261-269.
[28]LURIE S. Postharvest heat treatments[J]. Postharvest Biology and Technology, 1998, 14(3): 257-269.
[29] KIM J G, YOUSEF A E, DAVE S. Application of ozone for enhancing the microbiological safety and quality of foods: a review[J]. Journal of Food Prot, 1999, 62(9): 1 071-1087.
[30] SONG J, FAN L, HILDEBRAND P D, et al. Biological effects of corona discharge on onions in a commercial storage facility[J]. Hort Technology, 2000, 10(3): 608-612.
[31] DEYPRM P, JONES A L, CAMERON A C. Fungistatic effects of carbon dioxide in a package environment on the decay of Michigan sweet cherries by Monilinia fructicola[J]. Plant Disease, 1991, 75(9): 943- 946.
[32] KIM H J, FENG H, TOSHKOV S A, et al. Effect of sequential treatment of warm water dip and low-dose gamma irradiation on the quality of fresh cut green onions[J]. Journal of Science, 2005, 70(3): 179-185.
[33] WISNIEWSKI M E, WILSON C L. Biological control of postharvest diseases of fruits and vegetables: recent advances[J]. HortScience,1992, 27(2): 94-98.
[34] PESIS E, AVISSAR I. Effect of postharvest application of acetaldehyde vapor on strawberry decay, taste, and certain volatiles[J]. Journal of the Science of Food and Agriculture, 1990, 52(3): 77-85
[35] SHOLBERG P L, HAAG P, HOCKING R, et al. The use of vinegar vapor to reduce postharvest decay[J]. HortScience, 2000, 35(5): 898-903.
[36] ARCHBOLD D D, HAMILTON T R, CLEMENTS A M, et al. Fumigating ‘Crimson Seedless' table grapes with (E)-2-hexenal reduces mold during long-term postharvest storage[J]. HortScience,1999, 34(4): 705-707.
[37] AVISSAR I, DROBY S, PESIS E. Characterization of acetaldehyde effects on Rhizopus stolonifer and Botrytis cinerea[J]. Annals of Applied Biology, 1990, 116(2): 213-220.
[38] FALLIK E, ARCHBOLD D D, HAMILTON-KEMP T R, et al. (E)-2-hexenal can stimulate Botrytis cinerea growth in vitro and on strawberries in vivo during storage[J]. Journal of the American Society for Horticultural Science, 1998, 123(5): 875-881.
[39] SONG J, PAUL D H, FAN L H, et al. Effect of hexanal vapor on the growth of postharvest pathogens and fruit decay[J]. Food Science,2007, 72(4): 216-223.
[40] FAN L, SONG J, BEAUDRY R M, et al. Effect of hexanal vapor on spore viability of Penicillium expansum, lesion development on whole apples and fruit volatile biosynthesis[J]. Food Science, 2006, 71(3): 105-109.
[41] EAFUS: Center of food safety and applied nutrition[S]. U.S. Food and Drug Administration (FDA), 2006.
[42] GARDINI F, LANCIOTTI R, GUERZONI M E. Effect of (E)-2-hexenal on the growth of Aspergillus flavus in relation to its concentration, temperature and water activity[J]. Letters in Apply Microbiology, 2001, 33(1): 50-55.
[43] KNIGHT T, KLIEBER A, SEDGLEY M. Structural basis of rind disorder oleocellosis in Washingt on Navel orange[J]. Annals of Botany, 2002, 90(6): 765-773.
[44] MCGUIRE R G. Reporting of objective colour measurements[J]. HortScience, 1992, 27(12): 1254-1255.
[45] PIRIE A, MULLINS M G. Changes in anthocyanin and phenolic content of grapevine leaf and fruit tissue treated with sucrose, nitrate and abscisic acid[J]. Plant Physiology, 1976, 58(4): 468-472.
[46] SRIVASTAVA M K, DWIVED U N. Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(l/2): 87-96.
[47] AVISSAR I, PESIS E. The control of postharvest decay in table grape using acetaldehyde vapors[J]. Ann Apply Biology, 1991, 118(1): 229-237. [48] JUN S, PAUL D H, LIHUA F C, et al. Effect of hexanal vapor on the growth of postharvest pathogens and fruit decay[J]. Journal of Food Science, 2007, 72(4): 216-223.
[49] JUN S, RUJIDA L, WEIMIN D, et al. Hexanal vapor is a natural,metabolizable fungicide: inhibition of fungal activity and enhancement of aroma biosynthesis in apple slices[J]. HortScience, 1996, 121(5): 937-942.
[50] 马瑜, 柯杨, 王常晔, 等. 乙醇缓释气体处理对草莓常温保鲜效果的影响[J]. 保鲜与加工, 2014(2): 30-33; 37.
[51] PAZ O, JANES H W, PREVOST B A, et al. Enhancement of fruit sensory quality by post-harvest applications of acetaldehyde and ethanol: blueberries, tomatoes, pears[J]. Food Science, 1982, 47(1): 270-278.
[52] PALIGATH G, MURR D P. Compositions for the preservation of fruits and vegetables[J]. Food Science, 2007, 74(6): 198-206.
Effect of Hexanal Fumigation on Infectious Diseases and Physiological Disorders of Navel Orange
ZHAO Yijie1, WANG Jianjun1, DENG Lili1, 2, ZENG Kaifang1,2,*
(1. College of Food Science, Southwest University, Chongqing400715, China;2. Chongqing Engineering Research Center of Regional Food, Chongqing400715, China)
We designed this study to examine the effect of hexanal fumigation on postharvest infectious diseases and physiological disorders of navel oranges. For infectious diseases, the effect of hexanal vapour treatment before artifi cial inoculation of navel oranges with Penicillium italicum, Penicillium digitatum and Colletotrichum gloeosporides was not significant while the effect of hexanal vapour treatment after artificial inoculation with pathogens was related to its concentration. The incidence of infectious diseases was decreased by hexanal vapour treatment at 50 and 100 μL/L,especially at 100 μL/L. Meanwhile, 100 μL/L hexanal vapour also signifi cantly inhibited the increase in the natural incidence of diseases. The effect of hexanal vapor treatment at low concentrations (50 and 100 μL/L) on physiological disorders was not signifi cant, but hexanal vapor treatment at high concentration (150 μL/L) promoted the oxidation of total phenolics,caused rind collapse and then accelerated the occurrence of the physiological disorders.
hexanal; infectious diseases; physiological disorders; storage
TS255.3
A
1002-6630(2015)24-0290-07
10.7506/spkx1002-6630-201524054
2015-04-25
国家自然科学基金面上项目(31471631);“十二五”国家科技支撑计划项目(2015BAD16B07);重庆市科技攻关(应用技术研发类/重点)项目(cstc2012gg-yyjsB80003)
赵一洁(1993—),女,硕士研究生,研究方向为农产品贮藏工程。E-mail:zhaoyijie1993@163.com
曾凯芳(1972—),女,教授,博士,研究方向为农产品贮藏工程。E-mail:zengkaifang@163.com
——硫酰氟熏蒸应用技术

