纳米TiO2-光催化灭活水中噬菌体MS2
吕文洲,乔宇祥,刘 英 (宁波大学建筑工程与环境学院,浙江 宁波 315211)
纳米TiO2-光催化灭活水中噬菌体MS2
吕文洲*,乔宇祥,刘英 (宁波大学建筑工程与环境学院,浙江 宁波 315211)
提出了一种简易的水中病毒灭活方法,以噬菌体MS2为模式病毒,探讨了紫外光照射时间、TiO2浓度、紫外光强度对自来水中MS2灭活效率的影响;评价了太阳光代替紫外光用于光催化灭活病毒的可行性.研究结果表明,聚乙烯(PE)材质的样品袋能更好地透过紫外光;紫外光照射 6h,50mg/L的 TiO2可以灭活自来水中 7.95Log的 MS2;紫外光强度在 45μW/m2以下时,灭活率随强度的提高而增加;在溪水中,50mg/L的 TiO2仅有 4.87Log的灭活效率. 在太阳光下,50mg/L的 TiO2在自来水和溪水中对 MS2的灭活效率差异不明显,都达到了6.1Log以上,表明太阳光-TiO2灭活水中的病毒可行且高效.
纳米TiO2;噬菌体MS2;水;病毒灭活
TiO2作为一种环境友好型的光催化材料被广泛用于难降解有毒有害物质的光催化降解[1-4].其主要作用机理是TiO2在紫外光的激发下发生空穴等作用产生活性氧(ROS)[5],包括·OH、O2·-、·O2和H2O2等可以与病原菌结构中的蛋白和脂质发生反应,从而导致此类生物体的灭活[6],因此,TiO2也被尝试用于水中致病微生物的灭活研究. Matsunaga等[7]于1985年最早利用TiO2灭活细菌和酵母菌;而后围绕TiO2光催化灭活病原菌的条件优化[8]、灭活机理[6,9]、反应器材料[10-12]、光催化剂的改性[13-16]以及 TiO2固定化方面[17-18]展开了广泛的研究.相比于病原菌,目前对水中病毒的灭活研究相对较少且多见于国外.Sjogren等[19]通过添加 FeSO4显著提高了紫外光照射下TiO2悬液对水中MS2的灭活效果.国内关于TiO2对病原菌或者病毒灭活的研究较少,且多处于实验室的定性研究阶段[20-21].另外,在病原菌和病毒的灭活过程中,敞开体系或者曝气过程中往往会产生含有病原菌或病毒粒子的气溶胶,可能对接触人群产生健康风险[22],因此在病原菌及病毒灭活的装置设计时应予以考虑.
噬菌体MS2在有肠道病毒污染的水环境中普遍存在,对阳光和紫外光具有一定的抗性[23-24],并且对人没有致病性,因此常被用做评价消毒效果的模式病毒[14,19,25-26].本研究以MS2为例,提出了一种水中病毒灭活的简易方法,探讨了紫外光照射时间、TiO2浓度、紫外光强度对TiO2光催化灭活 MS2的影响;并在此基础上,评价了太阳光-TiO2灭活水中MS2的效能和可行性.
1 材料与方法
1.1实验材料
噬菌体MS2及培养:MS2由美国加州大学欧文分校市政与环境工程系的Sunny Jiang实验室提供.培养方法:将一接种环的宿主大肠杆菌从试管斜面接入盛有15mL LB液体培养基(酵母提取物5g;细菌胰蛋白胨 10g;NaCl 10g;水1L;pH 7.0)的灭菌离心管中,置于37℃、165r/min的恒温振荡器中培养过夜.使用移液器移取1mL的培养液,接入盛有30mL LB液体培养基的50mL离心管中,继续以 165r/min振荡培养 6h;随后接入备存的MS2滤液100μL, 培养过夜,待培养液基本澄清时结束培养.将培养好的MS2悬液经0.22μm (MILLEX-GP,33mm)的无菌针头滤器过滤,即为MS2的储备液.
纳米TiO2及处理:纳米TiO2购自Sigma公司,为锐钛矿形态,颗粒直径为 21nm.实验前,秤取一定量的 TiO2粉末,置于盛有一定量的超纯水的50mL离心管中,放在冰浴中在 300W 的超声波(Fisher Scientific, Sonic Dismembrator, model 500)下分散20min,每次超声15s,间隔5s. TiO2及超纯水的量根据具体实验中TiO2的添加浓度而定.
1.2MS2灭活装置及仪器
样品袋中放入100mL的TiO2与MS2的悬液,封口卷动密封后固定于一台以 48°夹角前后摇摆的试管振荡器(型号:Speci-Mix,Thermo)上, 以 18r/min的频率缓慢摇摆,其目的主要是保持TiO2的颗粒均匀分散在悬液中,避免因为团聚现象而导致的颗粒比表面积下降.同时,样品袋中的少量空气在摇摆中形成大的气泡,反复洗刷样品袋内壁,防止在内侧形成水雾而影响紫外光的穿透效率.本实验选取了2种样品袋,一种是普通透明的样品袋(成分为聚对苯二甲酸乙二酯,PET),一种是 Nasco Whirl-Pak的无菌样品袋(成分为聚乙烯,PE).通过在可见-紫外分光光度计(型号:CARY 100Bio)中对其进行波长扫描,选择紫外光透过率高的Nasco Whirl-Pak样品袋进行后续实验.
在条件实验中,紫外光源为定波长黑光灯SPECTROLINE MODEL EA-160,稳定提供波长为365nm的紫外光.装置中紫外灯管与试管振荡器摆动轴心的直线距离约 10cm,以下实验中除了考察紫外光强度对MS2灭活的影响外,紫外光强度一律为(62.8±0.8)μW/m2.
1.3试验设计
1.3.1紫外光-TiO2对自来水中 MS2的灭活效果取自来水放入广口试剂瓶中,静置12h以便使余氯逸出,根据预先测定的培养好的MS2悬液浓度,使用自来水将其稀释到 MS2浓度约为108PFU/mL.取 4个样品袋,分别装入经稀释的MS2悬液95mL,然后向其中2个加入超声波处理后的 TiO2悬液 5mL,使 TiO2的最终浓度为200mg/L;另外2个则加入5mL超纯水代替TiO2悬液.样品袋在紫外光下照射6h,考察 TiO2与紫外光不同组合处理下MS2的灭活率,即无TiO2+紫外光、无TiO2+无紫外光(通过厚的铝箔密封样品袋来实现)、TiO2+无紫外光及 TiO2+紫外光.其中MS2灭活率计算方法为Rate=Log(C0/Ct). 1.3.2紫外光照射时间对灭活 MS2的影响TiO2的终浓度取 200mg/L,考察紫外光照射0,1,2,3,4,5, 6h时TiO2对MS2的灭活效率.
1.3.3TiO2浓度对灭活MS2的影响TiO2的浓度取0, 5,10,20,40,50,100,150,200mg/L,考察不同TiO2浓度对MS2的灭活效率.为了与后续采用太阳光灭活MS2实验的时间一致,以下实验的紫外灯照射时间一律采用6h.
1.3.4紫外光强度对 TiO2灭活 MS2的影响TiO2的浓度取50mg/L,通过调节样品袋与灯管之间的距离控制紫外光强度,强度分别控制在0,14.3,33.5,44.6,57.5μW/m2,考察不同紫外光强度下TiO2对MS2的灭活效果.
1.3.5紫外光-TiO2灭活溪水中 MS2的效果取校园附近一条小溪中的水代替自来水考察紫外光-TiO2对MS2的灭活效果.该小溪中有芦苇等水生植物,水质清澈,取样处水深 0.5m,流速约0.3m/s.为了切近实际应用目的,实验前将溪水进行2h的静置处理,未过滤.
1.3.6太阳光-TiO2灭活自来水及溪水中 MS2的效果TiO2的浓度取 50mg/L.选取阳光充足的晴天进行实验,将装置放于太阳光下,照射时间选取早上10:00至下午16:00,共6h.在不同时段对光照强度和样品温度进行测定,以排除室外温度过高而导致的MS2灭活的可能.溪水采集和处理方法同上.
1.4分析方法
紫外光强度测定:使用ILT1400-A Radiometer Photometer对黑光灯的紫外光和晴天太阳光的紫外光部分进行测定.该仪器可以测定瞬时值和一段时间内的积分值.测定单位为 μW/m2或者J/m2(可切换).
MS2浓度测定:使用双层平板法.首先根据不同的实验,将待测的MS2样品使用无菌水进行梯度稀释,取合适的3个浓度的稀释液300μL与新培养的大肠杆菌悬液 300μL混合、震荡,再倾入含5mL LB上层培养基(含0.5%的琼脂)中充分混合,但震荡幅度不宜过大,以免产生气泡造成对后续计数的影响.为了排除TiO2颗粒吸附MS2对测定结果的影响,实验后直接取MS2悬液进行稀释分析,没有进行TiO2颗粒的去除.同时,后续的双层平板培养在生化培养箱中进行,没有光照,因此培养基中存在的 TiO2颗粒不会被光激活而产生光催化反应,因而也不会对测定结果造成影响.
对于各因素的影响试验研究,分别进行3次实验,结果以平均值表示.
2 结果与讨论
2.1紫外光-TiO2灭活MS2的效果
由图1看出,两种样品袋在波长400nm以上的透光率趋于一致,但在 350nm 以下时, Whirl-pak的透光率明显高于普通样品袋,而后者在200~310nm时的透光率几乎为0,也就是说此波段的光会被完全阻隔,因此不能透过样品袋作用于 TiO2颗粒.因此,普通样品袋的光催化效能将明显低于Whirl-pak样品袋.
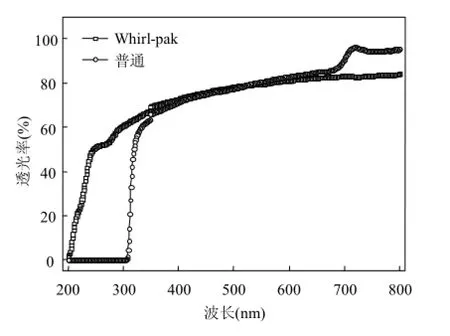
图1 两种样品袋对不同波长光的透过率Fig.1 Comparison of transmittance rate of two sample bags under different wavelength

表1 紫外光-TiO2各组合情况下去除MS2的效果Table 1 MS2 removal efficiency under different combinations of ultraviolet and TiO2
太阳光到达地球表面的组分包括 UVB (280~320nm)、UVA(320~400nm)以及可见光(400~700nm)[27].利用太阳能灭活水中病原微生物,因其经济廉价而成为发展中国家水消毒的一种常用方法.Lawrie等[28]评价了太阳能对不同材质容器中大肠杆菌、粪肠球菌以及产气荚膜梭菌的灭活效果,结果表明对波长280~320nm具有良好透过性的PE材质的容器在灭活效果上明显优于PET材质的容器,因此本研究选取PE材质的Whirl-pak样品袋进行后续研究.
表1是使用whirl-pak样品袋在黑光灯下灭活MS2的效果.对于3×107PFU/mL的MS2悬液, 当 TiO2浓度为 200mg/L时,经紫外灯照射6h,MS2的灭活率达到了7.48Log;没有光照射时(即使用铝箔纸包裹),仅有约 1Log的灭活效率;而单纯的紫外光照射处理对MS2的灭活效果也只有1.56Log.因此,在自来水介质中,TiO2在紫外光的激发下具有很高的MS2灭活效率.
由于取样测试的是含有TiO2的悬液,因此吸附作用对 MS2去除率的影响因素可以排除.而TiO2颗粒吸附作用对MS2的去除效率也即为二氧化钛存在下未经光照的处理.根据测试结果,仅吸附而无光催化的去除效率仅为1.01Log.
2.2紫外光照射时间对TiO2灭活MS2的影响
由图 2可以看出,对于浓度为 7.84Log的MS2,在接受强度为62.4~63.2μW/m2的紫外光照射1h后,剩余浓度约3.76Log,去除约4.08Log;照射 2h后,去除 6.91Log,此时的 MS2浓度仅约8PFU/mL;4h后无MS2检出.因此,在200mg/L的TiO2浓度下,几乎在 2h内可以将浓度为 6.93× 107PFU/mL的MS2全部灭活,其接收的紫外光能量约为462.3mJ/m2.由拟合曲线可以看出,在起初的2h内,MS2的灭活速率最高(k=-3.0271).
2.3TiO2浓度对灭活MS2的影响
首先考察了TiO2浓度0,50,100,150,200mg/L的效果.结果显示,经过6h的照射,即使最低的使用量 50mg/L也可以达到 7.95Log的灭活效率.随后降低TiO2浓度为5,10,20,40,50mg/L,结果如图3显示.随着TiO2浓度的增大,6h的灭活效率增加,而且TiO2浓度与剩余MS2的对数值呈现显著的负相关(R2=0.9818).当 TiO2浓度为40mg/L时,MS2的去除率达到6.78Log,相应的水中的MS2浓度约为30PFU/mL;相对于光照前的1.8×108PFU/mL,去除效果已经很显著,但灭活效果远低于50mg/L时的7.95Log.
现有文献中关于TiO2浓度对MS2灭活影响的研究并不多见.Biguzzi等[8]利用TiO2光催化灭活假单胞菌 Pseudomonas stutzera,TiO2浓度由0.5g/L提升到 4.0g/L,灭活率由 4.26Log提高到6.00Log.但本研究表明,对于利用 TiO2光催化灭活MS2,随着TiO2浓度的增加(超过0.5g/L后),灭活率并没有明显地提高.可能的原因是,0.5g/L 的TiO2在被光激发后产生了足够多的·OH或者ROS,足以灭活溶液中的 MS2.高浓度的 TiO2更容易导致颗粒团聚以及紫外光透过率的降低,从而降低光催化效率.
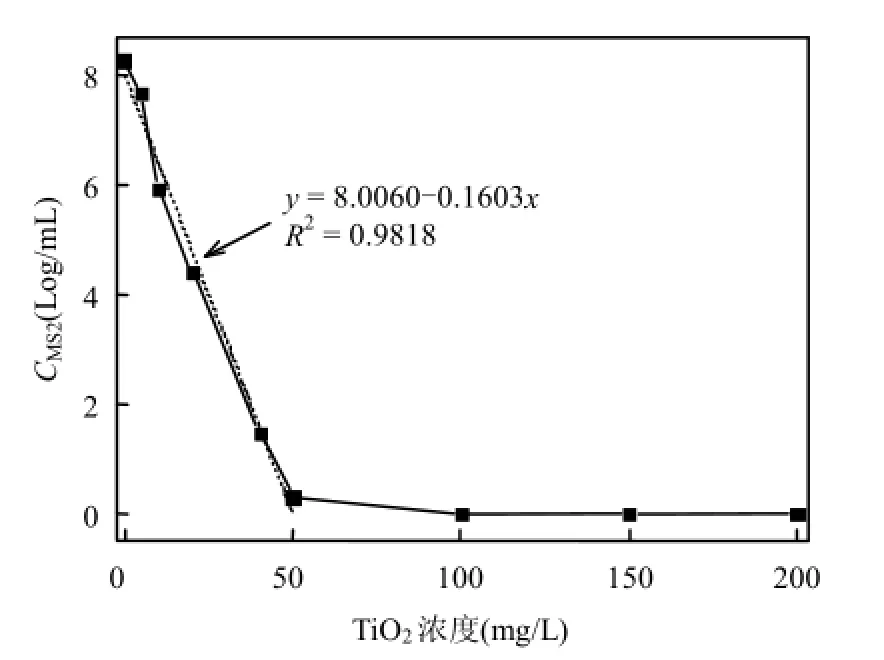
图3 紫外光下TiO2浓度对灭活MS2的影响Fig.3 Effect of TiO2concentration on the MS2inactivation efficiencyunder ultraviolet
2.4紫外光强度对TiO2灭活MS2的影响
考虑到50mg/L的 TiO2能基本去除水中的MS2,后续实验中均选这个浓度进行.更少的TiO2的用量有利于减少悬液的浊度,既经济又可提高光的利用效率;同时也可以减少实际应用中的材料消耗和环境保护问题.由图4可以看出,紫外强度在 45μW/m2以下时,随着紫外光强度的增加,灭活率增加(R2=0.9790);而强度继续提高到57.5μW/m2时,去除率并没有明显增加,说明TiO2对MS2的灭活也存在一个最优的紫外光强度.

图4 紫外光强度对TiO2灭活MS2的影响Fig.4 Effect of ultraviolet intensity on the MS2 inactivation efficiency
2.5紫外光-TiO2灭活溪水中MS2的效果
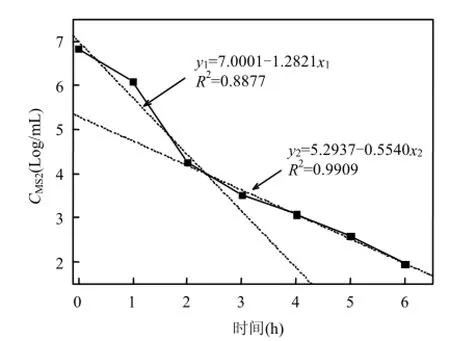
图5 紫外光下CTiO2=50mg/L TiO2对溪水中MS2的灭活效果Fig.5 Removal efficiency of MS2 in creek water at the concentration of 50mg/L of TiO2under ultraviolet
使用溪水替代自来水,跟踪研究了在紫外光强度为62.4μW/m2下,50mg/mL的TiO2对溪水中MS2的灭活效果.由图 5可以看出,对于6.6×106PFU/mL的MS2,经过6h紫外光照射后的绝对灭活率为4.87Log, 反应完后悬液中的MS2浓度达到了100PFU/mL左右,明显低于相同条件下自来水中MS2的灭活效率.推测造成该结果的原因可能是溪水中含有的少量天然有机物(NOM)消耗了产生的活性氧所致.相比之下,仅光照可以灭活约1.17Log的MS2;而仅TiO2无光照时,只有0.15Log的灭活效率,均较自来水的低.从灭活曲线来看,在2h内也有一个较快的灭活速率(k=-1.2821),与自来水中的规律相同(图 2),但灭活速率明显低于后者(k=-3.0271).同时由图5还可以看出,2h后的灭活速率明显低于前 2h,其k=-0.5540.至于在灭活溪水中 MS2时出现灭活速率的拐点,推测与溪水中的少量有机物及其组成有关,但具体原因还需进一步研究.
2.6太阳光-TiO2灭活自来水及溪水中MS2的效果
在美国加州2012年10~12月份选择晴天天气探讨了太阳光条件下,50mg/LTiO2对自来水及溪水中MS2的灭活效率.测定了太阳光在10:00~16:00间的强度,10:30: (57.6±0.1)μW/m2; 14:10:(44.2±0.3)μW/m2; 16:00 仅(2.2±0.1)μW/m2(太阳快落山时).测试6h总的光能约992~1040mJ/m2.实验中每隔1h测试了菌悬液的温度,最高温度没有超过30℃,因此温度不会造成MS2的失活.实验结果表明,对于 7.0×107PFU/mL的 MS2,经过6h的太阳光照射后,自来水和溪水中的残留MS2浓度类似,为50PFU/mL左右,去除效率均达到了6.14~6.19Log.而有趣的是,虽然溪水中有少量有机物的存在,但MS2灭活效率并没有因此而降低,反而略有升高.一般认为ROS可以无选择性的攻击有机物,因此水中的NOM可能和病毒存在着一定的竞争,消耗一部分的 ROS,也就可能出现病毒灭活效率的降低.但水中NOM的存在会产生新种类的 ROS,如单线氧(1O2)[27,29],而这些新的ROS的作用可能抵消了少量NOM对ROS的消耗,因此保持了高的去除率.另外,Love等[22]研究太阳光对水中人类病毒和MS2的灭活效果中发现,因为南加州海滩的水质异常清澈,以至于对其中的病毒灭活效率与PBS中病毒的灭活效率没有明显差异.
2.7讨论
2.7.1太阳光-TiO2对水中病毒的灭活国外学者近年来利用太阳能复合抛物面聚光器(Solar Compound Parabolic Collectors)来光催化灭活水中的病毒取得了一定的成果,但这些装置结构和操作往往比较复杂,比如复杂的管路、充气等,而充气可能导致气溶胶的产生而出现二次污染[30].而且对于发展中国家而言,简单、经济、易行的灭菌方法更为现实和有效.本研究中建立了简单的灭菌装置,所需要的就是选择紫外光可以高效透过的袋子,向含病毒的水中加入少量的TiO2,然后密封于袋子中并进行适度的混匀操作,达到了高效灭活水中病毒的目的.另外,该过程在全密封情况下进行,不存在产生气溶胶的风险.
同样是50mg/L的TiO2灭活溪水中的MS2,太阳光照射6h的效果远高于紫外灯照射的效果(分别为6.19Log和4.87Log),推测原因可能是太阳光中的短波紫外光(比如UVB)起到了一定作用.
2.7.2光催化剂的改良或者固定利用悬浮态TiO2,特别是纳米级颗粒做光催化剂灭活水中的病毒存在回收难的问题.虽然在灭活水中病毒时使用的TiO2量远低于其他行业,如食品和个人护理等,但也可能对环境造成一定的风险[31];而且存在浊度对灭活效率的影响问题[32].因此固定化TiO2是一个发展的趋势.
目前出现了 TiO2纳米管等固定化的TiO2[18,33],还有一些为改善氧化活性而设计的元素修饰TiO2[34],提高了使用的安全性和光催化的效率,为该技术的应用奠定了基础.但有学者对比了悬浮态和固定态TiO2的消毒效果,认为要达到相同的灭活效率,固定态的浓度要比悬浮态高[35],这一点与 TiO2光催化机制有关[36],即 TiO2光致催化反应主要发生于催化剂表面,而悬浮态的纳米颗粒更易与病原粒子的有机结构接触.
3 结论
3.1以 PE为材质的样品袋能更好地透过紫外光而用于光催化灭活MS2.
3.2在自来水中,200mg/L的TiO2在紫外光照射6h可以灭活自来水中7.48Log的MS2,且在起初的2h灭活速率最高;50mg/L的TiO2在6h紫外光下可达到 7.95Log的灭活效果;紫外强度在45μW/m2以下时,灭活率随强度的提高而增加;强度继续增大对灭活率的提高作用不明显.
3.3在溪水中,50mg/L的TiO2在6h紫外光下只有4.87Log的灭活效率.但在太阳光下,50mg/L的TiO2在自来水和溪水中对MS2的灭活效率差异不明显,均达到了6.1Log以上.
[1] Kanakaraju D, Glass B D, Oelgemöller M. Titanium dioxide photocatalysis for pharmaceutical wastewater treatment [J]. Environmental Chemistry Letters, 2013,12(1):27-47.
[2] Mousanejad T, Khosravi M, Tabatabaii S M ,et al. Photocatalytic ozonation for degradation of 2-sec-butyl-4,6-dinitrophenol (DNBP) using titanium dioxide: effect of operational parameters and wastewater treatment [J]. Research on Chemical Intermediates, 2013,40(2):711-722.
[3] 高乃云,张晏晏,马艳. UV/TiO2去除水中磺胺甲唑的动力学及影响因素分析 [J]. 中国环境科学, 2013,33(11):1958-1964.
[4] 王阿楠,滕应,骆永明.二氧化钛(P25)光催化降解二苯砷酸的研究 [J]. 环境科学, 2014,35(10):3800-3806.
[5] 李明玉,赵倩,曾小龙,等.TiO2光电催化中光生电子降解对苯醌的行为研究 [J]. 中国环境科学, 2015,35(5):1397-1402.
[6] Carré G, Hamon E, Ennahar S, et al. TiO2photocatalysis damages lipids and proteins in Escherichia coli [J]. Applied and Environmental Microbiology, 2014,80(8):2573-2581.
[7] Matsunaga T, Tomoda R, Nakajima T, et al. Photoelectrochemical sterilization of microbial cells by semiconductor powders [J]. FEMS Microbiology Letters, 1985,29(1/2):211-214.
[8] Biguzzi M, Shama G. Effect of titanium dioxide concentration on the survival of Pseudomonas stutzeri during irradiation with near ultraviolet light [J]. Letters in Applied Microbiology, 1994,19(6):458-460.
[9] Pigeot-Rémy S, Simonet F, Errazuriz-Cerda E ,et al. Photocatalysis and disinfection of water: Identification of potential bacterial targets [J]. Applied Catalysis B: Environmental, 2011,104(3/4):390-398.
[10] Lawrie K, Mills A, Figueredo-Fernández M, et al. UV dosimetry for solar water disinfection (SODIS) carried out in different plastic bottles and bags [J]. Sensors and Actuators B: Chemical, 2014,208(0):608-615.
[11] Marques A R, Gomes F d C O, Fonseca M P P ,et al. Efficiency of PET reactors in solar water disinfection for use in southeastern Brazil [J]. Solar Energy, 2013,87(0):158-167.
[12] Fisher M B, Iriarte M, Nelson K L. Solar water disinfection (SODIS) of Escherichia coli, Enterococcus spp., and MS2 coliphage: Effects of additives and alternative container materials [J]. Water Research, 2012,46(6):1745-1754.
[13] 全玉莲,李方宇,曹东杰,等.锰离子掺杂纳米二氧化钛的制备及在造纸废水处理中的应用 [J]. 环境工程, 2013,31(2):8-11.
[14] Jafry H R, Liga M V, Li Q, et al. Simple Route to Enhanced Photocatalytic Activity of P25 Titanium Dioxide Nanoparticles by Silica Addition [J]. Environmental Science and Technology, 2010:1563-1568.
[15] Xiong Z, Ma J, Ng W J, et al. Silver-modified mesoporous TiO2photocatalyst for water purification [J]. Water Research, 2011, 45(5):2095-2103.
[16] 唐建军,陈益清,李文龙.TiO2及负载Fe(Ⅲ)可见光催化H2O2降解扑草净的协同效应 [J]. 中国环境科学, 2015,35(3):777-782.
[17] Alrousan D M a, Dunlop P S M, McMurray T a, et al. Photocatalytic inactivation of E. coli in surface water using immobilised nanoparticle TiO2films [J]. Water Research, 2009, 43(1):47-54.
[18] 钟福新,林莎莎,朱义年,等.La/Fe共掺杂 TiO2纳米管阵列光催化降解制糖废水 [J]. 环境科学学报, 2011,31(7):1450-1455.
[19] Sjogren J C, Sierka R a. Inactivation of Phage MS2 by Iron-Aided Titanium Dioxide Photocatalysis [J]. Applied and Environmental Microbiology, 1994,60(1):344-347.
[20] 黄利强,许昱,郭松林.纳米 TiO2光催化杀灭水产病原菌的研究 [J]. 集美大学学报(自然科学版), 2010,15(4):254-257.
[21] 吴秉婷,陈昭斌,许欣.纳米二氧化钛对噬菌体 MS2灭活效果的初步观察 [J]. 现代预防医学, 2010,37(3):526-528.
[22] Fannin K F, Vana S C, Jakubowski W. Effect of an activated sludge wastewater treatment plant on ambient air densities of aerosols containing bacteria and viruses [J]. Applied and Environmental Microbiology, 1985,49(5):1191-1196.
[23] Mamane H, Shemer H, Linden K G. Inactivation of E. coli, B. subtilis spores, and MS2, T4, and T7phage using UV/H2O2advanced oxidation [J]. Journal of Hazardous Materials, 2007, 146(3):479-486.
[24] Love D C, Silverman A, Nelson K L. Human Virus and Bacteriophage Inactivation in Clear Water by Simulated Sunlight Compared to Bacteriophage Inactivation at a Southern California Beach [J]. Environmental Science and Technology, 2010,44(18):6965-6970.
[25] Cho M, Chung H, Choi W, et al. Different inactivation behaviors of MS-2phage and Escherichia coli in TiO2photocatalytic disinfection [J]. Applied and Environmental Microbiology, 2005, 71(1):270-275.
[26] Kim J Y, Lee C, Love D C, et al. Inactivation of MS2 coliphage by ferrous ion and zero-valent iron nanoparticles [J]. Environmental Science and Technology, 2011,45(16):6978-6984.
[27] Kohn T, Nelson K L. Sunlight-mediated inactivation of MS2coliphage via exogenous singlet oxygen produced by sensitizers in natural waters [J]. Environmental Science and Technology, 2007,41(1):192-197.
[28] McGuigan K G, Conroy R M, Mosler H-J ,et al. Solar water disinfection (SODIS): A review from bench-top to roof-top [J]. Journal of Hazardous Materials, 2012,235-236(0):29-46.
[29] Kohn T, Grandbois M, McNeill K ,et al. Association with natural organic matter enhances the sunlight-mediated inactivation of MS2 coliphage by singlet oxygen [J]. Environmental Science and Technology, 2007,41(13):4626-4632.
[30] García-Fernández I, Fernández-Calderero I, Polo-López M I, et al. Disinfection of urban effluents using solar TiO2photocatalysis:A study of significance of dissolved oxygen, temperature, type of microorganism and water matrix [J]. Catalysis Today, 2015,240, Part A(0):30-38.
[31] Weir A, Westerhoff P, Fabricius L ,et al. Titanium dioxide nanoparticles in food and personal care products [J]. Environmental Science and Technology, 2012,46(4):2242-2250.
[32] Davies C M, Roser D J, Feitz a J, et al. Solar radiation disinfection of drinking water at temperate latitudes: inactivation rates for an optimised reactor configuration [J]. Water Research, 2009,43(3):643-652.
[33] 滕洪辉,张影,宁军博,等.二氧化钛纳米管光催化降解水中百草枯 [J]. 环境工程学报, 2014,8(3):815-820.
[34] Wu P, Xie R, Imlay K, et al. Visible-light-induced bactericidal activity of titanium dioxide codoped with nitrogen and silver [J]. Environmental Science and Technology, 2010,44(18):6992-6997.
[35] Laot N, Narkis N, Neeman I, et al. TiO2photocatalytic inactivation of selected microorganisms under various conditions:sunlight, intermittent and variable irradiation intensity, CdS augmentation and entrapment of TiO2into sol-gel [J]. Journal of Advanced Oxidation Technologies, 1999,4(1):97-102.
[36] Gumy D, Morais C, Bowen P, et al. Catalytic activity of commercial of TiO2powders for the abatement of the bacteria (E. coli) under solar simulated light: Influence of the isoelectric point [J]. Applied Catalysis B: Environmental, 2006,63(1/2):76-84.
致谢:本实验的MS2由美国加州大学欧文分校市政与环境工程系的Sunny Jiang教授提供,实验工作得到了Sunny Jiang教授的悉心指导,在此表示衷心感谢.
Inactivation of bacteriophage MS2 in water by TiO2nanoparticles coupled with light.
LÜ Wen-zhou*, QIAO Yu-xiang, LIU Ying (College of Architectural Civil Engineering and Environment, Ningbo University, Ningbo 315211,China).
China Environmental Science, 2015,35(8):2532~2538
A simple inactivation method of viruses in water was presented in this study by using bacteriophage MS2 as the model virus. Effects of irradiation time, concentration of TiO2and light intensity of ultraviolet on removal efficiency of MS2 were discussed, and the feasibility of sunlight instead of ultravioletapplied to inactivate virus was evaluated. The results showed that higher transmittance of ultravioletwas obtained for the polyethylene (PE) sample bag; 7.95 Log of MS2 in tapwater was inactivated after 6hour's irradiation of ultraviolet at the concentration of 50mg/L of TiO2;inactivation rate increased with the increasing light intensity below 45μW/m2. By comparison, 4.87 Log of MS2 in creek water was inactivatedat the concentration of 50mg/L of TiO2under ultraviolet. However, 6.1 Log removal efficiency of MS2 in either tapwater or creek water was achieved under sunlight at the same concentration of TiO2, indicating that TiO2coupled with sunlight is a sound method to inactivate the virus in water.
nanoparticle TiO2;bacteriophage MS2;water;virus inactivation
X506
A
1000-6923(2015)08-2532-07
2015-1-27
国家自然科学基金项目(50908119);浙江省自然科学基金项目(LY12E08007)
* 责任作者, 副教授, wenzhoulv@yahoo.com
吕文洲(1974-),男,陕西西安人,副教授,博士,主要研究方向为废水生物处理及水质安全.发表论文30余篇.

