丹参酮Ⅰ脂质体的制备及表征*
郭丽丽,范丽丽,王爱潮,庞晓晨,罗 配,杨红云,王少峡,刘志东(1.天津市现代中药重点实验室,天津中医药大学,天津300193;2.天津中医药大学,现代中药发现与制剂技术教育部工程研究中心,天津300193;3.天津中医药大学中医药研究院,天津市现代中药重点实验室——省部共建国家重点实验室,天津市中药药理学重点实验室,天津300193)
丹参酮Ⅰ脂质体的制备及表征*
郭丽丽1,2,范丽丽1,2,王爱潮1,2,庞晓晨1,2,罗配1,2,杨红云1,3,王少峡1,3,刘志东1,2
(1.天津市现代中药重点实验室,天津中医药大学,天津300193;2.天津中医药大学,现代中药发现与制剂技术教育部工程研究中心,天津300193;3.天津中医药大学中医药研究院,天津市现代中药重点实验室——省部共建国家重点实验室,天津市中药药理学重点实验室,天津300193)
[目的]制备丹参酮Ⅰ脂质体,并对其包封率、粒径、电位等理化性质进行考察。[方法]采用薄膜分散法丹参酮Ⅰ脂质体,用琼脂糖凝胶柱色谱法和紫外分光光度法测定包封率,用差示扫描量热法检测丹参酮Ⅰ脂质体各组成物质的相变过程。[结果]丹参酮Ⅰ在1.004~6.024 μg/mL范围内线性关系良好(r=0.999 9),琼脂糖凝胶柱色谱法能有效分离脂质体和游离药物,加样回收率为(98.23±0.02)%,平均包封率为(92.56±0.39)%,粒径为(90.64±1.21)nm,电位为(-35.37±0.84)mV。[结论]薄膜分散法可用于制备丹参酮Ⅰ脂质体,制备的丹参酮Ⅰ脂质体的包封率高,粒径均一,电位稳定,药物含量和包封率测定方法准确可靠,专属性强。
丹参酮Ⅰ;脂质体;包封率
丹参酮Ⅰ(TSⅠ)是中药丹参中的脂溶性有效成分,不仅具有天然抗氧化性、心血管药理作用以及抗菌消炎作用,还具有明显的抗肿瘤作用[1],能抑制人肝癌细胞(HepG2)、人肺腺癌细胞(CL1-5)生长[2-3],另有文献报道丹参酮Ⅰ有提高小鼠学习记忆能力的作用[4]。丹参酮Ⅰ在水中溶解度低,有研究者曾将丹参酮Ⅰ制备成盐或固体分散物,动物实验表明,丹参酮Ⅰ固体给药时吸收效果差[5]。为了使其更好地发挥疗效、提高其生物利用度,结合脂质体能增加脂溶性药物溶解度的特性,拟通过将丹参酮Ⅰ包封成脂质体。因此本研究采用薄膜分散法制备了丹参酮Ⅰ脂质体(TSⅠ-LP),用琼脂糖凝胶柱色谱法测定包封率,为该制剂的优化与评价提供了可靠保证。
1 仪器与试剂
1.1仪器旋转蒸发仪(上海爱朗仪器有限公司);紫外分光光度计(WFZ-2800H,尤尼柯上海仪器有限公司);LF-50脂质体挤出仪(Avestin,加拿大);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);C3860A超声清洗器(天津Autoscience公司);AX205电子天平(Mettler toledo,瑞士);BP121S电子天平(德国Sartorius公司);DELTTA320 PH计(Mettler toledo,瑞士);Milli-Q超纯水系统(Millipore,美国);激光粒径测定仪(马尔文Nano ZS,英国);Jade DSC差示扫描量热仪(Perkin-Elmer,美国);冷冻干燥器(ELEYA FDU-2100,日本)
1.2试剂蛋黄卵磷脂(上海艾韦特医药科技有限公司,批号DE-13022,质量分数80%);丹参酮Ⅰ标准品(天津中新药业集团股份有限公司提供,批号W13-0-1,质量分数≥98%);胆固醇(郑州利伟生物实业有限公司,批号120712-16);琼脂糖凝胶(Sepharose CL-4B,批号17-0150-01,美国,粒径45~165 μm,分离范围70×103~20×108);甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1丹参酮Ⅰ脂质体的制备精密称取处方量的蛋黄卵磷脂:胆固醇:TSⅠ(20∶5∶1,质量比)共溶于适量无水乙醇中。超声溶解后置于旋转蒸发器上以50 r/min、40℃减压除去乙醇。形成薄膜后,加入一定量的去离子水洗脱薄膜,充分水化,冰水浴探头超声120次后(200 w,每次3 s,间歇3 s),经脂质体挤出仪过0.40 μm和0.20 μm滤膜,即得丹参酮Ⅰ脂质体。
2.2检测波长以甲醇作为空白,通过对TSⅠ对照品溶液、空白脂质体进行紫外扫描,可见空白脂质体对药物的检测无干扰,在244 nm处有最大吸收,故选择244 nm作为检测波长。
2.3标准曲线的绘制精密称取TSⅠ对照品适量于容量瓶中,加甲醇溶解制备成100.40 μg/mL的标准液,用甲醇稀释适当倍数分别配制成浓1.004、2.008、4.016、5.020和6.024 μg/mL的TSⅠ系列标准品溶液,以甲醇为空白,在244 nm处测定吸光度。以吸光度A(Abs)对浓度C(μg/mL)作图并进行线性回归,得回归方程:C=0.131 8A+0.005 9,r= 0.999 9,在1.004~6.024 μg/mL范围内线性关系良好[6-8]。
2.4精密度精密量取TSⅠ对照品储备液适量,配制成1.004、4.016、6.024 μg/mL溶液,分别每日重复测定5次,连续测定3 d,记录TSⅠ的吸光度值,计算日内、日间RSD值分别为0.19%、0.13%,表明仪器精密度良好。
2.5包封率的测定
2.5.1琼脂糖胶柱色谱条件于10 mL注射器针筒底部垫上两层脱脂棉。将溶胀12 h以上的8 mL液态琼脂糖凝胶(Sepharose CL-4B)装填于针筒内,用20%乙醇、洗脱液PBS(pH6.8)依次冲洗柱子(4~5个柱体积),再用空白脂质体(2~3个柱体积)冲洗柱子至平衡后,加入TSⅠ-LP混悬液0.5 mL,用PBS(pH6.8)洗脱,流速1.0 mL/min,室温条件下进行[9]。
2.5.2洗脱曲线的绘制用PBS(pH6.8)洗脱,分段收集,每份1 mL,接取20份,用甲醇分别稀释不同倍数,用紫外分光光度计于244 nm处测定样品的吸光度,根据2.3项下标准曲线计算浓度,用浓度C(μg/mL)为纵坐标,洗脱体积为横坐标,绘制洗脱曲线,见图1。根据图1,前11 mL洗脱下来的为TSⅠ-LP,游离药物从15 mL开始流出,到19 mL洗脱完全,此洗脱条件能很好地分离脂质体和药物。
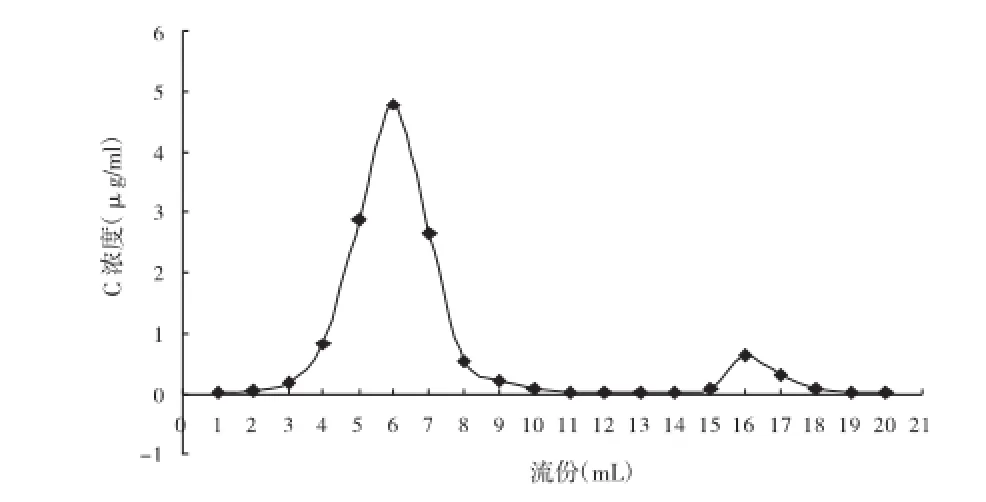
图1 TSⅠ-LP在琼脂糖胶柱上的洗脱曲线Fig.1 Elution curve of TSⅠ-LP on Sepharose gel
2.5.3加样回收率配制高、中、低3种浓度的TSⅠ的2%Tween-80溶液,精密量取0.5 mL,分别与0.5 mL空白脂质体混合后上样,按2.5.1项下条件洗脱,收集游离药物组分后,用甲醇分别稀释,用紫外分光光度计于244 nm处测定样品的吸光度,根据2.3项下标准曲线计算浓度和回收率。结果高、中、低不同浓度的样品回收率分别为100.00%、98.41%、96.28%,平均回收率为(98.23±0.02)%,表明该方法和条件可用于TSⅠ-LP洗脱。
2.5.4TSⅠ-LP包封率测定精密吸取样品0.5 mL,按2.6.1项下条件洗脱,收集前11 mL洗脱液,测定吸光度,根据标准曲线计算TSⅠ含量(W1)。另取同一份样品0.5 mL,用甲醇破乳稀释至10 mL容量瓶中,测定吸光度,计算TSⅠ含量(W2)。包封率%=经柱分离的脂质体中含药量(W1)/总药量(W2)×100%。由上述公式计算得[10],包封率为(92.56±0.39)%。
2.6粒径和Zeta电位测定将所制得的TSⅠ-LP样品用去离子水适当稀释,置Nano ZS激光粒径测定仪的石英测量池和毛细管小池中,分别测定其粒径和Zeta电位,每份样品各测3次。结果平均粒径为(92.43±0.19)nm,Zeta电位为(-35.37±0.84)mV,见图2。
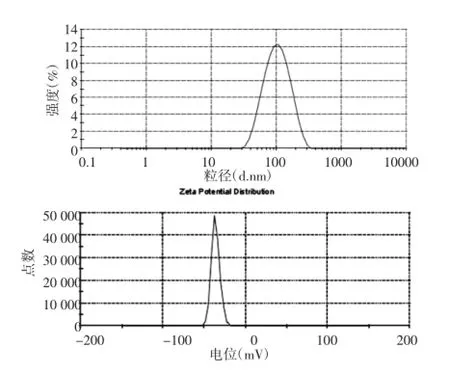
图2 TSⅠ-LP的粒径分布和电位分布曲线Fig.2 Size and Zeta distribution curve of TSⅠ-LP
2.7差示扫描量热法检测将TSⅠ-LP处方中的各组分(蛋黄卵磷脂、胆固醇、TSⅠ)、冻干处理的空白脂质体和TSⅠ-LP等样品分别置于坩埚中,在氮气流(20 mL/min)、加热速度10℃/min的条件下,温度范围为30~400℃,测定各样品的DSC曲线。结果可见,空白脂质体的DSC曲线与蛋黄卵磷脂、胆固醇的DSC曲线相比,相变峰明显不同,表明在脂质体形成双层膜时,脂质体中各成分发生了一定程度的相互作用。与TSⅠ、物理混合物的DSC曲线相比,TSⅠ-LP的DSC曲线中TSⅠ的相转变峰消失,表明TSⅠ已包裹于脂质体中[11-13]。见图3。
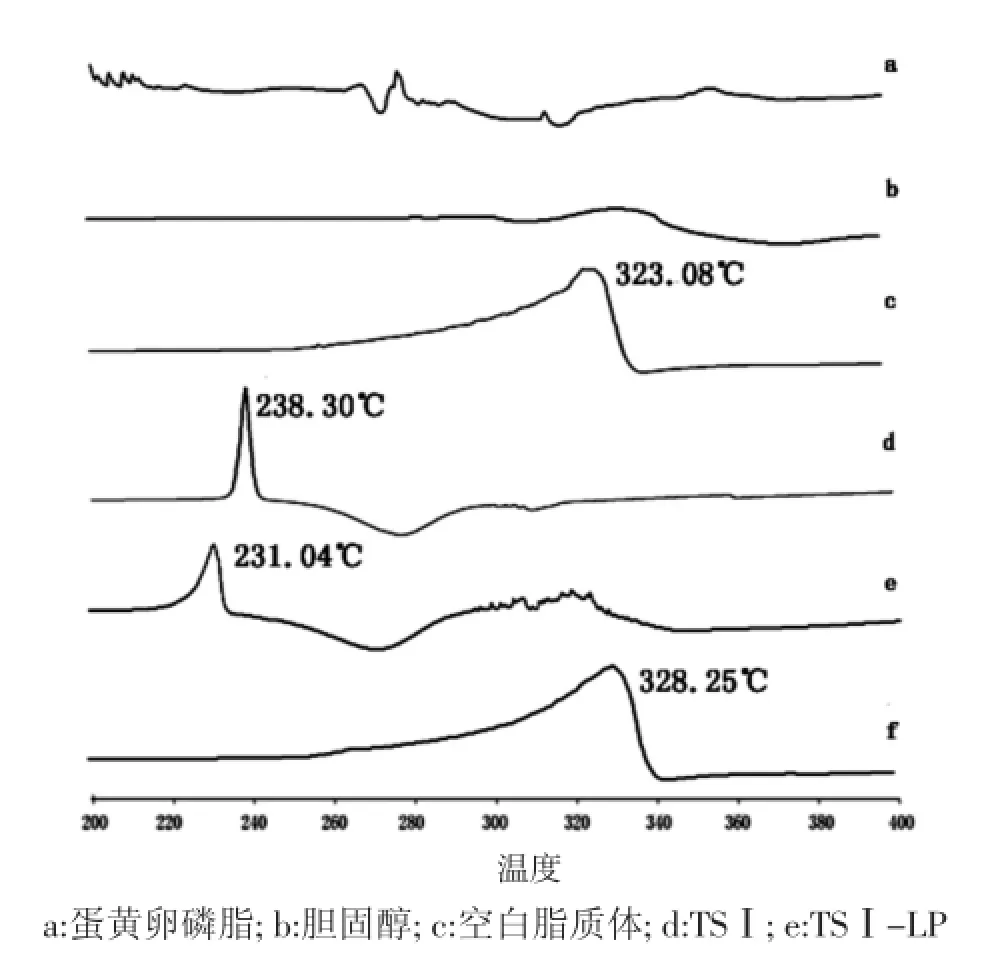
图3 各种样品的DSC曲线Fig.3 DSC crurves of all kinds of samples
3 讨论
丹参酮Ⅰ是丹参的有效生物活性成分之一,有多项研究表明丹参酮Ⅰ具有防止肝细胞损伤和增强学习记忆的药理作用,还可以诱导肺癌、乳腺癌、结直肠癌、血癌等癌细胞的凋亡。丹参中的二萜类化合物丹参酮主要包括丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮和二氢丹参酮,对癌症如结肠癌、肺癌、卵巢癌和口腔癌等有毒性作用。目前见诸报道的主要是丹参酮ⅡA的抗癌作用,但有文献表明在前列腺癌和卵巢癌中,丹参酮Ⅰ抑制癌细胞生长和诱导癌细胞凋亡的作用明显强于丹参酮ⅡA,因此对适合丹参酮Ⅰ的剂型进行深入的研究,对开发其更多的药理活性和作用机制具有重要意义[14-17]。
常用的脂质体制备方法有薄膜分散法、逆向蒸发法、乙醇/乙醚注入法、乳化法及硫酸铵梯度法等[18],本研究采用薄膜分散法制备丹参酮Ⅰ脂质体,并使用探头超声减小其粒径,方法简单,重现性好。
在制备TSⅠ-LP时,前期采用了高压均质、高压微射流、脂质体挤出仪对脂质体混悬液进行进一步的混匀成型,结果表明三种方法对TSⅠ-LP的载药量影响无显著差别,但制剂经脂质体挤出仪挤出后,粒径相对更小、分布更均匀、稳定性更高。因此,采用此法对TSⅠ-LP进行整粒。
包封率是评价脂质体制剂质量的重要指标,测定方法有很多种,常用的有凝胶柱层析法、透析法、微柱离心法、超速离心法、超滤离心法等[19-22]。实验前期测定包封率考察了超速离心法、超滤离心法和琼脂糖凝胶柱色谱法,结果发现超速离心法无法实现药物与脂质体的分离,超滤离心管对药物存在比较严重的吸附作用,因而本研究最终采用了琼脂糖凝胶柱色谱法来测定包封率。采用此法操作的缺点是:①人工填柱时,不能保证每次柱高都一致,这样可能会产生测量误差;②该法同其他方法相比,洗脱体积大、操作较繁琐、操作时间较长。在进行洗脱条件摸索时,发现洗脱过程中琼脂糖凝胶对TSⅠ-LP存在一定的吸附作用,后采用空白脂质体预先对柱子进行冲洗至饱和,这一问题才得到解决。因此,脂质体包封率的测定还需摸索更完善的方法进行,应结合脂质体的性质,选择合适高效的测定方法。
[1]梁勇,羊裔明,袁淑兰.丹参酮药理作用及临床应用研究进展[J].中草药,2000,31(4):304-306.
[2]郑国灿,李智英.丹参酮Ⅰ抗肿瘤作用及作用机制的实验研究[J].实验肿瘤杂志.2005,20(1):33-35.
[3]Lee CY,Sher HF,Chen HW,et al.Anticancer effects of tanshinoneⅠin human non-small cell lung cancer[J].Mol Cancer Ther.2008,7(11):3527-3538.
[4]Kim DH,Kim S,Jeon SJ,et al.Tanshinone I enhances learning and memory,and ameliorates memory impairment in mice via the extracellular signal-regulated kinase signalling pathway[J].Br J Pharmacol.2009,158(4):1131-1142.
[5]钱名望,杨保津,顾文华,等.丹参有效成分的研究[J].化学学报,1978,36(3):199-205.
[6]高国义,刘志东,赵峥,等.黄芩苷缓释片的研制及其体外释放度研究[J].天津中医药,2009,26(5):426-428.
[7]周红燕,陈建伟.紫外分光光度法测定炒决明子中总蒽醌含量[J].天津中医药,2007,24(2):156-158.
[8]郭迎新,潘卫三,李非,等.不同检测方法在银杏叶缓释制剂处方设计中的比较研究[J].天津中医药大学学报,2013,32(3):157-160.
[9]V.P.托尔钦林.脂质体[M].第2版.北京:化学工业出版社,2007.[10]高晓黎,季兴梅.葡聚糖胶柱色谱法测定脂质体包封率的条件筛选[J].中国药学杂志,2003,38(7):515-517.
[11]Bhalerao SS,Rajie Harshal A.Preparation,optimization,characterization,and stability of salicylic acid liposomes[J].Drug Dev Ind Pharm,2003,29(4):451-467.
[12]瞿继兰,刘志东,郭秀君,等.丹参酮ⅡA固体脂质纳米粒的制备及质量评价[J].天津中医药,2014,31(9):564-566.
[13]齐学洁,邱超,姜恒丽,等.白藜芦醇/羟丙基-Β-环糊精包合物的表征及体外溶出研究[J].天津中医药,2013,30(8):499-502.
[14]Kim MK,Park GH,Eo HJ,et al.TanshinoneⅠinduces cyclin D1 proteasomal degradation in an ERK1/2 dependent way in human colorectalcancer cells[J].Fitoterpia.2015,101:162-168.
[15]Liu JJ,Liu WD,Yang HZ,et al.Inactivation of P13k/Akt signaling pathway and activation of caspase-3 are involved in tanshinoneⅠ-induced apotosis in myeloid leukemia cells in vitro[J].Ann Hematol. 2010,89(11):1089-1097.
[16]Gong Y,Li Y,Lu Y,et al.Bioactive tanshinones in Salvia miltiorrhiza inhibit the growth of prostate cancer cells in vitro and in mice[J].Int J Cancer.2011,129(5):1042-1052.
[17]Wang L,Liu A,Zhang FL,et al.Evaluation and SAR analysis of the cytotoxicity of tanshinones in colon cancer cells[J].Chin J Nat Med. 2014,12(3):167-171.
[18]刘晓谦,王锦玉,仝燕,等.脂质体制备技术及其研究进展[J].中国药学杂志.2011,46(14):1084-1088.
[19]赵峰,栾瀚森,罗华菲,等.葡聚糖凝胶色谱法用于纳米粒包封率的测定[J].中国药学杂志,2012,47(17):1385-1390.
[20]许伯慧,李晓霞,孟璐,等.齐墩果酸脂质体包封率的测定[J].中国实验方剂学杂志,2012,18(23):86-90.
[21]庄英华,张中文,韩伟,等.超滤离心法测定连翘酯苷脂质体包封率[J].中国新药杂志,2012,21(18):2209-2216.
[22]张玲,黄微崴,王健,等.重酒石酸长春瑞滨脂质体包封率测定方法比较[J].沈阳药科大学学报,2010,27(2):105-109.
(本文编辑:高杉,张震之)
Preparation and characterization of TanshinoneⅠ-loaded Liposomes
GUO Li-li1,2,FAN Li-li1,2,WANG Ai-chao1,2,PANG Xiao-chen1,2,LUO Pei1,2,YANG Hong-yun1,3,WANG Shao-xia1,3,LIU Zhi-dong1,2
(1.Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.Tianjin State Key Laboratory of Modern Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;3.Insitute of Traditional Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin State Key Laboratory of Modern Chinese Medicine,Tianjin 300193,China)
[Objective]To prepare TanshinoneⅠ-loaded Liposomes(TSⅠ-LP)and investigate its entrapment efficiency(EE),particle size,Zeta potential and other physicochemical properties.[Methods]TSⅠ-LP were prepared by film dispersion method,and using Sepharose gel and UV spectrophotometry to determine the entrapment efficiency of TSⅠ-LP.Differential scanning calorimetry(DSC)thermograms of the liposomal samples were recorded respectively.[Results]A good linear relationship was showed of TSⅠin the range of 1.004~6.024 μg/mL(r=0.999 9).Sepharose gel was well in separating the liposomes from free TSⅠ.The average recovery rate was(98.23±0.02)%.The EE of TSⅠ-LP was(92.56±0.39)%.The particle size was(90.64±1.21)nm and the Zeta potential was(-35.37± 0.84)mV.[Conclusion]The film dispersion method can be used to prepare TSⅠ-LP with a high EE,a narrow size distribution and a stationary potential.The method which determine the content of TSⅠ-LP is reliable and sensitive.
TanshinoneⅠ;Liposomes;entrapment efficiency
R284.2
A
1672-1519(2015)05-0308-04
10.11656/j.issn.1672-1519.2015.05.14
教育部新世纪优秀人才支持计划(NCET-12-1068)。
郭丽丽(1988-),女,硕士研究生,主要从事缓控释制剂研究。
刘志东,E-mail:lonerliuzd@163.com。
(2015-01-23)

