低频低能量超声联合微泡对前列腺细胞的影响
陈旖旎,白文坤,胡兵
低频低能量超声联合微泡对前列腺细胞的影响
陈旖旎,白文坤,胡兵
(上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233)
目的:采用原子力声显微镜及透射电镜观察低频低能量超声联合微泡对前列腺癌细胞DU145及正常前列腺上皮细胞RWPE-1的作用。方法:两种细胞均分为对照组、单纯超声组、超声联合微泡组。对照组加入一定比例的生理盐水,不进行超声辐照;单纯超声组加入相同比例的生理盐水,用发射频率为21 kHz的低频超声辐照,辐照2 min,占空比30%;超声联合微泡组加入同前相同比例的微泡造影剂悬浊液,用与单纯超声组相同的超声辐照。处理过的细胞立即用原子力声显微镜观察其形貌并计算其杨氏模量。同时,对同一处理方式的对照组及超声联合微泡组细胞继续培养24 h后,用透射电镜观察细胞。结果:单纯超声组的DU145细胞及RWPE-1细胞的细胞形态与对照组无明显变化;超声联合微泡组的DU145细胞及RWPE-1细胞形态呈类圆形,细胞表面可见放射状显微丝状结构,细胞膜表面可见多个大孔状结构;超声联合微泡组的DU145细胞的弹性模量较RWPE-1细胞大,且与对照组相比,两种细胞的弹性模量均变大,DU145细胞尤甚。透射电镜观察结果示对照组的两种细胞未见细胞自噬,而超声联合微泡组两种细胞都出现自噬现象,其中DU145细胞中可见凋亡现象。结论:低频低能量超声联合微泡可引起前列腺癌DU145细胞及正常前列腺上皮RWPE-1细胞的细胞膜出现孔状结构,并诱导其自噬,且对DU145细胞的损伤大于RWPE-1细胞。
低频低能量超声;微泡造影剂;前列腺癌;原子力声显微镜;细胞自噬
0 引言
近年来,低频超声被广泛应用于疾病治疗中。
许多学者研究了低频、低能量超声联合微泡对肿瘤的作用[1-3]后发现,低频、低能量超声联合微泡可诱导某些肿瘤细胞的自噬及凋亡。
前列腺癌是发病率较高的男性恶性肿瘤。在美国,占男性癌症死因的第二位[4]。大多数患者经治疗后由激素敏感性变为激素抵抗性,成为激素非依赖性或难治性前列腺癌[5]。本实验拟用原子力声显微镜及电镜观察低频低能量超声联合微泡对激素非依赖性人前列腺癌细胞系DU145及正常永生化的前列腺上皮细胞系RWPE-1的作用。
1 材料与方法
1.1 材料
前列腺癌细胞株DU145(科院细胞库)及前列腺正常上皮细胞系RWPE-1(上海生博生物医药科技有限公司);超声波治疗仪由超声波发生器、单路功放及圆形平面换能器组成,输出功率可调,本实验发射频率为21 kHz,直径为13 mm;Veeco DI 3100型原子力显微镜,探针型号1:SICON-200,弹性常数为0.02~0.8 N/m,谐振频率为5~25 kHz;探针型号2:ACT-200,弹性常数为25~75 N/m,谐振频率为200~400 kHz;压电片;HiRox (KH-7700)数字体式显微镜;微泡使用Bracco公司声诺维,为SF6微泡,直径为2~8 µm,使用前生理盐水5 ml稀释振荡;其他试剂及仪器:角化细胞-SFM,重组上皮生长因子1-53 (EGF 1-53),牛垂体提取物(Bovine Pituitary Extract, BPE)(Gibco,美国);1640培养液(Hyclone公司);胎牛血清(杭州四季青生物制品研究所);0.25%胰酶(Gibco,美国)。
1.2 实验方法
1.2.1 细胞样本制备方法
DU145细胞培养在含10%胎牛血清的1640培养液中,37℃、5%CO2培养箱中培养,每2~3天传代一次;RWPE-1细胞培养在K-SFM(500 ml内含有25 mg BPEJ及2.5 µg EGF)中,37 °C、5%CO2培养箱中培养,每2~3天传代一次;以盖玻片为细胞黏附底物,玻片边长21 mm,透明白色,硼硅玻璃。盖玻片在乙醇中浸泡15 min后,取用无菌PBS溶液稀释过的浓度为100 µg/ml多聚赖氨酸0.25 ml,滴在准备好的无菌盖玻片上4 °C过夜,使多聚赖氨酸黏附在盖玻片上。第二天吸去多余的多聚赖氨酸溶液,把盖玻片用无菌蒸馏水浸洗两次。空气干燥并紫外线照射15 min后使用。将盖玻片置于六孔培养板中,各加入浓度为1×106个/ml的细胞1 ml,按照上述方法培养。将DU145与RWEP-1细胞按不同处理方法各分为三组:对照组、单纯超声组及超声联合微泡组。
1.2.2 超声辐照方法
室温下,将超声探头固定于不锈钢支架上,辐射面垂直向上,将装有盖玻片的六孔板的一个孔的中心置于超声换能器表面,板与换能器间涂有耦合剂,声强为0.113 W/cm2,占空比为30%,对于对照组,辐照0 min,加入相应的细胞培养液(100 µl/ml);对于单纯超声组,辐照2 min,加入相应的细胞培养液(100 µl/ml);对超声联合微泡组,辐照2 min,超声作用前向培养液内加入配置好的微泡悬液(100 µl/ml)。
1.2.3 原子力声显微镜(Atomic Force Acoustic Microscope, AFAM)观察
(1) 细胞表面形貌的观察。超声辐照处理后即刻观察。细胞表面用1号探针形貌扫描。对于对照组直接取出盖玻片,用滴管取蒸馏水冲洗玻片3次,干燥后置于AFAM试样台上,在接触模式下调节各项参数并下针扫描;单纯超声组超声辐照后观察;超声联合微泡组加入微泡超声辐照后,按照同样方法观察以获得细胞表面形貌像。
(2) 液态环境下用2号探针测量细胞的弹性模量。对于对照组直接取出盖玻片,盖玻片上滴上培养液,放置于AFAM试样台上,对细胞核中心区域作力曲线,设置悬臂梁最大弯曲量即Trigger Threshold为150 nm,采用Ramp Plot得到力曲线;对于单纯超声组,按照前述方法进行超声辐照后取出按照同样方法观察;对于超声联合微泡组,加入微泡后按照前述方法进行超声辐照后取出按照同样方法观察。每组选取五个细胞。得到力曲线图后,为了减小黏附性对弹性模量(杨氏模量)产生的误差,选用逼近力曲线,并沿用前人在试验过程中采用公式的Hertz接触模型计算弹性模量(杨氏模量)[6]。
1.2.4 透射电镜
各组细胞辐照后放置24 h,用细胞刮将玻片上的细胞刮下,将培养液离心,制备超薄切片后在透射电镜下观察。
1.3 数据分析
2 结果
2.1 AFAM细胞形态观察
原子力声显微镜扫描时是结合了光学显微镜,挑选出目标细胞进行扫描。如图1所示,A1~C1及A2~C2分别为对照组、单纯超声组、超声联合微泡组的DU145细胞的形貌图像及三维立体图像。对照组的细胞形态椭圆,细胞膜光滑完整,细胞核居中;单纯超声组细胞形态相对饱满,细胞膜光滑完整,细胞膜表面可见细小的孔状结构,直径约1 µm;超声联合微泡组的细胞呈圆形,细胞膜似不完整,可见放射状纤维样物质,细胞表面有多个孔状结构,直径约5 µm。如图2所示,D1~F1及D2~F2分别为对照组、单纯超声组、超声联合微泡组的RWPE-1细胞的高度图像及三维立体图像。对照组细胞呈长椭圆形,细胞膜光滑完整,细胞核居中,细胞间见显微结构相连;单纯超声组细胞呈长椭圆形,膜光滑完整;超声联合微泡组细胞呈类圆形,细胞表面可见放射状显微丝状结构,细胞膜表面可见多个大孔状结构,直径约6 µm。
2.2 AFAM液态环境下测量细胞的杨氏模量
细胞表面形貌成像后对细胞核中心区域作力曲线,运用公式计算其杨氏模量。对数据进行检验。DU145细胞及RWPE-1细胞的超声联合微泡组的杨氏模量与各自对照组相比,差异有统计学意义(=0.02、=0.048);DU145细胞及RWPE-1细胞的单纯超声组与对照组的杨氏模量均无统计学差异(=0.121、=0.542);RWPE-1细胞的超声联合微泡组的杨氏模量与单纯超声组杨氏模量差异有统计学意义(=0.02、=0.09);DU145细胞与RWPE-1细胞的对照组细胞的杨氏模量差异有统计学意义(=0.042);DU145细胞与RWPE-1细胞的超声联合微泡组细胞的杨氏模量差异无统计学意义(=0.199)。细胞的杨氏模量均数及标准差如表1所示。
表1 细胞的杨氏模量均数及标准差±s
Table 1 Mean and standard deviation of cell Young's modulus
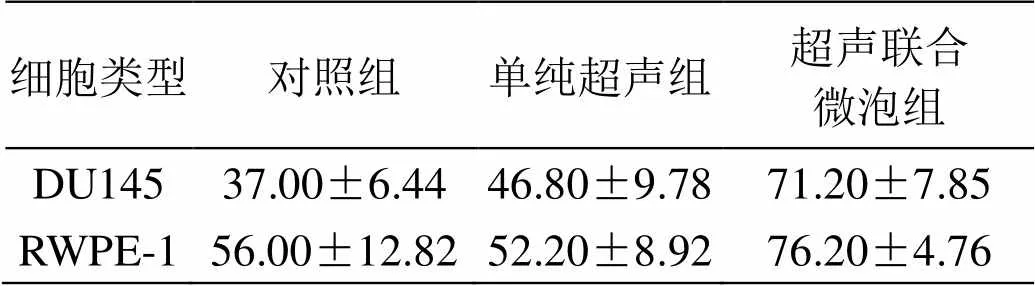
表1 细胞的杨氏模量均数及标准差±s
细胞类型对照组单纯超声组超声联合微泡组 DU14537.00±6.4446.80±9.7871.20±7.85 RWPE-156.00±12.8252.20±8.9276.20±4.76
2.3 透射电镜观察细胞自噬
将DU145细胞及RWPE-1细胞的空白对照组及低频低能量超声联合微泡组细胞进行透射电镜观察。空白对照组的DU145细胞和RWPE-1细胞的细胞膜完整,细胞核无变化;DU145的低频低能量超声联合微泡组细胞的细胞膜完整,细胞核未见明显改变,胞质内见多个囊样结构,内包裹部分细胞器,部分囊状结构为自噬泡,部分为自噬溶酶体。经过低频低能量超声联合微泡处理过的DU145细胞可见部分细胞出现细胞质浓缩,细胞核呈波纹状或呈折缝样,部分细胞核的染色质高度凝聚、边缘化,呈细胞凋亡的表现,而超声联合微泡组的RWPE-1细胞未见此表现。
3 讨论
本实验用原子力声显微镜及电镜观察低频低能量超声联合微泡对前列腺癌细胞系DU145及正常前列腺上皮细胞系RWPE-1的作用。原子力声显微镜可对细胞表面形貌进行纳米分析并测量细胞弹性。其可直接扫描细胞,从而避免了细胞制备过程中的复杂步骤,并可对活细胞进行观察[7]。本研究中,通过其对各组细胞的分析(图1及图2)发现,单纯超声作用后细胞的表面形貌变化不明显,而超声联合微泡组细胞形态饱满,细胞表面出现直径约5~6 µm的孔状结构,部分细胞包膜外见放射状的显微丝状结构。通过液相下接触模式,同时对各组细胞的弹性模量进行了测量。从数据可以得出前列腺癌DU145细胞相比正常的前列腺上皮细胞弹性大,单纯超声作用后细胞弹性模量变化不显著,而超声联合微泡作用后两种细胞弹性都变小,且超声联合微泡作用后的前列腺癌细胞较正常前列腺上皮细胞变化幅度更大,这可能与超声联合微泡作用后细胞内微丝变化有关[8-10],在一定范围内,细胞硬度增加可能表明细胞受到了损伤[11],这可能表示超声联合微泡对Du145细胞的作用强于RWPE-1细胞。在观察到单纯超声对细胞作用不明显后,采用透射电镜观察对照组及超声联合微泡组细胞的变化,可见DU145细胞及RWPE-1细胞在超声联合微泡作用后都出现了自噬现象(见图3)。自噬作为细胞在应激反应时机体所发生的一种适应性变化,在营养条件充足时,基本不出现在细胞中。自噬的发生常常有利于细胞生存,因为自噬的基本功能是将细胞的某些结构降解后再利用为细胞提供能量和物质[12,13]。可推测超声联合微泡对细胞造成损伤后,细胞通过自噬自我修复,而自噬的发生于细胞膜表面出现的孔状结构,是否由于部分膜蛋白的改变而诱导,还需要进一步的实验探索。同时在超声联合微泡作用后的DU145细胞中发现部分细胞出现细胞质浓缩,细胞核呈波纹状或呈折缝样,部分细胞核的染色质高度凝聚、边缘化,呈细胞凋亡的表现[14],而RWPE-1细胞中未见明显凋亡细胞,同时综合考虑超声联合微泡作用后它们的弹性模量的变化,我们可以得出超声联合微泡对DU145细胞的作用大于RWPE-1细胞。
图3(a) 对照组的Du145细胞的透射电镜图像
Fig.3(a) TEM images of DU145 cell in control group
图3(b) 对照组的RWPE-1细胞的透射电镜图像
Fig.3(b) TEM images of RWPE-1 cell in control group
图3(c) 超声联合微泡组的Du145细胞的透射电镜图像,图中可见自噬溶酶体或自噬泡(箭头所示)
Fig.3(c) TEM images of DU145 cell treated with ultrasound combined with microbubbles, showing autophagy lysosome or autophagic vacuoles (arrows)
图3(d) 超声联合微泡组的RWPE-1细胞的透射电镜图像,图中可见自噬溶酶体或自噬泡(箭头所示)
Fig.3(d) TEM images of RWPE-1 cell treated with ultrasound combined with microbubbles,showing autophagy lysosome or autophagic vacuoles (arrows)
从实验结果可以得出,低频低能量超声联合微泡可以引起前列腺癌DU145细胞及前列腺正常上皮细胞RWPE-1的自噬,使细胞弹性模量发生改变,且诱导了DU-145凋亡,但却未诱导正常前列腺上皮细胞发生凋亡,低频低能量超声联合微泡似乎是潜在的治疗前列腺癌的新方法。
4 结论
综上,低频低能量超声联合微泡可引起前列腺癌DU145细胞及正常前列腺上皮RWPE-1细胞的细胞膜出现孔状结构,并诱导其自噬,且对DU145细胞的损伤大于RWPE-1细胞。
[1] Yoshida K, Obata K, Tsukamoto A, et al. Limited damage of tissue mimic caused by a collapsing bubble under low-frequency ultrasound exposure[J]. Ultrasonics, 2014, 54(6): 1603-1609.
[2] XU W P, SHEN E, BAI W K, et al. Enhanced antitumor effects of low-frequency ultrasound and microbubbles in combination with simvastatin by downregulating caveolin-1 in prostatic DU145 cells[J]. Oncol Lett, 2014, 7(6): 2142-2148.
[3] ZHANG B, ZHOU H S, CHENG Q, et al. Overexpression of HSP27 in cultured human aortic smooth muscular cells reduces apoptosis induced by low-frequency and low-energy ultrasound by inhibition of an intrinsic pathway[J]. Genet Mol Res, 2013, 12(4): 6588-601.
[4] American Cancer Society website. Cancer Facts & Figures 2014. [EB/OL].[2014-03-08].http://www.cancer.org/research/cancerfactsstatistics/cancerfactsfigures2014/index
[5] ZHU Y, WANG H K, QU Y Y, et al. Prostate cancer in East Asia: evolving trend over the last decade[J]. Asian J Androl, 2015 Jan-Feb; 17(1): 48-57.
[6] CostaK D. Single-cell elastography: probing for disease with the atomic force microscope[J]. Disease markers. 2004, 19(2): 139-154.
[7] Ebert A, Tittmann B R, Du J, et al. Technique for rapid in vitro single-cell elastography[J]. Ultrasound Med Biol, 2006, 32: 1687-1702.
[8] Dulinska I. Stiffness of normal and pathological erythrocytes studied by means of atomic force microscopy[J]. J Biochem Biophys Methods, 2006, 66(1-3): 1-11.
[9] Cross S E, Jin Y S, Lu Q Y, et al. Green tea extract selectively targets nanomechanics of live metastatic cancer cells[J]. Nanotechnology, 2011, 22(21): 215101.
[10] 张晶, 张柏林, 唐纪琳, 等. 免疫毒素LHRH-PE40对HeLa细胞表面硬度的影响[J]. 分析化学, 2014(6): 811-816.
ZHANG Jing, ZHANG Bolin, TANG Jilin, et al. Impact of immunotoxin LHRH-PE40 on surface hardness of HeLa cell[J]. Chinese Journal of Analytical Chemistry, 2014(6): 811-816.
[11] Suresh S. Nanomedicine: elastic clues in cancer detection[J]. Nat Nanotechnol, 2007, 2(12): 748-9.
[12] Gomez-Cambronero J, Kantonen S. A river runs through it: how autophagy, senescence, and phagocytosis could be linked to phospholipase D by Wnt signaling[J]. J Leukoc Biol, 2014, 95(5): 779-784.
[13] Deretic V. Autophagy in immunity and cell-autonomous defense against intracellular microbes[J]. Immunol Rev, 2011, 240(1): 92-104.
[14] Ghavami S, Hashemi M, Ande S R, et al. Apoptosis and cancer: mutations within caspase genes[J]. J. Med. Genet, 2009, 46(8): 497-510.
The effect of low-frequency ultrasound combined with microbubbles on human prostate cells
CHEN Yi-ni, BAI Wen-kun, HU Bing
(Department of Ultrasound in Medicine, The 6th People’s Hospital Affiliated to Shanghai Jiaotong University, Shanghai Institute of Ultrasound in Medicine, Shanghai 200223, China)
Objective: To explore the impact of 21 kHz low-intensity ultrasound combined with microbubbles on both DU145 cells and RWPE-1 cells by using Atomic force acoustic microscope (AFAM) and Transmission electron microscopy (TEM). Methods: Both DU145 cells and RWPE-1 cells were divided into three groups: control group, ultrasound group and ultrasound combined with microbubbles group. Conditions of the low-frequency and low-energy ultrasound (US) irradiation were: Frequency, 21 kHz; Exposure time, 2 min at a duty ratio of 30%; and the valid treatment time of 84 seconds was used for the combination with microbubbles (100µl/ml). Cells of different groups were imaged in cover slips by AFAM immediately after the intervention. Twenty-four hours after intervention, TEM was used to observe cells. Results: Cellular membrane and three-dimensional structure of both cells showed significant difference in ultrasound combined with microbubbles group compared with control group, while no difference in ultrasound group compared with control group. Compared with control group, the elasticity modulus of both cells in ultrasound combined with microbubbles group was higher, and also the elasticity modulus of DU145 cells was higher than RWPE-1 in ultrasound combined with microbubbles group. Lots of autophagosomes or autolysosomes were detected by TEM in both cells in ultrasound combined with microbubbles group. TEM also demonstrated some apoptosis of DU145 cells in ultrasound combined with microbubbles group. Conclusions: The low-frequency ultrasound combined with microbubbles can induce autophagy in both DU145 cells and RWPE-1 cells, and the injury to DU145 cells is more serious than to RWPE-1 cells.
low-frequency ultrasound;microbubble contrast agent;prostate cancer;Atomic Force Acoustic Microscope(AFAM);autophage
TB566
A
1000-3630(2015)-04-0333-05
10.16300/j.cnki.1000-3630.2015.04.008
2014-12-23;
2015-02-17
国家自然科学基金项目(81401421)、教育部项目(20120073120100)、上海市科委自然基金面上项目(12ZR1422600)资助。
陈旖旎(1989-), 女, 福建建瓯人, 硕士研究生, 研究方向为原子力声显微镜的应用。
胡兵, E-mail: binghu_stephen@163.com

