氧化铜纳米颗粒的环境影响及其生态毒理效应综述
付昕 葛泰根 朱方等

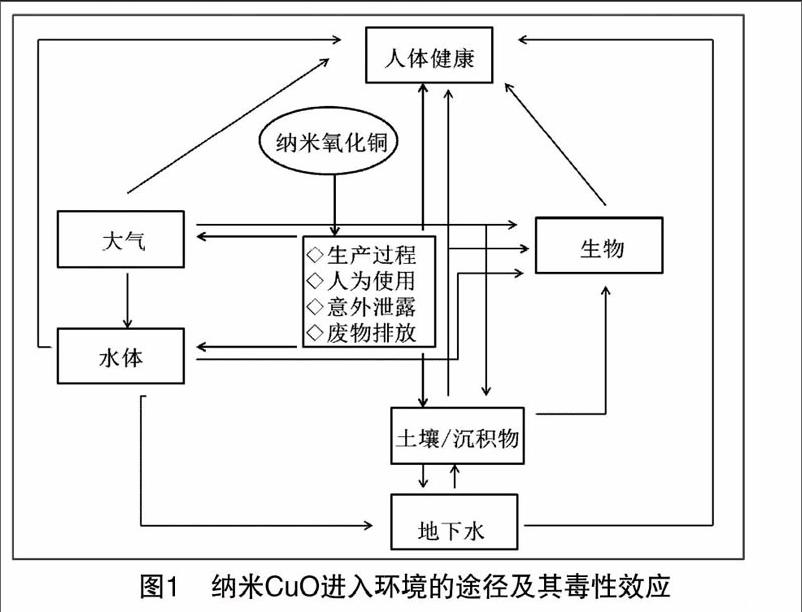
摘要: 随着纳米科技的迅猛发展,多种纳米材料被广泛应用并逐步进入到周围的环境及生命体中,纳米材料的生物安全性和生态毒理学效应逐渐成为国内外关注的热点。纳米氧化铜(CuO)因具有良好的杀菌性、催化特性、热稳定性而被广泛应用于涂料、废水处理、杀菌、生物医用陶瓷材料等领域,因此它将不可避免地进入环境和生态系统中,并引起相应的环境毒理效应。本文从流行病学调查和试验研究2个方面出发,综述了纳米CuO对细胞(细胞膜、细胞生长、凋亡)、生物体(肺、肝、肾)、生态系统的影响,探讨其产生毒性的可能机制,并对其毒性研究的前景进行展望。
关键词: 纳米氧化铜;环境健康;生态毒理;细胞;生物体;综述
中图分类号: TQ131 2+1;X171 5 文献标志码: A
文章编号:1002-1302(2015)08-0340-04
伴随着纳米科技的快速兴起与发展,在20世纪80年代末、90年代初期,种类繁多的纳米科技产品迅速走进了人们的视野。科学家们对纳米技术的发展作了预言:纳米科技的发展将会给社会带来非常大的经济利益,能够促进先进材料的制造、新型能源的开发、生物技术的发展、疾病的诊断和治疗等 [1]。纳米材料由于尺寸较小、化学组成与结构的特殊性,以及不同于以往传统材料的特殊物理化学特性(如小尺寸效应、大比表面积、高表面界面效应、高量子尺寸效应、高量子隧道效应等),目前已经被广泛应用于医药、电子、能源、环保、通讯、化妆品、航空航天、材料等领域。纳米材料在生活、工作中的广泛运用,使得人类与其接触的机会大大增加,因此纳米材料逐步渗透到人类的生存环境和生态系统中。由于纳米材料本身所具有的特殊性,它们易于与生物体的细胞器、细胞、组织器官,甚至是蛋白质这类大分子物质等相互作用,可能造成细胞以及组织器官的功能异化,从而给生物体的健康带来诸多影响。因此,纳米材料是否会给人们的生活工作环境带来污染、是否会对生物体的健康带来影响、是否会造成生态环境的破坏这一系列问题引起了各国研究者及政府部门的广泛关注 [2-4],对纳米材料的生物安全性进行评价已成为当务之急。目前广泛应用的纳米材料主要有以下几大类:碳纳米管(CNTs)、富勒烯(fullerene)、量子点(QDs)、金属氧化物(氧化铁、二氧化钛、氧化铜)等 [5],其中纳米氧化铜(CuO)是应用最广泛的纳米材料之一。易于形成片状结构,较薄的纳米片向各个方向生长,经缠绕交织而形成花状、蒲公英状、管状、伞状、线状、棒状等结构。由于具有良好的催化活性、热传导性及气敏性,目前纳米CuO已被大量开发生产,广泛用于电池、太阳能转换、气体传感器、微电子、传导液、杀菌、新型的催化剂(取代贵金属)、化妆品等与人们生产生活息息相关的行业中。纳米CuO被认为是在21世纪应用最广泛的新材料、新产品,下面简要介绍纳米CuO在相关行业中的应用。
1 1 新型催化剂
在有机化学反应中,纳米CuO是最为广泛使用的催化剂。甲醇作为新兴的生物质能源,是当今的研究热点,为了实现其能源的快速完全转化,有利于促进能量的完全释放,将纳米CuO加入到甲醇的氧化反应中。在纳米CuO的催化作用下,甲醇在210~220 ℃时的转化效率达到90%,远高于添加其他纳米材料。
在生物科技领域,纳米CuO可催化氨基酸并使其发光,实现对氨基酸的检测。有研究者利用低温固相法所制得的纳米CuO来催化精氨酸天冬氨酸的鲁米洛化学发光体系,经过对比发现,相对于分析纯CuO、Cu 2+,纳米CuO的催化活性分别提高了5 65、4 51倍 [6]。此外,在检测氨基酸方面,纳米CuO也表现出了较高灵敏度,可作为氨基酸检测的新型方法。
1 2 杀菌作用
目前被采用的抗菌剂大部分为光催化类抗菌剂,这种抗菌剂多数是属于宽禁带的n型半导体氧化物,半导体的能带结构通常是由1个充满电子的低能价带(valenee band,VB)和空的高能导带(conduetion band,CB)构成,二者之间存在禁带。当能量大于或等于半导体带隙能的光波辐射时,处于价带的电子(e-)就会被激发到导带上,价带生成空穴(h+),从而在半导体表面产生了具有高度活性的空穴电子对,并与环境中的O2、H2O 发生作用,细胞中的有机物分子与产生的活性氧自由基发生化学反应,从而达到杀菌的目的 [7]。CuO属于p-型半导体,自身存在空穴(CuO)+,可能与环境发生作用而起到抗菌或抑菌的作用。Mahapatra等采用液相法,Cu(OH)2 前驱体以碱式 CuCO3、NaOH为原料所获得,然后将其热分解得到纳米CuO,研究结果表明,纳米CuO对肺炎杆菌、绿脓杆菌有良好的抑菌作用 [8]。
1 3 传感器的应用
物理传感器、化学传感器是现阶段最主要的2类传感器。物理传感器是以外界的热、光、磁、温度、湿度等物理量为对象,将检出物理量转变成电信号的装置。化学传感器则是把特定化学物质的种类和浓度转化成电信号的装置,将敏感材料与待测物质的分子、离子等相互接触,根据电信号的变化来开发化学传感器。因此传感器能较为灵敏地反映外界环境中某些物质的变化,广泛应用于环境检测、气象预报、医疗诊断等方面。半导体金属氧化物CuO可作为还原性气体(CO、H2、CH4)和氧化性气体(NOx)检测的灵敏材料 [9]。此外,纳米CuO具有高比表面积、高表面活性、特异物性、小尺寸性等一系列特点,加上对于外界环境变化如温度、光、湿度等方面的灵敏反应,因此将纳米CuO包裹在其他材料的表面,将大大提高传感器对CO、乙醇的选择性,为检测环境质量提供了更为灵敏及先进的方法 [10-12]。
1 4 与其他材料复合
复合纳米材料由于具有单一纳米材料所不具备的特点而受到人们的普遍关注,纳米CuO与其他材料复合而形成的复合材料具有良好的物理特性。
作为催化剂,纳米CuO的催化活性点很低,而与其他材料复合后,例如CuO/CeO2在160 ℃且存在H2的情况下,CO有很高的催化活性和选择性,其催化活性远高于相同条件下制备的Co/Mn [13]。纳米CuO与其他材料所得的复合材料不仅可以作为CO与氮氧化物的氧化、还原催化剂,还可充当挥发性有机气体、甲烷燃烧的催化剂。在复合材料中添加适量的CuO,可以提高甲烷的起始燃烧温度达到350 ℃,完全燃烧温度达到630 ℃,使用这种复合材料将会大大提高染料的燃烧率,从而节省能源。此外复合纳米材料具有一定的热稳定性,当焙烧温度达到800 ℃,复合材料仍具有较好的催化活性 [14]。白守礼等通过合成3种不同CuO复合材料,分别为CuO/Al2O3、CuO/CeO2、CuO/SiO2,对比这3种复合材料的气敏活性结果表明,复合氧化物的比表面积对CO、H2的灵敏度都显著提高,这可能是由纳米氧化复合物之间的电子相互作用和化学叠加效应所造成的 [15]。endprint
2 纳米CuO的安全性研究
由于纳米CuO在各个领域被广泛研究和应用,纳米CuO逐渐被大量生产,导致越来越多的工作人员、研究人员、生产者、消费者都会无法避免地大量接触到纳米CuO。同时,纳米CuO也会伴随其生产过程,通过大气、土壤、废物处理、水体、食物链等多种途径进入环境及生命体中,所产生的环境影响和生态毒理效应引起了广泛的关注。在目前的研究中,对于纳米CuO的安全性依然没有进行全面的测评,下面将从生物体、生态系统2个方面对其进行测评。
2 1 纳米CuO对细胞的影响
由于纳米材料具有与生物分子相似的尺寸,当进入生物体后很容易进入到细胞中;因此,小粒径的纳米颗粒不仅易穿透细胞膜,而且不易被巨噬细胞及树突状细胞所吞噬,使得其毒性可能会对细胞的生长、代谢甚至 DNA、RNA产生影响。
2 1 1 纳米CuO跨膜转运 细胞膜作为防止细胞外物质自由进入细胞的保护屏障,保证了细胞内环境的相对稳定,使各种生化反应能有序进行。外源物质穿过细胞膜通常有3种途径:被动运输、主动运输、内吞与外排作用。采用透射电子显微镜观察发现,纳米CuO能穿过人体肺表皮细胞(A549)而进入细胞内部,在细胞质、溶酶体、线粒体甚至细胞核中都发现有纳米CuO的存在 [16-17]。研究者通过透射电子显微镜观察经过纳米CuO处理的A549细胞发现,其细胞形态发生了明显变化,同时由于初级溶酶体过多的蛋白质累积导致次级溶酶体的产生和累积。以上研究结果也间接证明了纳米CuO进入细胞可能是通过内吞作用,而并非通过被动扩散作用。
2 1 2 抑制细胞生长 目前对于纳米材料的毒性评价主要有2种方式:体内试验、体外试验。体内试验更接近生物真实的暴露情况,而体外试验主要是纳米材料对细胞造成的毒性作用,用细胞存活率、细胞膜完整性通透性的改变、氧化胁迫等指标来进行检测。细胞存活率是细胞毒性研究最常用的指标,近年来研究者通过体外试验发现,用纳米CuO处理的人体肺表皮细胞(A549)的细胞存活率随着纳米CuO浓度的升高而逐渐降低,呈现明显的剂量依赖效应。此外,研究者选取了其他纳米材料(圆柱形的硅纳米颗粒 [18]、壳聚糖纳米颗粒 [19]、硅包覆的磁性纳米颗粒 [20])与纳米CuO进行毒性对比,发现纳米CuO的IC50值远低于这3种纳米材料,说明纳米CuO具有更高的毒性,造成这一现象的原因可能有2个:(1)通过电镜观察发现纳米CuO的粒径处于20~40 nm,均小于圆柱形的硅纳米颗粒[(214±29) nm]、 壳聚糖纳米颗粒(>109 nm)、包覆的磁性纳米颗粒 (50 nm);(2)金属氧化物的纳米材料在完全细胞培养液中会释放出金属离子,这些金属离子也会对人体细胞产生毒性作用 [21-23]。
2 1 3 引起细胞凋亡 通过透射电子显微镜观察可发现,纳米CuO处理后的细胞体积变小、变形,细胞膜完整但出现发泡现象,此外细胞核核仁消失、凋亡小体可见;进行凝胶电泳检测发现,DNA出现梯状的随机断裂,这一系列现象说明细胞发生凋亡。为了进一步地验证纳米材料对于细胞凋亡的影响,很多研究者选择具有代表性的凋亡基因(P53、bax、bcl-2、caspase-3),经过实时荧光定量(quantitative real-time PCR分析发现,经过处理后的细胞凋亡基因的表达量明显与对照组具有显著性差异 [24]。这些基因表达量的变化有利地证明了纳米CuO引起的细胞凋亡不仅体现在细胞形态的变化上,甚至对基因表达产生了损伤。
2 2 纳米CuO对生物体的影响
2 2 1 纳米CuO对肺部的损伤 肺脏是环境中有害物质进入人体之后最容易沉积的重要器官,纳米颗粒由于粒径较小,吸入后很容易沉积在肺中,从而引起相应的病理损伤和炎症反应。国际放射线防护委员会(ICRP)的研究表明,纳米颗粒可通过呼吸作用在人类的呼吸道及肺泡中沉积。经研究统计发现,粒径为1 nm的颗粒90%左右可以在鼻咽部沉积,其余10%沉积在气管支气管区;粒径在5~10 nm的颗粒,沉积在上述3个部分的比例均为20%~30%;粒径为50 nm的颗粒,约有50%沉积在肺泡中。Ram等采用支气管注入法将试验动物成年大鼠暴露于含有纳米CuO的环境中,按照大鼠体质量分别以1、5 mg/kg染毒24 h、7 d,结果发现染毒24 h后大鼠肺泡出现急性炎症反应,同时形成肺大泡、空泡化,表现出肺组织损伤;处理7 d后,肺部出现单核细胞浸润、肉芽肿、淋巴聚集等现象 [25]。这些结果都表明,纳米CuO具有较强的炎症潜力,同时受损伤的组织会产生不可逆转的慢性病灶如纤维化、肉芽肿等。纳米颗粒通过呼吸作用进入肺泡后,附着在肺泡表面的难溶颗粒有的以主动运输的方式通过细胞膜进入细胞,以致引起细胞的病变;有的可到达淋巴腺或随淋巴液循环进入血液,在血液和体液的带动下,进一步转运至心脏、肝脏、肾脏,甚至到达中枢神经系统中,引起相应的毒性症状,如心血管系统疾病、肝功能失调、肾脏疾病等。
2 2 2 纳米CuO在肝、肾中的富集 肝脏作为体内最主要的解毒器官,承担了分解外来异物的主要功能,随后在血液的带动下,将分解后的毒物及杂质输送到肾脏,经肾小球、肾小管过滤后排出体外,可见肝脏是维持生物体生命活动和新陈代谢稳态的最重要的器官,也是外来异物作用的靶器官。Lei等采用经口一次性染毒的CuO纳米颗粒,分别设置50、100、200 mg/kg 3个浓度梯度,5 d后发现大鼠在高浓度组处理下出现体质量下降、嗜睡、低通气、震颤以及背部拱起等症状 [26]。后经临床生化指标检测发现,其中天冬氨酸转氨酶、谷丙转氨酶、血浆代谢产物胆红素明显高于对照组,这些指标均说明大鼠肝脏已发生病变,引起肝功能损伤。为了进一步验证,通过病理学观察发现,大鼠肝脏在高浓度时已经坏死,且肝细胞体积增大,细胞核消失,胞质透明,呈现中央静脉周围细胞水样变性的特征,位于肝门区的大量淋巴细胞浸润;肾近曲小管坏死,坏死面积已扩展至肾全部,甚至在管腔中发现细胞碎片,可观察到蛋白质样物的沉淀。可见肾脏、肝脏是纳米CuO在生物体内的重要靶器官。endprint
2 3 纳米CuO对生态系统的影响
随着纳米技术的发展,纳米材料被普遍生产和研究,同样也必将在生产、运输、使用、废物降解等多个过程中进入大气、土壤、水体、生物体等组成的整体生态系统中。即便目前对纳米材料在这些程序中的储蓄、释放程度还不是完全明了,但它们会不断地通过在整体大的生态系统的各环节中潜在地蓄积,在无生命的空气和水中逐步积累后,以多种途径进入生物体,在特定组织(器官)中不断增加浓度,进而与生物大分子相结合,产生显著的生物毒性效应。此外,它们还可以通过运动迁移和扩散,实现远距离输送传播,对生态系统中的大范围的群体或个体生物带来不同程度的影响。
金盛杨等对土壤生态系统进行研究,选择了土壤系统氮循环过程中参与其中的土壤脲酶,发现该酶通过专性水解尿素等有机氮源而释放出铵,从而调节土壤肥力。将土壤加入到1~1 000 mg/kg纳米CuO悬液中,在37 ℃黑暗中培养 24 h,在 1~1 000 mg/kg范围内,纳米CuO 对土壤脲酶活性产生了显著(P<0 05)或极显著(P<0 01)的抑制效应;在相对低浓度下,纳米CuO对土壤脲酶活性具有抑制效果;在相对高浓度下,纳米CuO引起了脲酶活性抑制。由此可以推测,纳米CuO对土壤酶具有高毒性效应,从而在进入土壤系统后会破坏土壤质量;另一方面,纳米CuO释放出的Cu 2+会富集于农作物当中,进一步进入人体,从而损害人体健康。
Aruoja等研究了纳米CuO对水生微型藻(Pseudokirchneriella subcapitata)的影响,发现纳米CuO会造成微型藻的死亡,不仅是因为纳米CuO释放出的Cu 2+,导致呈剂量反应关系,而且是由于纳米CuO的悬液会聚集成团,使得阳光不能透过,因缺乏阳光而不能进行光合作用并产生营养物质 [28]。
3 纳米CuO的毒性作用机制
目前对于纳米CuO的生物毒性作用机制尚未完全明了,但是通过国内外研究现状说明,氧化应激反应及活性氧(ROS)的大量产生可能是最主要的毒性作用机制 [29]。
就材料本身的特性来讲,纳米材料颗粒拥有较大的比表面积及较小的尺寸。尺寸越小,越易进入机体;而比表面积越大,当与机体接触时,机体表面的活性点就越多,从而沉积在组织器官内。虽然纳米材料的毒性不能仅靠其小尺寸效应来解释,但可以确定的是:颗粒的尺寸越小,越易沉积于细胞及组织当中而不被巨噬细胞所清除。
纳米颗粒的大比表面积和单位质量内较多的粒子数目,使得纳米颗粒的表面反应活性成倍增高,远远超过常规材料;与常规材料相比,纳米颗粒表面更容易产生具有高活性的自由基 [30-31]。自由基能够诱导细胞的氧化损伤和炎症反应,激活与免疫相关的一些分子的合成和释放。此外,纳米颗粒的表面基团决定着其电子特性,比如亲电子的表面基团可以与分子氧(O2)反应而生成超氧阴离子( O-2[KG- 2]· )自由基,进而通过Fenton歧化反应生成 ROS。ROS的产生可以与细胞中的DNA发生作用,进而对DNA造成氧化损伤 [32-34]。根据研究发现,CuO最初暴露于A549细胞时即产生了大量的ROS;随着处理时间的延长,启动了细胞内的 p53/p38 基因的表达 [35-36],其介导的细胞信号转导途径在调节细胞正常生命活动中起重要作用,对受到损伤的DNA进行修复;染毒细胞随着染毒时间的增加,发生了DNA链的断裂并产生了DNA氧化损伤物(8-OHdG)。以上研究结果均说明,纳米CuO产生的生物毒性效应与ROS的产生有一定的关系。
4 结论
纳米CuO由于具有良好的催化活性、电学、材料学等方面的性能,在许多领域得到了广泛应用。目前更多的研究集中在对水生藻类 [37]、细胞 [38-39]等的毒性效应;缺少纳米CuO对环境、生态系统群体、个体的生物影响的相关研究。对于纳米CuO在生态系统中的释放过程、运输模式、降解时间、生物毒性、在生物体内的富集等方面缺乏系统的研究。
目前仍须进一步解释纳米CuO环境健康和生态毒理方面的问题包括以下4个方面:(1)量化纳米CuO的生产以及在空气、土壤、水生态系统中的释放过程,可为深入彻底地研究纳米CuO的在环境中的形态转换及迁移途径提供相应的理论基础;(2)采用慢性毒性试验以及选择相应的受试生物,有助于人们全面了解纳米材料的潜在危害,为进行环境健康安全暴露评价提供相应依据;(3)研究纳米CuO的毒性作用不应仅局限于斑马鱼等模式生物中,更应深入到分子水平,从而从分子及基因水平研究纳米CuO的毒性作用机制;(4)制定纳米材料环境安全性评估方法和评估标准,须要纳米材料的生产者、管理者及毒理学研究者密切合作,最终建立一套相对全面、系统的纳米材料安全评价标准,以指导纳米CuO的安全生产和合理使用。
参考文献:
[1] 白春礼 纳米科技及其发展前景[J] 科学通报,2001,46(2):89-92
[2]Colvin V L The potential environmental impact of engineered nanomaterials[J] Nature Biotechnology,2003,21(10):1166-1170
[3]Rice R F American chemical society meeting Nanomaterials show signs of toxicity[J] Science,2003,300(5617):243
[4]Dowling A Nanoscience and nanotechnologies:opportunities and uncertainties[R] London:The Royal Society & The Royal Academy of Engineering Report,2004:61-64endprint
[5] Leonard S,Bradford S Nano technology-life-cycle risk management[J] Human and Ecological Risk Assessment,2006,12(3):528-551
[6]Cao Y,Casenas B,Pan W P Investigation of chemical looping combustion by solid fuels 2 Redox reaction kinetics and product characterization with coal,biomass,and solid waste as solid fuels and CuO as an oxygen carrier[J] Energy Fuels,2006,20(5):1845-1854
[7]Zheng S F,Hu J S,Zhong L S,et al Introducing dual functional CNT networks in to CuO nano microspheres toward superior electrode materials for lithium-ion batteries[J] Chemistry of Materials,2008,20(11):3617-3622
[8]Mahapatra O,Bhagat M,Gopalakrishnan C,et al Ultrafine dispersed CuO nanoparticles and their antibacterial activity[J] Journal of Experimental Nanoscience,2008,3(3):185-193
[9]杜建平,薛永强,王志忠.纳米氧化铜的制备新方法及应用[J] 山西化工,2004,24(3):3-7
[10] Frietsch M,Zudock F,Goschnick J,et al CuO catalytic membrane as selectivity trimmer for metal oxide gas sensors[J].Sensors and Actuators B:Chemical,2000,65(1):379-381
[11]Kim Y S,Hwang I S,Kim S J,et al CuO nanowire gas sensors for air quality control in automotive cabin[J] Sensors and Actuators B:Chemical,2008,135 (1):298-303
[12]Chowdhuri A,Gupta V,Kumar R,et al Improved response of H2S gas sensors with CuO nanoparticleson SnO2 film[J] Proceedings of IEEE,2003(1):201-205
[13]Muiz J,Marbán G,Fuertes A B Low temperature selective catalytic reduction of NO over modified activated carbon fibres[J] Applied Catalysis B-Environmental,2000,27 (1):27-36
[14]崔梅生,杨 东,何柱生,等 氧化铈负载CuO催化材料对甲烷燃烧的催化作用[J] 中国稀土学报,2004,22(5):605-608
[15]白守礼,马丽景,闫 涛,等 纳米复合金属氧化物的制备、表征和气敏性质研究[J] 自然科学进展,2004,14(7):833-836
[16] Wang Z,Li N,Zhao J,et al CuO nanoparticle interaction with human epithelial cells:cellular uptake,location,export,and genotoxicity[J] Chemical Research in Toxicology,2012,25(7):1512-1521
[17]Simon-Deckers A,Gouget B,Mayne-L′hermite M,et al In vitro investigation of oxide nanoparticle and carbon nanotube toxicity and intracellular accumulation in A549 human pneumocytes[J] Toxicology,2008,253(1/2/3):137-146
[18]Herd H L,Malugin A,Ghandehari H Silica nanoconstruct cellular toleration threshold In vitro[J] Journal of Controlled Release,2011,153(1):40-48
[19] Huang M,Khor E,Lim L Y Uptake and cytotoxicity of chitosan molecules and nanoparticles:effects of molecular weight and degree of deacetylation[J] Pharmaceutical Research,2004,21(2):344-353endprint
[20]Kim J S,Yoon T J,Yu K N,et al Cellular uptake of magnetic nanoparticle is mediated through energy-dependent endocytosis in A549 cells[J] Journal of Veterinary Science,2006,7(4):321-326
[21]Moriwaki H,Osborne M R,Phillips D H Effects of mixing metal ions on oxidative DNA damage mediated by a Fenton-type reduction[J] Toxicology in Vitro,2008,22(1):36-44
[22]Deng X Y,Luan Q X,Chen W T,et al Nanosized zinc oxide particles induce neural stem cell apoptosis[J] Nanotechnology 2009,20(11):115101
[23]Xia T,Kovochich M,Liong M,et al Comparison of the mechanism of toxicity of zinc oxide and cerium oxide nanoparticles based on dissolution and oxidative stress properties[J] ACS Nano,2008,2(10):2121-2134
[24]Masud A,Kuida K,Lakhani S A,et al Caspases 3 and 7:key mediators of mitochondrial events of apoptosis[J] Science,2006,311(5762):847-851
[25]Ram V S,Kumar A K,Kumar C P,et al Pulmonary toxicity of copper oxide (CuO) nanoparticles in rats[J] Journal of Medical Science,2013,13(6):571-577
[26]Lei R,Wu C,Yang B,et al Integrated metabolomic analysis of the nano-sized copper particle-induced hepatotoxicity and nephrotoxicity in rats:a rapid in vivo screening method for nanotoxicity[J] Toxicology and Applied Pharmacology,2008,232(2):292-301
[27]金盛杨,王玉军,汪 鹏,等 纳米与微米CuO及Cu 2+对土壤脲酶的生态毒性比较研究[J] 生态毒理学报,2010,5(6):835-841
[28]Aruoja V,Dubourguier H C,Kasemets K,et al Toxicity of nanoparticles of CuO, ZnO and TiO2 to microalgae Pseudokirchneriella sub
capitata[J] The Science of the Total Environment,2009,407(4):1461-1468
[29]Nel A,Xia T,Mdler L,et al Toxic potential of materials at the nanolevel[J] Science,2006,311(5761):622-627
[30]Donaldson K,Stone V,Clouter A,et al Ultrafine particles[J] Occupational and Environmental Medicine,2001,58(3):211-216
[31]Oberdrster G,Oberdrster E,Oberdrster J Nanotoxicology:an emerging discipline evolving from studies of ultrafine particles[J] Environmental Health Perspectives,2005,113(7):823-839
[32]Sharma V,Shukla R K,Saxena N,et al DNA damaging potential of zinc oxide nanoparticles in human epidermal cells[J] Toxicology Letters,2009,185(3):211-218
[33]Eom H J,Choi J p38 MAPK activation,DNA damage,cell cycle arrest and apoptosis as mechanisms of toxicity of Silver nanoparticles in jurkat T cells[J] Environmental science & technology,2010,44(21):8337-8342
[34]Yang H,Liu C,Yang D,et al Comparative study of cytotoxicity,oxidative stress and genotoxicity induced by four typical nanomaterials:the role of particle size,shape and composition[J] Journal of Applied Toxicology,2009,29(1):69-78 [HJ1 8mm]endprint
[35]Zhang C,Zhu H,Yang X,et al P53 and p38 MAPK pathways are involved in MONCPT-induced cell cycle G2/M arrest in human non- small cell lung cancer A549[J] Journal of Cancer Research and Clinical Oncology,2010,136(3):437-445
[36]Livak K J,Schmittgen T D Analysis of relative gene expression data using Real-Time quantitative PCR and the 2 ΔΔCT method[J] Methods,2001,25(4):402-408
[37]Tubbing D M J,Admiraal W,Cleven R F M J,et al The contribution of complexed copper to the metabolic inhibition of algae and bacteria in synthetic media and river water[J] Water Res,1994,28(1):37-44
[38]Reeves J F,Davies S J,Dodd N J,et al Hydroxyl radicals (·OH) are associated with titanium dioxide (TiO2) nanoparticle-induced cytotoxicity and oxidative DNA damage in fish cells[J] Mutat Res,2008,640(1/2):113-122
[39]Wang Y,Aker W G,Hwang H M,et al A study of the mechanism of in vitro cytotoxicity of metal oxide nanoparticles using catfish primary hepatocytes and human HepG2 cells[J] The Science of the Total Environment,2011,409(22):4753-4762endprint

