癌症探秘(中)



这种饱受期待的疗法导致多名患者死亡。它一落千丈却又东山再起,原因很简单——它不仅治愈了一些疑难病,而且有望在治疗癌症方面显身手。
在美国作家丹尼尔·凯斯1966年所著小说《献给阿尔吉侬的花》(改编成的同名电影后来获得奥斯卡奖)中,32岁的主人翁查理·戈登是一名精神病患者,其病因是一种无法治愈的苯丙酮尿症。这种绝症由一个基因的缺失引起,这个基因为代谢苯基丙氨酸的酶解码。如果苯丙酮尿患者吃含有苯基丙氨酸的东西,这种化合物及其副产品就会在患者的血液里堆积,并且变得有毒,由此造成大脑损伤、色素丧失、痉挛及其他一系列问题。
在小说里,通过接受一种实验性的外科手术来提升自己的智力,戈登最终战胜了这种遗传病。而在现实中,苯丙酮尿患者的经历与此截然不同——他们必须严格坚持低蛋白质饮食,避开所有包含苯基丙氨酸的食物,例如一切肉类、奶制品、坚果、豆类、豆腐及人造甜味剂——阿巴斯甜。
对苯丙酮尿的理想疗法,或许是介于危险的大脑手术和严格的饮食限制之间。事实上,真正的理想疗法或许是补充那个缺失的基因,从而让该病患者能像正常人那样享受高蛋白食物。由于基因治疗(即向患者的细胞中添加新基因,替换缺失或失灵的基因)方面的进展,这种看似不可能的梦想或许很快将成为现实。
从20世纪90年代的黑暗时期开始(当时,这种各方期待的疗法导致多名患者死亡),基因疗法已经走过了一条长路。在过去20多年中,科学家在这方面取得了许多新认识,其中最重要的也许是:基因疗法在纸面上容易描述,但在人类细胞中施行起来却要难得多。而值得庆幸的是,一些决心已定的科学家们一直试图攻克这个难题,他们对于让基因疗法带来现代医疗革命满怀期待与信心。
在了解基因疗法之前,让我们首先学习一些有关DNA和基因表达的基础知识。或许你在高中生物学课堂上已经了解了有关基因的常识,但在这里我们不妨对此作扼要重述。基因是指遗传信息的一个单元,它控制某种特定的活动或特征。基因存在于染色体中,染色体则位于细胞核内。染色体包含DNA长链,这些长链由被称为核苷酸基(或简称核苷酸)的亚基(或称亚单元)构成。核苷酸基为特定的蛋白质充当模板。在细胞里,这个模板经过多步骤的过程组建而成。其中第一个过程称为转录。当一个DNA分子释放并充当一个模板,以创制一条信使RNA链时,转录过程就开始了。随后,信使RNA游离出细胞核,进入细胞质,在那里附着到一个被称作核糖体的结构上。储存在信使RNA中的基因序列(也称遗传密码,它本身就反映出DNA密码),决定着一个精确的氨基酸序列。这一步骤被称为转译,正是它制造了一条氨基酸长链,即一个蛋白质。
蛋白质是细胞的主力。它们负责建造生理基础设施,但它们也控制和调节重要的代谢通道。如果一个基因功能失灵,例如其核苷酸基序列被搅乱,那么就无法制造或准确制造相应的蛋白质。科学家把这称为变异,而变异可造成包括癌症和苯丙酮尿在内的种种问题。
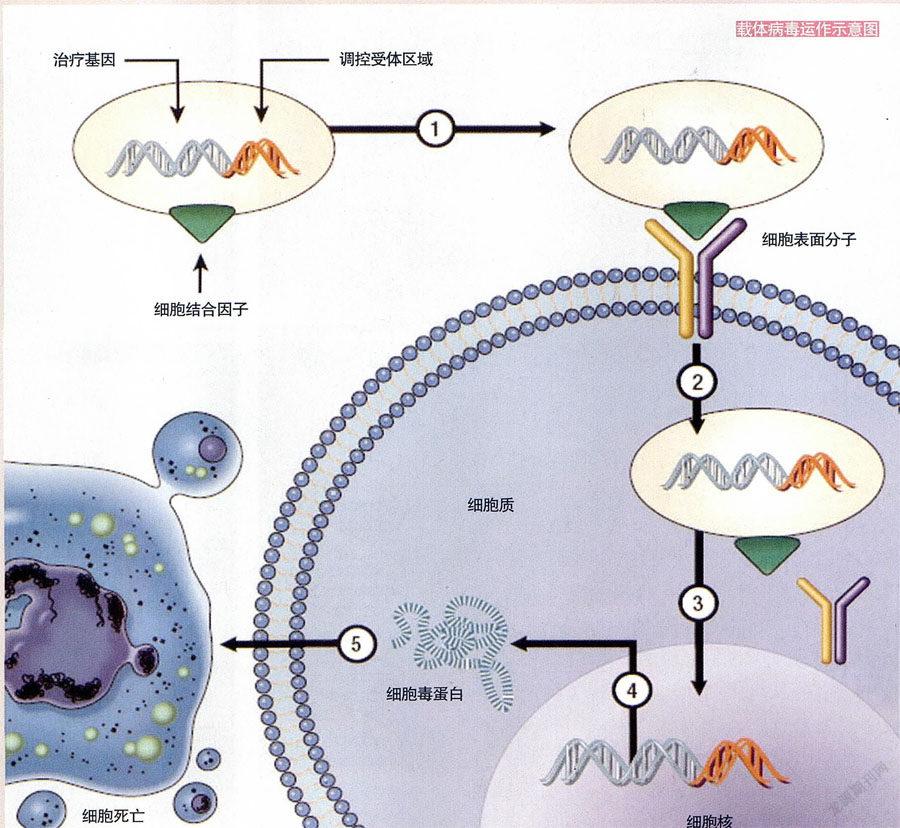
基因疗法试图恢复或替换缺陷型基因,让细胞恢复制造缺失蛋白质的能力。在纸面上,这非常简单明了:只需把一个基因的正确版本注入一条DNA长链。而在现实中,由于细胞需要某种外部辅助(以一个病毒的形式),基因疗法的实施变得有些复杂了。你可能会认为,病毒只是会引起感染(例如天花、流感、狂犬病或艾滋病等)的因子。但在基因疗法中,科学家使用“依然活着却又死了”的微小病毒颗粒,为一个细胞实施“基因大改组”。
病毒充当载体
病毒已经让科学家困扰了多年。他们能看到病毒的效果——疾病,但他们无法分离病毒。起初,他们以为同自己打交道的是非常小的细菌细胞。然后,在对病毒的研究大潮中,美国科学家文德尔·斯坦利在1935年让引起烟草花叶病的颗粒结晶,这也是在全球首次描述病毒。这些奇异的颗粒没有细胞核或其他细胞结构,但它们拥有核酸——要么是RNA,要么是DNA。这小小一包遗传信息被包裹在一只蛋白质衣壳中。在一些情况下,则被包裹在一只膜包膜中。
与其他生物不同,病毒不能自行复制,这是因为它们不具备必需的细胞机制。然而,如果病毒侵犯一个细胞,并且借助细胞的器材和酶,那么病毒就能复制。这一基本过程是:病毒进入宿主细胞,释放自己的核酸和蛋白质;宿主细胞酶并没有把病毒DNA或RNA视为外来物,从而愉快地制造它们的大量额外拷贝;与此同时,宿主的其他细胞酶把病毒核酸转录成信使RNA,后者则充当模板,制造更多的病毒蛋白质;利用新鲜的核酸供给,以及由宿主细胞制造的蛋白质,新的病毒颗粒自我组建;病毒离开所在细胞,到其他宿主那里重复前述过程。
正是病毒把遗传信息带到细胞里去的能力,使得病毒在基因疗法中大有用场。如果用一个人类基因的DNA替换病毒DNA的一个片段,然后让这个病毒感染一个细胞,情况会怎样呢?宿主细胞是否会复制被引入的基因,然后遵循基因模板,制造相关的蛋白质?科学家发现,这完全可行——前提是改造病毒,阻止它引起疾病,或诱导宿主的一种免疫反应。经过这样的修改后,病毒就变成了一种载体,可用于实施一种特定的基因疗法。
今天,科学家使用多种类型的病毒作为载体。他们采用过的载体之一是腺病毒(它是造成人类普通感冒的病毒之一)。腺病毒把自己的DNA引入细胞核中,但这个DNA并不整合进染色体。这让腺病毒成为还算不错的载体,但它们通常会激发一种免疫反应,就算腺病毒已被弱化也一样。作为另一种选择,科学家可能会依赖腺病毒相关病毒。它们是腺病毒的更友好、更温柔版本,尚未发现它们会引起人类疾病。不仅如此,腺相关病毒还会把自己的基因整合进宿主染色体,这有可能使得细胞复制被插入的基因,并且把它传递给已改变的细胞的未来几代。诸如导致艾滋病及某些类型肝炎的逆转录酶病毒,也会让自己的基因材料片段进入自己所侵犯的细胞染色体内。因此,科学家深入研究了把逆转录酶病毒用作基因疗法载体的可能性。
体外基因疗法
基因疗法这个理念已在科学家们的脑海中存在了几十年时间。美国遗传学家爱德华·塔图姆在1966年率先提出,基因性疾病或许可通过“基因工程”来治疗。同一年,另一名美国人约舒华·雷德伯格在自己发表于《美国自然学家》杂志上的一篇论文中,勾勒了“病毒基因疗法”的细节。由此,多名科学家努力研究把基因疗法从概念推进到现实。1972年,美国生物化学家保罗·博格研发出剪掉人类DNA的一个片段、并把它注入一个病毒的基因组的办法。接着,他用这样的病毒感染细菌细胞。最终,他得以让细菌产生人胰岛素。10年后,美国人罗纳德·伊文斯把负责老鼠生长激素的基因注入一只逆转录酶病毒,接着又把这个基因导入老鼠细胞。
所有这些尝试,为一场基因疗法革命奠定了基础。由美国食品和药物管理局(简称FDA)批准的首次基因疗法试验,开展于1990年。这次试验聚焦于重症综合性免疫缺陷(简称SCID)患者,这种病也被称为“泡泡男孩病”。此病患儿、美国男孩戴维·维特不得不一直住在无菌环境——一个塑料泡泡中,直到他1984年死于12岁。
在这场试验中,科学家使用了体外基因疗法。首先,他们把一根特制的针插进患者的股骨中采集骨髓。接着,在实验室中,他们让来自于骨髓的干细胞暴露在逆转录酶病毒面前。这些病毒的RNA已经过修改,从而含有与SCID相关的基因。病毒感染干细胞,并且把这种功能性基因插入宿主染色体中。下一步,科学家提取经过基因改造的干细胞,把它们重新注入患者的血液中。这些细胞径直朝着骨髓而去。与所有功能良好的干细胞一样,这些细胞也成熟,并且成为不同的细胞类型,其中包括健康的T细胞,这些T细胞都携带必需基因的功能正常的拷贝。运用这种技术,数十名SCID患儿被彻底治愈。不过,这并非是基因学家用来治疗的唯一疾病,也不是唯一的基因方法。
生殖细胞基因疗法
迄今为止,科学家一直把他们的基因疗法实验集中于体细胞(即除了生殖细胞之外的人体所有细胞)。换句话说,这些实验不能被传递给患者的孩子。在理论上,有可能操纵卵细胞或精细胞的DNA,这样的DNA能让经过基因改造的基因传递给未来几代人。这种所谓的“种系基因疗法”引发了一系列有关伦理问题的担忧。对于那些希望获得美国联邦基金资助的科学家来说,这种基因疗法还不能进行。
体内基因疗法
实施基因疗法的第二种常见方式,是把携带所需基因的病毒直接注入有缺陷的细胞所在区域。20世纪90年代,美国宾夕法尼亚大学病理学及实验室医学教授詹姆斯·威尔逊成为这种所谓的“体内基因疗法”的先锋。他运用逆转录酶病毒作为载体,但他弱化了病毒,以限制受体的免疫反应。在初期测试中,经过改造的病毒看来未对接受治疗者造成任何损害,就连普通感冒也没有。这意味着,这种办法能可靠地传递基因,同时又没有什么副作用。
1999年,威尔逊领导了基于逆转录酶病毒的基因疗法的第一期临床试验,目的是治疗一种罕见的基因疾病——鸟氨酸转氨甲酰酶(简称OTC)缺乏症。OTC是一种帮助身体分解多余氮的酶。没有了它,氨水平会持续上升,直到引起大脑中毒。X染色体上的一个单一基因为OTC解码,使得此基因成为这种实验疗法的一个理想候选对象。威尔逊把这个OTC基因注进已被弱化的逆转录酶病毒颗粒,然后把这些颗粒注入18名患者的肝脏。
这种理念很简单:病毒感染肝细胞;肝细胞开始复制OTC基因,并开始制造OTC酶。不幸的是,其中一名18岁患者——杰西·基辛格在接受经过改造的病毒注射3天后死亡。科学家现在相信,基辛格的身体发动了强烈的免疫反应,引起大面积器官衰竭,从而导致死亡。
基因疗法引发伦理争议
基因疗法的安全性仅仅是问题的一部分。许多人质疑:改造某人的基因,在道德上正确与否?他们想知道:谁来决定哪些基因是“好”的?或者,哪些基因是“坏”的?他们还疑惑基因疗法的成本问题:如果这种疗法的价格很高,许多低收入者会怎样?要是有人想通过基因疗法来修改非致命性人类特征,例如身高、智力或体育能力,又会怎样?这些问题和人们对病毒生理学或基因插入及表达机制的关切一样重要。
基因疗法的安全性
杰西·基辛格之死震惊了美国公众,也在整个科学界引发了冲击波。科学家们开始痛苦地意识到,基因疗法纸上谈兵很容易,实施起来却面对诸多挑战与陷阱。不管他们实施基因疗法的方式如何——是体外疗法还是体内疗法,实际上都带有潜在的风险。
对体内基因疗法来说,最大问题是患者的免疫系统。人体把逆转录酶病毒样颗粒(哪怕是携带人类基因的这样的颗粒)视为外来物。当这些颗粒进入宿主细胞时,宿主的回应是发动反击以除掉这些入侵者。这正是发生在杰西·基辛格身上的情况。他的免疫系统并不明白这些病毒是来帮忙的,因而发起了猛烈的攻击,甚至在此过程中关闭了他的脏器。今天,科学家或许会给予他较低的治疗剂量,或者使用免疫抑制药物对他进行预防性治疗。另一种选择是探索使用“裸”DNA,就是被去掉了病毒载体的核酸分子。
依赖逆转录酶病毒的体外基因疗法也有自己的问题。请记住,逆转录酶病毒把自己的DNA缝合进宿主的染色体,这有点像取出一个句子当中的一个短语,并且把它插入一个更长的句子当中。如果插入的地方不对,其形成的“语言”就可能没有意义。在使用逆转录酶病毒的一些基因疗法试验中,患者出现了白血病及其他形式的癌症,原因是插入一个基因时扰乱了周围其他基因的功能。
在SCID基因疗法试验中,这样的并发症影响了多个孩子。好在科学家运用其他疗法,战胜了他们中许多人的癌症。但正由于这样的问题,FDA现在通过自己的一个机构——“生物制剂评估与研究中心”管理全美国的基因疗法产品和服务。对于那些有兴趣研发人类基因疗法产品和服务的科学家及生产商,该中心则提供前摄的(指前一活动中的因素对后一活动造成影响的)科学性及调控性建议。在运用基因疗法进行临床试验时,美国和国外的这方面投资者也可获得美国“国立健康研究院”的建议与指引。不过,迄今为止,“生物制剂评估与研究中心”尚未批准过任何基因疗法产品上市。但是,多项正在进行中的这方面试验,正在产生有希望的结果。
基因疗法能治哪些病?
在杰西·基辛格死后,FDA禁止詹姆斯·威尔逊再对人体进行基因疗法试验。不过,其他研究者不受此限制。2007年,美国宾夕法尼亚大学医学院的分子基因学家及内科医生简·本内特及其丈夫艾伯特·马奎尔(宾夕法尼亚州儿童医院的视网膜外科医生)开始基因疗法临床试验,目的是研究这种疗法对一种罕见的眼盲症——先天性黑朦(简称LCA)的疗效。RPE65基因的一个变异,导致对视网膜来说很重要的一个蛋白质缺失。缺乏这个蛋白质的人会逐渐丧失视力,直到完全失明,而失明通常在40岁就会发生。
马奎尔夫妇把RPE65基因插入一只腺病毒相关病毒。接下来,他们以低剂量把经过基因改造的病毒注入3名患者的视网膜。这些病毒感染视网膜细胞,这些细胞开始产生RPE65蛋白质。结果,3名患者的视力都改善了,而且没有出现副作用。该团队决定开展更大规模的试验,且加大病毒剂量。结果,又有6名LCA患者接受了基因治疗,并且获得了更好的疗效。
SCID和LCA是运用基因疗法成功治疗的为数不多的疾病。然而,基因学家和分子生物学家对于采用基因疗法治愈更多疾病胸有成竹。詹姆斯·威尔逊目前继续致力于在该领域的探索。他已经分离了120类腺相关病毒,其中许多在一些组织中的表现比在其他组织中更有效。例如,其中一些载体对心脏组织有亲和性,另一些则对脊髓和大脑细胞有亲和性。未来的研究,也许将带来对脊柱损伤和帕金森病等疑难病的有效疗法。
在体外基因疗法方面,科学家们也正在大步前进。2013年7月,美国《科学》杂志发表了调查使用慢病毒属作为基因疗法载体的两项研究结果,它们的独特之处在于它们能在分裂和非分裂的细胞中有效,并且永久性地传导基因。其他逆转录酶病毒则必须对分裂的细胞实施“基因巫术”。或许更重要的是,当把自己的载荷注入宿主DNA时,慢病毒属看来不太容易激活其他的癌症相关基因。科学家采用基于慢病毒属的基因疗法治疗肾上腺脑白质营养不良(一种影响年轻男性、伴X染色体的神经退行性疾病)和异染性脑白质营养不良(一种由一个单一基因变异引发的罕见的退行性疾病),结果表明这两种疑难病都不再发展,而且没有有害的副作用。
未来,其他有希望的基因疗法一定会出现。它们针对的大多是遗传病,例如囊胞性纤维症、肌肉萎缩症、镰状细胞性贫血和血友病等。甚至就连苯丙酮尿症也会让基因疗法转变成过去式。如果真是这样,查理·戈登一定会非常开心。
基因疗法与癌症
基因疗法涉及向细胞注入基因材料,赋予细胞新功能或恢复细胞缺失的功能。科学家认为癌症也可能是由基因受损或缺失引起的。我们的基因遗传自父母,基因决定我们的特质。基因由生物学分子——脱氧核糖核酸(DNA)和核糖核酸(RNA)构成。DNA和RNA负责蛋白质的制造。这些蛋白质具有许多功能,例如帮助细胞维持形状,或控制细胞生长与分裂等。基因的改变(即变异)可能会影响蛋白质,有时候这可能引发疾病,例如癌症。科学家发现,复合晚期癌症变异基因(MMAC1)参与了一些常见癌症。他们还成功修复了参与人类肺癌的一个有缺陷的肿瘤抑制基因——p53。
癌症的基因疗法也分体外疗法和体内疗法。体外疗法涉及从患者体内提取一些癌细胞,向它们注入好基因,然后再把它们送回体内。体内疗法是把好基因直接注入肿瘤内,但这种疗法的效果取决于确定癌瘤位置和癌症是否已转移。在癌症基因疗法中,科学家通常使用两类细胞——癌细胞自己和攻击癌细胞的免疫系统细胞。
美国“圣迭戈健康系统”的“穆尔斯癌症中心”的科学家们,目前正在研发针对乳腺癌、皮肤癌、白血病和胰腺癌的基因疗法。例如,他们已经介入抗体药物赫赛丁的研发。这种靶向药物正在被证明对没有扩散的人类表皮生长因子受体-2(HER2)型乳腺癌有效。HER2控制着细胞生长、分裂及自身修复。科学家们也已经在把一种改造过的疱疹病毒注入黑素瘤(一种皮肤癌)的癌瘤内部,旨在改善机体对这种癌症的免疫防御能力。
一种被称为“TNFerade生物制剂”的基因疗法,涉及一个包含肿瘤坏死因子基因α的DNA载体。这种免疫系统蛋白质有强力抗癌作用。科学家正在研究联合运用TNFerade与放射疗法,用于对无法手术的胰腺癌患者的首次治疗。“TNFerade及疱疹攻略”使用基因疗法来提升主要机制的杀癌效果。所谓主要机制,包括在TNFerade当中采用放射和由病毒诱导的细胞溶菌作用(胞溶作用)。
在美国,使用基因疗法治疗癌症只能通过临床试验进行。那么,这样的临床试验是否有风险呢?答案是肯定的。病毒载体既影响癌细胞,也影响健康细胞。新基因可能会插到不正确的DNA位置,或者转移基因可能会被“过度表达”,产生过多的缺失蛋白,从而造成损害。总之,在接受癌症基因疗法之前,和其他任何接受基因疗法的患者一样,患者应该和医生讨论基因疗法涉及的所有风险。
(下期预告:本文涉及的靶向治疗正在成为一种越来越重要的癌症疗法,甚至有科学家相信,它最终可能取代传统的化疗、放疗和手术,成为癌症治疗的一线策略。那么,什么是靶向治疗?它的前景到底是怎样的?请关注本刊下期的相关文章。)

