无溶剂体系中固定化脂肪酶催化合成香茅醇酯
于 敏,周 华,任立伟,蒋振华,韦 萍
无溶剂体系中固定化脂肪酶催化合成香茅醇酯
于 敏,周 华,任立伟,蒋振华,韦 萍
南京工业大学生物与制药工程学院,江苏 南京 211800
在无溶剂体系中以大孔树脂NKA吸附固定的褶皱假丝酵母脂肪酶(Candida rugosa lipase)为催化剂,以脂肪酸为酰基供体,酶法合成香茅醇脂肪酸酯。考察了褶皱假丝酵母脂肪酶对酰基供体的选择性,以及反应温度、摇床转速、酶用量、底物比例及微量水添加等对酯化反应的影响,建立了无溶剂中香茅醇酯的酶法合成工艺。研究表明,在酸醇物质的量比为1,摇床转速为200 r/min,固定化酶用量为1 250 U/L,反应温度为50 ℃,微量水添加量为4 μL的条件下,反应10h,月桂酸香茅酯及油酸香茅酯的转化率分别可达95.6% 和87.6%,明显高于在有机溶剂体系中的酯化率。
香茅醇酯 脂肪酶 固定化 无溶剂 酶催化
香茅醇是一种具有新鲜玫瑰香气的萜烯醇,其脂肪酸酯也是重要的风味和芳香化合物,广泛应用于食品、饮料、化妆品及医药行业[1,2]。目前化学合成香料以其经济性和周期短等特点占据着较大的市场空间,但随着生活水平的提高,人们对天然高品质香料的兴趣逐渐增强,从自然界中提取已不能满足日益增长的消费需求,而生物法合成的香料被视为天然香料,其比化学法合成的香料更能满足消费者心理需求,因此生物法生产香料受到越来越多的关注。酶法合成香茅醇酯具有反应条件温和、产物纯度高和环境污染小等优点。上世纪90年代,已有关于有机溶剂中游离脂肪酶催化合成萜烯醇酯的报道[3],但游离酶在有机溶剂中分散性较差且不易回收利用,因而在随后的研究中逐渐被Novozyme 435和Lipozyme MML等固定化酶所取代[4,5]。Claon等[6]使用固定化脂肪酶SP435在正己烷中通过转酯化反应催化合成短链乙酸香茅酯,获得98%的酯化率,目前其他长链香茅酯的合成也多在有机相中进行[7,8]。除了传统有机相体系,超临界二氧化碳因与己烷等溶剂极性相近[9],具有类似气体的扩散性及液体的溶解能力,同时兼具低黏度和低表面张力的特性也迅速被用作酶催化反应的介质。曾健青等[9]利用Lipozyme IM在超临界CO2中催化油酸甲酯与香茅醇转酯化反应合成油酸香茅酯,实现酶促反应与分离一体化过程。近年来,离子液体的出现也为酶催化反应提供了新的发展契机,Lozano等[10]使用离子液体对Novozym 435进行包裹,提高了其催化合成丁酸香茅酯的反应速率。尽管在以上反应体系中香茅醇酯化率均比较高,但是有机溶剂的毒性与挥发性、离子液体复杂的制备过程以及超临界流体对反应设备的苛刻要求均制约了香茅醇酯的规模化制造,故发展更为环境友好的新型香茅醇酯制备反应体系显得尤为重要。
无溶剂体系中以低熔点反应物为反应溶剂,使酶直接作用于底物,加快了反应速率,且克服了有机溶剂毒性大、易燃易挥发、对环境造成污染及回收和循环使用成本高等缺点[11],是酶工程领域中具有良好发展潜力的新型反应体系。目前有关无溶剂体系中香茅酯合成的报道极少[10],通常需要使用昂贵的脂肪酸乙烯酯为酰基供体,酶种类单一,且未见使用褶皱假丝酵母脂肪酶(Candida rugosa lipase,CRL)在无溶剂体系中催化合成香茅酯的报道。本工作以大孔树脂吸附固定的褶皱假丝酵母脂肪酶为催化剂,在无溶剂体系中采用脂肪酸作为酰基供体,以提高酶法合成香茅酯酯化率为目标,建立绿色环保的香茅酯酶法制备工艺。
1 实验部分
1.1 固定化脂肪酶的制备
按照供应商提供的方法对载体大孔树脂NKA (购自南开大学化工厂)进行预处理。将适量褶皱假丝酵母脂肪酶(购自Sigma公司)溶解在pH值为5.0的磷酸盐缓冲液中,4 ℃下搅拌30 min,配制成4 mg/mL的粗酶溶液(实际蛋白质量分数为2.5%~3.0%),经4 ℃下10 000 r /min离心5 min以去除不溶物,取5 mL上清液与0.1 g上述载体混合。30 ℃吸附2h后,用砂芯漏斗抽滤,提取固定化酶,并用5 mL pH值为5.0的缓冲液冲洗固定化酶数次。用少量pH值为7.0 的磷酸盐缓冲液浸泡固定化酶20 min后再次抽滤,将固定化酶于30 ℃真空干燥48h,利用酶的“pH记忆性”将脂肪酶的构象调至最适宜催化的状态。固定化酶蛋白回收率为80%,测得干燥后的酶活为10 U/g。
1.2 脂肪酶活性的测定
以对硝基苯基乙酸酯(p-NPA)为底物,采用比色法测定游离和固定化脂肪酶的水解活性[12]。在37 ℃,pH值为7.0的条件下,1 min内水解产生1 μmol p-NPA所需要的酶量定义为一个活力单位(U)。
1.3 香茅醇酯的酶法合成
10 mL具塞锥形瓶中加入2 mmol脂肪酸与2 mmol β-香茅醇(纯度大于99.8%),放入恒温空气摇床预热后,加入干燥后的固定化脂肪酶,混匀后添加4 μL去离子水,于恒温摇床中反应2h后,加入0.5 g的4A分子筛以去除反应生成的过量水。在不同的反应条件(摇床转速、温度、底物比例和酶用量等)下进行实验。
1.4 酯化率的测定
对反应体系分析可知主要成分为香茅酯、游离脂肪酸及β-香茅醇的混合物。采用Agilent 6890气相色谱仪进行反应底物和产物定量分析,色谱条件如下:载气为N2;检测器为FID,210 ℃;气化室220 ℃;色谱柱为PEG-20M(15 m×0.25 mm×0.25 μm);柱室温度50 ℃,维持2 min,以20 ℃/min升温至200 ℃并维持3 min。通过内标法计算香茅醇的含量。香茅醇的酯化率通过测定反应前后反应体系中香茅醇的浓度变化换算而得。
2 结果与讨论
2.1 酰基供体对香茅醇酯化反应的影响
向10 mL反应瓶中各加入2 mmol脂肪酸与香茅醇,以0.5 U(约0.05 g)干燥后的固定化CRL为催化剂,在无溶剂体系中进行香茅醇酯的合成反应,采用的脂肪酸分别为乙酸、丁酸、己酸、辛酸、癸酸、月桂酸和油酸。由于月桂酸熔点为 44~46 ℃,癸酸的熔点为 31.5 ℃,为了保证不同脂肪酸体系都为均一液态体系,所以选择无溶剂体系反应温度为50 ℃,考察固定化CRL对脂肪酸的选择性,并探讨建立无溶剂反应体系的可行性。在摇床转速200 r/min下反应24h,结果如图1所示。由图可看出,乙酸和己酸在无溶剂体系中的酯化率均很低,主要是由于CRL对这两种酸的选择性较差所致[13]。丁酸的极性较强,催化过程中可能会剥夺CRL的“必需水”,因此酯化率也较低。辛酸、癸酸、月桂酸及油酸在无溶剂体系的酯化率分别可达70.12%,63.15%,95.56%和87.56%。其中月桂酸香茅酯酯化率最高,这可能是由于月桂酸与香茅醇等摩尔混合后体系的疏水参数(lgPm)接近于 4(lgP = x1lgP1+x2lgP2,其中x1和x2分别代表体系中两种物质的摩尔分数,P1和P2分别代表两种物质的疏水参数。乙酸、丁酸、己酸、辛酸、癸酸、月桂酸和油酸的lgP分别为2.78,2.03,2.59,3.12,3.64,4.17和5.52),能为脂肪酶提供适宜的催化环境[14],且CRL对较长碳链的脂肪酸选择性较高所致。
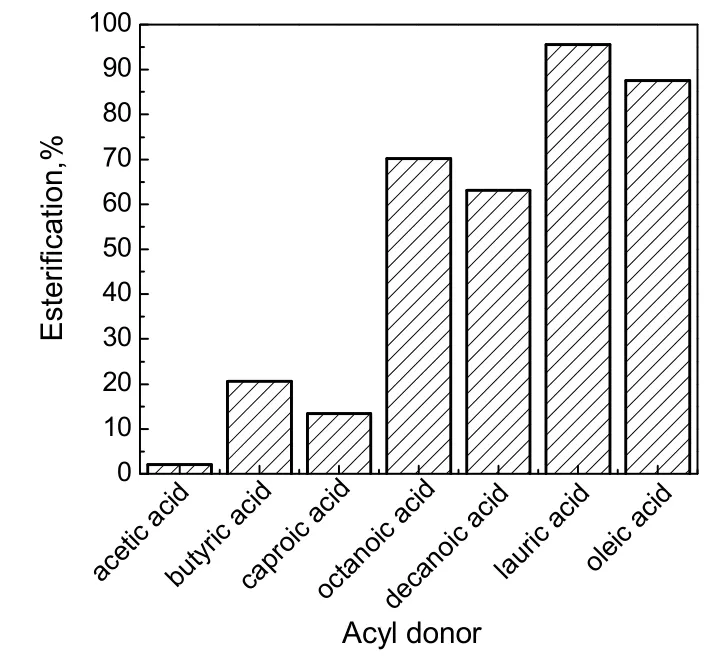
图1 不同脂肪酸对CRL催化合成香茅酯的影响Fig.1 Effect of different aliphatic acids on the synthesis of citronellyl ester catalyzed by CRL

图2 不同酰基供体对CRL催化合成月桂酸香茅酯的影响Fig.2 Effect of different acyl donors on the synthesis of citronellyl laurate ester catalyzed by CRL
以月桂酸香茅酯合成为例,比较月桂酸、月桂酸甲酯及乙酯以及月桂酸乙烯酯(活性酯)几类常用的酰基供体的作用效果,结果如图2所示。由图可看出,以月桂酸及月桂酸乙烯酯作为酰基供体时获得的酯化率较高,以月桂酸甲酯和月桂酸乙酯为酰基供体时,无溶剂体系中香茅醇的酯化率均低于30%。故以下研究中选择月桂酸作为酰基供体。
2.2 转速对香茅醇酯化反应的影响
摇床转速关系到反应体系中底物的传质,选择合适的转速既可达到所需的传质效果,又可节约能耗,故在无溶剂体系中考察了摇床转速对反应的影响,结果如图3所示。由图可看出,当无溶剂体系中摇床转速为200 r/min时混合传质效果较好,酯化率较高,这是因为无溶剂体系粘度较高,需要克服的传质阻力较大所致。当摇床转速达到240 r/min时,酯转化率略有降低。故200 r/min的转速已经可以满足体系反应要求。

图3 摇床转速对CRL催化合成月桂酸香茅酯的影响Fig.3 Effect of agitation speed on the synthesis of citronellyl laurate ester catalyzed by CRL
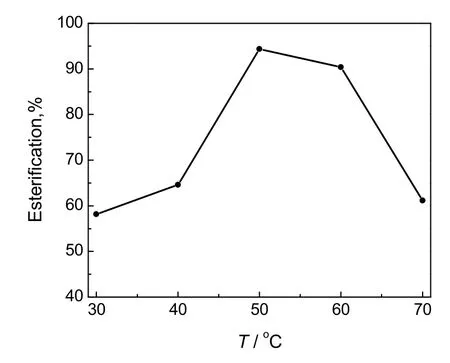
图4 温度对CRL催化合成月桂酸香茅酯的影响Fig.4 Effect of temperature on the synthesis of citronellyl laurate ester catalyzed by CRL
2.3温度对香茅醇酯化反应的影响
反应温度既能影响酶催化反应速率和脂肪酶的活性,也可以影响传质,反应温度对CRL催化合成月桂酸香茅酯的影响见图4。由图可看出,当温度为50或60 ℃时,该体系才具有较高的酯化率,这是因为在低于月桂酸熔点的温度下,月桂酸以固体形式存在并伴随反应的进行不断减少,在50或60 ℃时月桂酸以熔化形式存在,与香茅醇形成的均一液态反应体系有利于增大底物与酶的碰撞几率,从而使反应速率加快。此外温度的升高可使反应体系粘度降低而提高酯化效果,但是70 ℃的反应温度会严重影响脂肪酶的活性并造成酯化率降低,所以确定反应温度为50 ℃。
2.4 底物比例对反应的影响
通常底物比例可在一定程度上影响体系的最终转化率,实验考察了不同底物比例对月桂酸香茅酯酯化率的影响,结果如图5所示。由图可知,该固定化脂肪酶无溶剂体系在酸醇物质的量之比为1时即可获得最高的酯化率,主要原因是无溶剂体系增加了底物浓度,酸或醇过量都可能对脂肪酶产生更为显著的抑制作用,且在该体系中醇的抑制作用较酸更为显著;此外,该结果的获得与混合后反应体系的lgPm值接近于4,能为脂肪酶催化酯化反应提供适宜的疏水环境有关。

图5 底物比例对CRL催化合成月桂酸香茅酯的影响Fig.5 Effect of molar ratio of substrate on the esterification of citronellyl laurate ester catalyzed by CRL

图6 不同固定化酶量催化的酯化反应进程曲线Fig.6 Process curves of esterification catalyzed by different amounts of immobilized lipase
2.5 固定化脂肪酶用量对香茅醇酯化反应的影响
固定化脂肪酶用量对香茅醇酯化反应的影响如图6所示。由图可看出,酶用量较少时,随着酶用量的增加,反应到达平衡所需时间不断缩短,底物转化率也不断提高。当加入酶活为625 U/L时,反应的转化率可达95%左右的峰值。酶量的增加对酯化率提高作用不大,但能明显缩短反应时间,当酶用量为1 250 U/L时,达到95%的酯化率所需反应时间可由24h缩短至10h,反应效率提升显著。
2.6 微量水添加量对香茅醇酯化反应的影响
非水相催化过程中,一般认为酶分子需要结合微量“必需水”以满足活性构象的变化要求,只有达到最佳水含量的要求时,蛋白质结构的动力学刚性和热力学稳定性之间才能达到最佳平衡点。为此考察了不同初始水添加量对固定化脂肪酶无溶剂体系合成月桂酸香茅酯的影响,结果如图7所示。由图可看出,初始水添加量对非水体系中的酶促反应有一定影响,与正常情况下即不添加微量水(control)相比,当初始水添加量为4或10 μL时,酯化率较高,在95%左右。继续增加初始水添加量后,酯化率明显降低,当初始水添加量为50 μL时,酯化率降低至70%。在最适水添加量时,水分子主要充当“分子润滑剂”以维持酶的活性构象,当超过最适水添加量时,会促进酯的水解,且此时水化层厚度增加,而该反应的底物与产物在水相中的溶解性均较差,较厚的水化层会增加底物与产物的扩散难度,导致最终转化率下降。

图 7 初始水添加量对酯化率的影响Fig.7 Effect of initial water addition on esterification of citronellyl laurate ester catalyzed by CRL

图8 不同溶剂环境中的合成香茅醇酯结果Fig.8 CRL-catalyzed synthesis of citronellyl esters in organic solvent and solvent-free systems
2.7 有机溶剂及无溶剂体系中香茅醇酯合成结果比较
选择月桂酸及油酸为酰基供体,分别在有机溶剂及无溶剂体系中进行香茅酯合成。在酸醇物质的量比为1,加入5 mL有机溶剂(正己烷,正庚烷或异辛烷)与4 μL去离子水,酶浓度为1 250 U/L ,200 r/min,50 ℃反应10h后,香茅醇酯化效果如图8所示。由图可看出,在无溶剂体系中,月桂酸香茅醇酯和油酸香茅醇酯的酯化率分别达到95.6%和87.6%,月桂酸香茅醇酯的酯化率高于Serri等[7]报道的89%,油酸香茅醇酯酯化率高于曾健青等[9]在超临界CO2中获得的66.14%,而在有机溶剂中月桂酸香茅醇酯和油酸香茅醇酯的酯化率最高只有81.3%和80.1%,故对于月桂酸及油酸等中长链脂肪酸香茅酯的酶法合成而言,无溶剂体系的酯化效果明显优于有机溶剂体系,这与无溶剂体系中脂肪酸与香茅醇混合后体系的 lgPm有关,也与无溶剂体系增大了底物浓度有关。而且分析表明,采用固定化CRL进行香茅酯合成时,对于与香茅醇混合后能给脂肪酶提供适宜疏水环境的中长链脂肪酸而言,无溶剂体系比有机溶剂体系更具优势,可获得更高的酯化率,且可简化后续分离提纯过程。
3 结 论
以大孔树脂NKA吸附固定的CRL为催化剂,构建了无溶剂体系中香茅醇酯的绿色合成工艺。在底物物质的量之比为1,添加酶浓度为1 250 U/L的固定化CRL和4 μL微量水的条件下,50 ℃,200 r/min反应10h,月桂酸香茅酯酯化率可达95.6%,油酸香茅酯酯化率达87.6%,香茅醇酯的酯化率均高于有机溶剂体系中酯化率,表明本工作构建的无溶剂体系尤其适合于中长链脂肪酸香茅酯的酶法合成,且该反应体系具有条件温和、无溶剂挥发和产物更易分离提取等优势,是一条环境友好的酶法合成工艺,为优质萜烯酯香料的高效制备与应用奠定了基础。
[1]Yadav G D, Trivedi Ah. Kinetic modeling of immobilized-lipase catalyzed transesterification of n-octanol with vinyl acetate in non-aqueous media[J]. Enzyme and Microbial Technology, 2003, 32(7): 783-789.
[2]Melo L, Pastore G M, Macedo G A. Optimized synthesis of citronellyl flavour esters using free and immobilized lipase from Rhizopus sp[J]. Process Biochemistry, 2005, 40(10): 3181-3185.
[3]Nishio T, Takahashi K, Yoshimoto T, et al. Terpene alcohol ester synthesis by polyethylene glycol-modified lipase in benzene[J]. Biotechnol Letters, 1987, 9(3): 187-190.
[4]Garcia T, Sanchez N, Martinez M, et al. Enzymatic synthesis of fatty esters. part I. kinetic approach[J]. Enzyme and Microbial Technology, 1999, 25(7): 584-590.
[5]Fonteyn F, Blecker C, Lognay G, et al. Optimization of lipase-catalyzed synthesis of citronellyl acetate in solvent-free medium[J]. Biotechnol Lett, 1994, 16(7): 693-696.
[6]Claon P A, Akoh C C. Lipase-catalyzed synthesis of terpene esters by transesterification in n-hexane[J]. Enzyme and Microbial Technology, 1994, 16(3): 235-240.
[7]Serri N A, Kamaruddin Ah, Long W S. Studies of reaction parameters on synthesis of citronellyl laurate ester via immobilized Candida rugosa lipase in organic media[J]. Bioprocess and Biosystems Engineering, 2006, 29(4): 253-260.
[8]Yadav G D, Lathi P S. Synthesis of citronellol laurate in organic media catalyzed by immobilized lipases: kinetic studies[J]. Journal of Molecular Catalysis B: Enzymatic, 2004, 27(2): 113-119.
[9]曾健青, 张耀谋, 刘莉玫, 等. 酶促合成油酸香茅醇酯的超临界连续反应—分离过程[J]. 有机化学, 2000, 20(2): 195-197. Zeng Jianqing, Zhang Yaomou, Liu Limei, et al. The continuous reaction-separation process for the lipase-catalyzed synthesis of citronellyl oleate in supercritical CO2[J]. Chinese Journal of Organic Chemistry, 2000, 20(2): 195-197.
[10]Lozano P, Piamtongkam R, Kohns K, et al. Ionic liquids improve citronellyl ester synthesis catalyzed by immobilized Candida antarctica lipase B in solvent-free media[J]. Green Chemistry, 2007, 9(7): 780-784.
[11]辛嘉英, 郑 妍, 吴小梅, 等. 无溶剂体系脂肪酶催化制阿魏酸双油酸甘油酯[J]. 精细化工, 2007, 24(2): 172-177. Xin Jiaying, Zheng Yan, Wu Xiaomei, et al. Lipase-catalyzed synthesis of feruloyated dioleoylglycerol in solvent-free system[J]. Fine Chemicals, 2007, 24(2): 172-177.
[12]Ozyilmaz G. The effect of spacer arm onhydrolytic and synthetic activity of Candida rugosa lipase immobilized on silica gel[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 56(4): 231-236.
[13]Langrand G, Rondot N, Triantaphylides C, et al. Short chain flavour esters synthesis by microbial lipases[J]. Biotechnol Letters, 1990,12(8): 581-586.
[14]贺 芹, 徐 岩, 腾 云, 等. 华根霉全细胞脂肪酶催化合成生物柴油[J]. 催化学报, 2008, 29(1): 41-46.he qin, Xu yan, Teng yun, et al. Biodiesel production catalyzed by whole-cell lipase from Rhizopus chinensis[J]. Chinese Journal of Catalysis, 2008, 29(1): 41-46.
200 r/min, reaction temperature 50 ℃, the concentration of immobilized lipase 1 250 U/L, the addition of water 4 μL, citronellyl laurate and citronellyl oleate were achieved with esterification rate of 95.6% and 87.6%, respectively, after 10h of reaction, which was more superior than that in organic solvent system.
Synthesis of Citronellyl Esters Catalyzed by Immobilized Lipase in Solvent-Free System
Yu Min, Zhouhua, Ren Liwei, Jiang Zhenhua, Wei Ping
College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211800, China
The enzymatic synthesis of citronellyl esters by esterification of citronellol and fatty acids in a solvent-free system was discussed using Candida rugosa lipase (CRL) absorbed on macroporous resin NKA as catalyst. The conditions of enzymatic synthesis of citronellyl esters was optimized, including the selectivity of acyl donor, reaction temperature, enzyme dosage, molar ratio of substrate and micro-water addition. The results showed that under the conditions of molar ratio of acid to alcohol 1, agitation speed
citronellyl esters; lipase; immobilization; solvent-free; enzyme catalysis
Q814.9
A
1001—7631 ( 2015 ) 04—0373—06
2014-11-20;
2015-05-28。
于 敏(1991—),女,硕士研究生;周 华(1970—),男,教授,通讯联系人。E-mail: zhouhua@njtech.edu.cn。
国家重点基础研究计划(973)项目(2009CB724706)。

