HPLC测定蒲地蓝消炎片中紫堇灵的含量
覃华亮,韦怡
(1.广西壮族自治区柳州食品药品检验所,广西 柳州 545006;2.广西中医药大学 附属瑞康医院,广西 南宁 530011)
HPLC测定蒲地蓝消炎片中紫堇灵的含量
覃华亮1,韦怡2*
(1.广西壮族自治区柳州食品药品检验所,广西 柳州 545006;2.广西中医药大学 附属瑞康医院,广西 南宁 530011)
目的:建立蒲地蓝消炎片中紫堇灵含量的测定方法。方法:采用Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.015 mol·L-1磷酸盐缓冲液(pH 6.7)(70∶30),流速为0.8 mL·min-1,检测波长为289 nm,柱温为35 ℃。结果:紫堇灵进样量在0.141 5~0.377 3 μg与峰面积呈良好的线性关系(r=0.999 6);平均回收率为98.49%(n=6),RSD=0.45%。结论:该方法简便准确,分离度高,专属性强,重复性好,可用于蒲地蓝消炎片中紫堇灵的含量测定。
蒲地蓝消炎片;紫堇灵;高效液相色谱法;含量测定
蒲地蓝消炎片由黄芩、蒲公英、苦地丁、板蓝根组成,收载于《卫生部药品标准·中药成方制剂》(第三册),具有清热解毒,抗炎消肿的功效,用于疖肿、腮腺炎、咽炎、淋巴腺炎、扁桃腺炎等[1]。紫堇灵是苦地丁中的有效成分之一,具有镇静、抗钩端螺旋体及肝损伤保护作用[2-3]。查阅相关文献[4-10],并没有关于蒲地蓝消炎片中紫堇灵含量测定方法的报道,为了更好地控制药品质量,本文采用高效液相色谱法对蒲地蓝消炎片中紫堇灵含量进行测定,并考察了该方法的准确性。
1 仪器与试药
1.1仪器
LC-2010A高效液相色谱仪、紫外可见波长检测器(日本岛津),LC Solution色谱工作站,UV-2450紫外可见分光光度计(日本岛津公司);Mettler Xp26微量电子分析天平(瑞士梅特勒公司,精密度:百万分之一);Mettler AE-200电子分析天平(瑞士梅特勒公司,精密度:万分之一);AS7240BT超声波清洗器(天津奥特赛恩斯仪器有限公司)。
1.2试药
紫堇灵对照品(中国食品药品检定研究院,批号:111734-200601);蒲地蓝消炎片(广东心宝制药有限公司,批号:20140105,20131201,20130905);甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 对照品溶液的制备
精密称取紫堇灵对照品适量,加甲醇制成质量浓度为0.235 8 mg·mL-1的对照品储备液,备用。精密吸取上述储备液1 mL,置10 mL量瓶中,加甲醇稀释至刻度,制成质量浓度为23.58 μg·mL-1的对照品溶液。
2.2 供试品溶液的制备
取重量差异下的样品,研细,精密称定1.0 g,置具塞锥形瓶中,精密加入甲醇20 mL,称定重量,超声处理30 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,用0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.3 色谱条件
Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.015 mol·mL-1磷酸盐缓冲液(pH6.7)(70∶30);流速为0.80 mL·min-1;检测波长为289 nm;柱温为35 ℃;进样量为20 μL。理论板数按紫堇灵峰计算应不低于5 000。
2.4 线性关系考察
分别精密吸取对照品溶液6、8、10、12、14、16 μL,注入色谱仪中,测定,以进样量为横坐标,峰面积为纵坐标,绘制标准曲线,得回归方程为Y=1.451×106X+6.042×103,r=0.999 8。结果表明,紫堇灵在0.141 5~0.377 3 μg具有良好的线性关系。
2.5 精密度试验
精密吸取2.1项下对照品溶液10 μL,按2.3色谱条件连续进样6次,在相同条件下测定,得紫堇灵峰面积的RSD=0.81%,结果表明精密度良好。
2.6 稳定性试验
取供试品溶液(批号:20140105),分别在室温放置0,6,12,18,24 h后进样10 μL分析,测定紫堇灵的峰面积,所得峰面积的RSD=0.62%(n=6)。结果表明,供试品溶液室温放置24 h内稳定性良好。
2.7 重复性试验
取同一批号样品(批号:20140105),按2.2方法制备6份供试品溶液,按2.3色谱条件下进样20 μL,测定峰面积,计算紫堇灵平均质量分数为0.21 mg·g-1,RSD=0.93%,结果表明重复性良好。
2.8 专属性试验
取按蒲地蓝消炎片处方比例和工艺制成的缺苦地丁的阴性对照品适量,精密称取1.0 g,按2.2方法制备成缺苦地丁的阴性对照溶液,按2.3色谱条件测定,结果表明处方中其他成分对紫堇灵的测定无干扰,见图1。

A.紫堇灵对照品;B.供试品;C.缺苦地丁的阴性样品;1.紫堇灵。图1 蒲地蓝消炎片及对照品HPLC图
2.9加样回收率试验
精密称取6份已知含量的供试品(批号:20140105,含紫堇灵0.21 mg·g-1),各0.50 g,分别精密加入2.1紫堇灵对照品储备液0.5 mL,按上述制备方法及色谱条件操作,结果见表1。
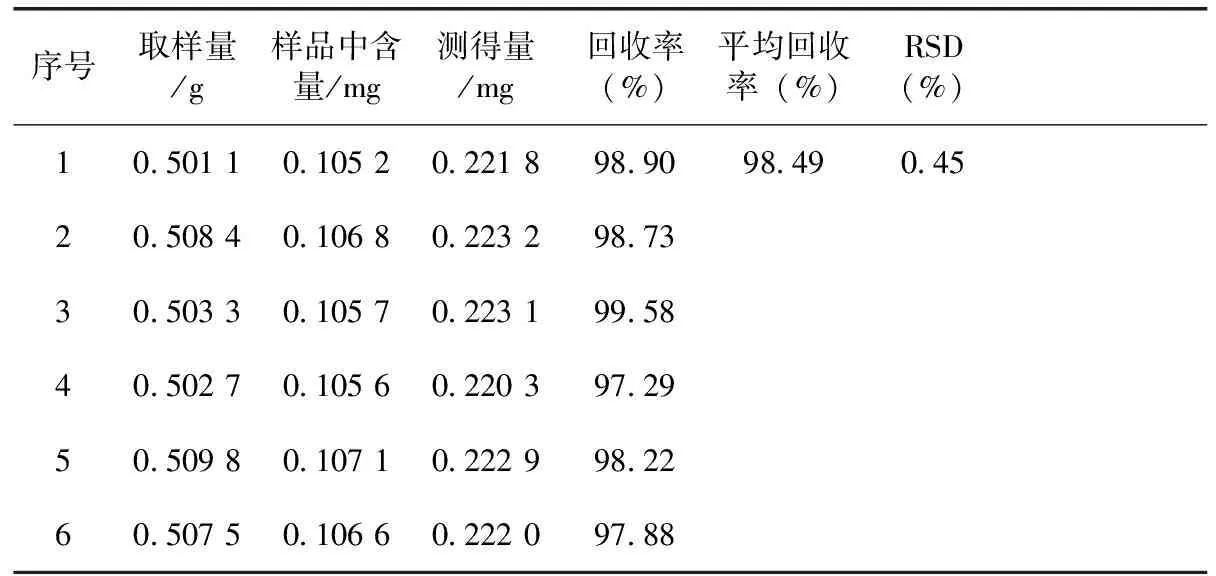
表1 蒲地蓝消炎片中紫堇灵加样回收率试验
注:紫堇灵对照品加入量均为0.117 9 mg。
2.10 蒲地蓝消炎片样品的测定
取3批蒲地蓝消炎片样品(批号:20140105,20131201,20130905),测定紫堇灵的含量,每一批样品按2.2方法制备3份供试品溶液,按上述方法进样分析,结果见表2。
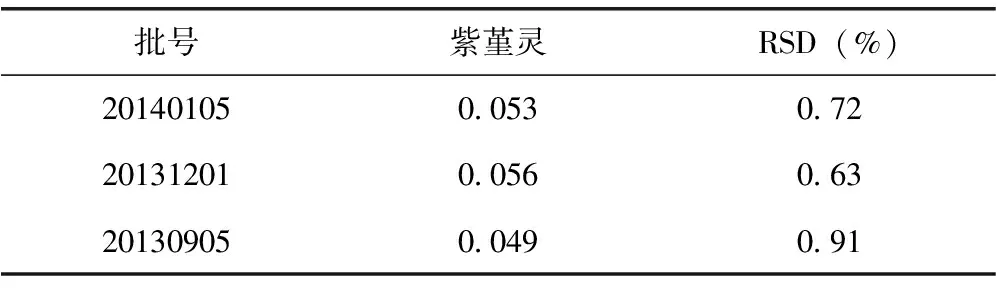
表2 蒲地蓝消炎片中紫堇灵的测定(n=3) mg/片
3 讨论
在初试验时,采用《中国药典》2010版一部中苦地丁含量测定项下的流动相和检测波长检测样品中紫堇灵的含量[11],结果发现,紫堇灵出峰的峰形好,基线平稳,柱效高,保留时间适中,达到良好的分离效果,由此确定色谱条件。
紫堇灵为异喹啉类生物碱,易溶于三氯甲烷、丙酮等有机溶剂。笔者分别考察了以甲醇、丙酮、三氯甲烷为溶剂的提取效率,其中甲醇提取最为完全。提取方法考察了加热回流和超声提取,结果发现加热回流提取所得成分较多,导致干扰峰数量多、面积大,而紫堇灵含量相对较低,无法对紫堇灵峰进行准确积分,最终选用超声法进行提取。提取方法确定后,分别考察了10,20,30,40,60 min的超声提取,结果表明30 min以后,样品中紫堇灵的含量不再提高,因此确定提取时间为30 min。
有研究表明[12],目前市场上不同产地的苦地丁所含紫堇灵的差异很大,选用不同产地的苦地丁投料,必然会影响到蒲地蓝消炎片的质量。现行标准中,除检查项外,无鉴别及含量测定项目,无法较好地控制药品质量。本文采用高效液相色谱法测定蒲地蓝消炎片中的紫堇灵含量,样品处理简单,方法快速准确,对其质量控制具有一定的参考价值。
[1] 卫生部.卫生部药品标准·中药成方制剂 [S].第三册.1991:187.
[2] 魏怀玲,刘耕陶.紫堇灵、乙酰紫堇灵及原阿片碱对小鼠实验性肝损伤的保护作用[J].药学学报,1997,32(5):331.
[3] 郑建芳,秦民坚,郑昱,等.苦地丁生物碱的化学成分[J].中国药科大学学报,2007,38(2):112.
[4] 黄阁,赵怀清,李发美.RP-HPLC法测定苦地丁及其复方制剂中紫堇灵的含量[J].沈阳药科大学学报,2001,18(6):419.
[5] 徐晓莹,李宝明,何丽一.苦地丁中异喹琳生物碱的反相离子对高效液相色谱分析法[J].药学学报,1994,29(10):785.
[6] 李凯,逯海龙.蒲地蓝消炎片质量标准的研究[J].宁夏医科大学学报,2012,34(8):859.
[7] 刘德胜,吕青志,张晓帆,等.HPLC法对不同蒲地蓝消炎制剂中绿原酸和咖啡酸含量的测定[J].滨州医学院学报,2012,35(1):51.
[8] 静国峰.HPLC测定蒲地蓝消炎片中黄芩苷的含量[J].中国中药杂志,2008,33(15):1919.
[9] 曹兵,胡春雪,熊叶红,等.蒲地蓝消炎片质量控制方法研究[J].大理学院学报,2008,7(8):4.
[10] 邵礼梅,王云龙,李延雪.高效液相色谱法测定蒲地蓝消炎片中黄芩苷与黄芩素含量[J].中国药业,2012,21(4):37.
[11] 国家药典委员会.中国药典 [S].一部.北京:中国医药科技出版社,2010:187.
[12] 黄阁,杨红娟,李发美.苦地丁中紫堇灵和乙酰紫堇灵的制备和HPLC测定[J].中国中药杂志,2003,28(4):346.
DeterminationofCorynolineinPudilanAnti-InflammatoryTabletbyHPLC
TAN Hualiang1,WEIYi2*
(1.LiuzhouInstituteforFoodandDrugControl,Liuzhou545006,China;2.RuikangHospitalAffiliatedtoGuangxiUniversityofChineseMedicine,Nanning530011,China)
Objective:To establish an HPLC method to determine the content of corynoline in Pudilan Anti-Inflammatory tablet.Methods:The Diamonsil C18(250 mm×4.6 mm,5 μm)column was used.The mobile phase consisted of methanol -0.015 mol·L-1phosphate buffered solution(pH 6.7)(70∶30 for volume)at flow rate of 0.8 mL·min-1.The detection wavelength was 289 nm and the column temperature was 35 ℃.Results:The calibration curve was in good linearity within the range of 0.141 5-0.377 3 μg(r=0.999 8,n=6).The average recovery was 98.49%,and the RSD was 0.45%(n=6).Conclusion:This method is simple,accurate,high separation degree,strong specificity and good repeatability,which can be used for determining the content of corynoline in Pudilan Anti-Inflammatory tablet.
Pudilan Anti-Inflammatory tablet;Corynoline;HPLC;Content determination
2014-04-29)
*
韦怡,讲师,研究方向:中医临床及教学;E-mail:65653067@qq.com
10.13313/j.issn.1673-4890.2015.1.015

