莲雾果实高质量总RNA提取方法的建立
尹珍珍,吴光斌,陈发河,*,谢潮添
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学水产学院,福建 厦门 361021)
莲雾果实高质量总RNA提取方法的建立
尹珍珍1,吴光斌1,陈发河1,*,谢潮添2
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学水产学院,福建 厦门 361021)
为从莲雾果实中提取高质量RNA,以“黑珍珠”莲雾果实为材料,采用试剂盒法、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)法、十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法、改良CTAB法和Trizol法5 种总RNA提取方法进行比较分析。结果表明,SDS法得到的总RNA质量较差,有严重的降解和DNA污染;Trizol法提取物中有较多蛋白和多糖等残留,无条带出现。CTAB法、改良CTAB法和试剂盒法均能获得质量较好的莲雾果实总RNA,经实时荧光定量聚合酶链反应验证得到条带与目的片段大小一致,表明该RNA均能满足后续分子生物学研究。
莲雾果实;RNA提取;多糖;多酚;方法
从不同植物组织和器官中提取完整性好、高纯度的RNA是进行cDNA文库构建、Northern分析实时荧光定量聚合酶链式反应(quantificational real-time polymerase chain reaction,RT-PCR)和新一代测序(如RNA-seq)等许多分子生物学研究的基础和前提。由于不同组织结构与所含成分的差异,其RNA最适提取方法也不尽相同[1]。尤其对于富含蛋白质、多糖多酚类物质的植物果实组织,且核糖核酸酶(RNase)水平较高,这些因素作用下难以从果实中获得高质量RNA[2-4]。目前已有通过研究改进不同的提取方法,成功从猕猴桃[5]、葡萄[6-9]、苹果[6,10]、香蕉[11]、菠萝[12]、枇杷[13-14]、越橘[15-16]、李[17]和番茄[18]等果实中提取得到高质量RNA的报道。莲雾(Syzygium samarangense Merr. et Perry)是热带、南亚热带地区重要珍稀果树之一,其果实风味独特,富含蛋白质、VC、糖类、膳食纤维等营养物质,具有除痰、润肺、止咳、凉血等功效,深受大众喜爱。而目前以莲雾果实为材料进行高质量RNA提取的方法目前未见有报道。
本研究以成熟莲雾果实为材料,采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法、改良CTAB法、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)法、Trizol法和适合多糖多酚植物RNA提取试剂盒法提取莲雾果实组织总RNA,探索和建立最适宜莲雾果实总RNA的提取方法,为莲雾分子生物学研究的开展提供基本的技术支持。
1 材料与方法
1.1材料与试剂
台湾“黑珍珠”莲雾(Syzygium samarangense Merr. et Perry)果实 厦门台湾水果集散中心。
二乙基焦碳酸酯(diethylpyrocarbonate,DEPC)北京索莱宝科技有限公司;Plant RNA Kit RNA提取试剂盒 美国Omega公司;十六烷基三甲基溴化铵、氯化锂、氯仿(均为分析纯) 上海浩然生物技术有限公司;TIANScript cDNA第一链合成试剂盒KR104、2×Taq PCR MasterMix KT201 天根生化科技有限公司。
1.2仪器与设备
5417R台式高速冷冻离心机 德国Eppendorf公司;Nanodrop ND-1000分光光度计 凯乐博(北京)科技发展有限公司;ULT386-3-V40超低温冰箱 美国Thermo Electron公司;AL104电子天平 梅特勒-托利多仪器(上海)有限公司;SW-CJ-1FD超净工作台苏州净化医疗设备有限公司;YXQ.SG41.280压力蒸汽灭菌锅 佛山顺德格兰仕微波炉电器有限公司;凝胶成像系统 美国UVP公司;DYY-6C型电泳仪 北京市六一仪器公司。
1.3方法
1.3.1试剂盒法提取总RNA
参照Omega公司的E.Z.N.A plant RNA Kit试剂盒使用说明提取RNA。
1.3.2 CTAB法提取总RNA
取0.5 g新鲜莲雾果肉放入预冷的研钵中,加入2%聚乙烯砒咯烷酮(polyvinyl pyrrolidone,PVP),用液氮快速研磨至粉末,快速转入预冷的2 mL离心管中,再加入1 mL 3% CTAB提取液,同时加入2% β-巯基乙醇和20 μL 4 mg/mL蛋白酶K溶液,充分混匀;置65 ℃水浴30min,期间每 5 min振摇1 次。4 ℃、10 000×g离心10 min;取上清液,加入等体积的氯仿-异戊醇溶液(体积比24∶1),混匀后于4 ℃、12 000×g离心15min。取上清液加入1/3体积10 mol/L LiCl溶液,混匀后于-20 ℃条件下沉淀过夜。4 ℃、12 000×g离心30 min,弃上清液,用200 μL 2 mol/L LiCl溶液充分悬浮沉淀,4 ℃、12 000×g离心20 min,弃上清液,重复1 次。用200 μL 10 mmol/L Tris-HCl溶液(pH 7.5)在室温条件下充分悬浮沉淀,加入20 μL 体积 3 mol/L KAc溶液(pH 5.5),冰浴20 min。4 ℃、12 000×g离心15 min,转移上清液于新1.5 mL管中,加入500 μL预冷的无水乙醇,-70 ℃放置 2~3 h。 4 ℃、12 000×g离心20 min,弃上清液,加入1 mL 75%乙醇溶液洗涤2次,室温晾干,用适量DEPC水溶解并置于-70 ℃保存备用。
1.3.3改良CTAB法提取总RNA
取0.5 g新鲜莲雾果肉,先挤干水分放入预冷的研钵中,加入2% PVP,用液氮快速研磨至粉末,迅速转入含有1 mL 75%乙醇溶液和2%(质量分数)β-巯基乙醇溶液的2 mL离心管中,混匀,4 ℃、10 000×g离心10 min,弃去上清液,重复1 次。加入1 mL 3% CTAB提取液,后续方法同1.3.2节CTAB法。
1.3.4 SDS法提取总RNA
取0.5 g新鲜果肉挤干水分于液氮中速冻,研磨成粉,迅速置于盛有1 mL SDS缓冲液的离心管中,于65 ℃水浴30 min,不时颠倒混匀。在离心管加入0.4 mL 3 mol/L KAc溶液(pH 5.5),混匀,冰浴20 min,4 ℃、12 000×g离心20 min,取上清液。加入等体积氯仿-异戊醇溶液(24∶1,V/V),轻轻颠倒混匀,4 ℃、12 000×g离心15 min,取上清液。加入1/2体积的冰异丙醇溶液,轻轻颠倒混匀(见丝状沉淀),于 -20 ℃沉淀30 min。4 ℃、12 000×g离心10 min,弃上清液。加入75%乙醇溶液洗涤2 次,室温晾干,用适量DEPC水溶解并置于-70 ℃保存备用。
1.3.5 Trizol法提取总RNA
取0.5 g新鲜果肉挤干水分于液氮中速冻,研磨成粉,快速转入盛有1 mL Trizol的离心管中,旋涡振荡充分混匀。加入约1/5体积的氯仿,旋涡混匀约15 s,室温静置5 min,于4 ℃、12 000×g离心20 min。取上清液,加入等体积的异丙醇,轻轻颠倒混匀,室温静置5 min,于4 ℃、12 000×g离心10 min。去上清液,加入200 μL 75%乙醇溶液洗涤2 次,室温晾干,用30 μL DEPC水溶解并置于-70 ℃保存备用。
1.3.6总RNA检测
用Tris-硼酸电泳缓冲液(0.5×TBE)、1.0%琼脂糖凝胶检测RNA的纯度及完整性。
紫外分光光度计测定A230nm、A260nm、A280nm值,A260nm∶A280nm、A260nm∶A230nm比值检测RNA纯度。计算样品总RNA提取量(μg/g)。
1.3.7 RT-PCR分析
参照马六甲蒲桃β-actin部分序列(登录号:ADB43594.1)和过氧化物酶(peroxidase,POD)(登录号:ACJ11762.1),并委托上海英潍公司合成。其中β-actin上游引物FP:5'-CCATTCAGGCTGTCCTTTCC-3',下游引物RP:5'-AGCTTTTCCTTCATGTCCCT-3',POD上游引物FP:5'-AGATTCCGTTGTTGCTTTAGGTG-3',下游引物RP:5'-GGCATTGATGTTGTTCTCGTTG-3'。按照TIANScript RT Kit试剂盒说明书进行反转录,再根据2×Taq PCR MasterMix说明在PCR反应管中调试反应液和设置反应条件。反应结束后以1.0%琼脂糖凝胶电泳,余下反应液于-70 ℃保存。
2 结果与分析
2.1总RNA样品琼脂糖凝胶电泳检测
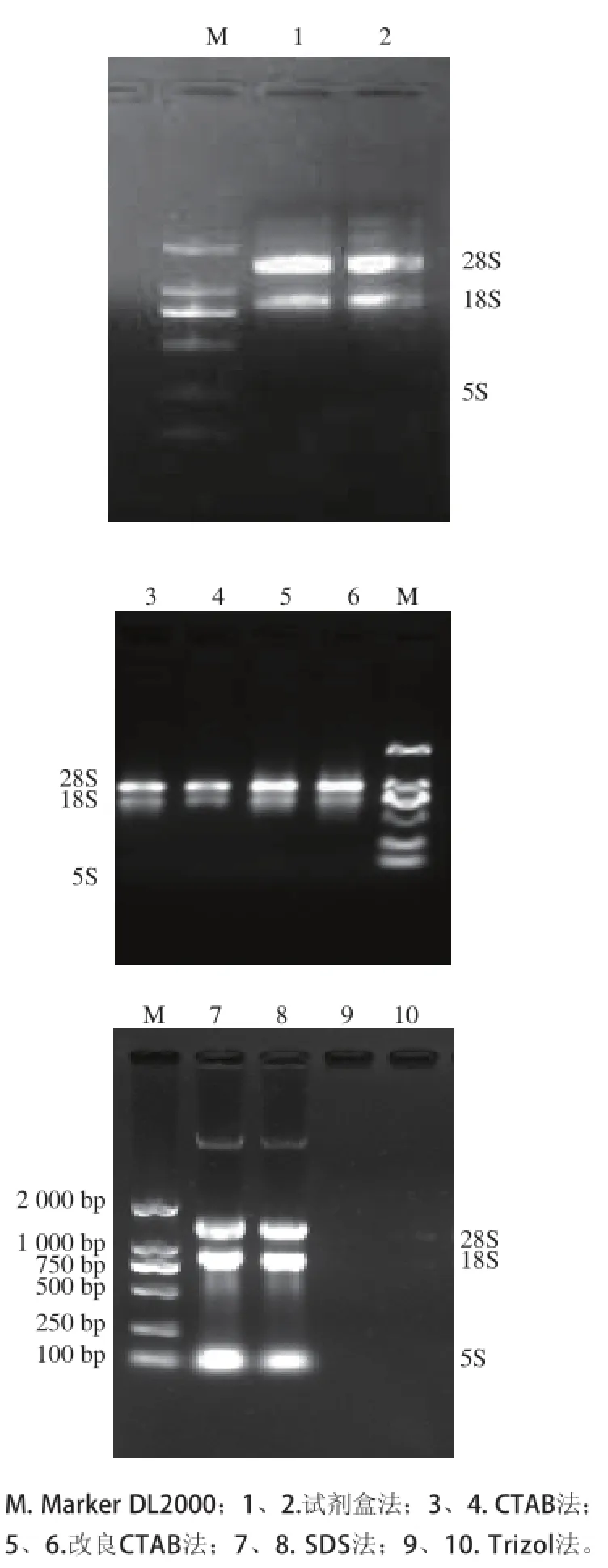
图1 5种不同的方法提取莲雾果实总RNA的电泳图Fig.1 Electrophoretograms of total RNA extracted from wax apple fruit by five methods
图1显示,只有4 种方法可从莲雾果实组织获得一定量的总RNA,而不同提取方法获得的RNA质量又有明显的差异。试剂盒法、CTAB法和改良CTAB法均能得到28S、18S和5S 3 条条带,条带清晰,无明显拖尾现象,且28S条带的亮度约为18S的2 倍,说明提取的总RNA完整性较好,纯度较高。SDS法虽获得的RNA产量较多,但RNA有明显降解,且出现明显的DNA污染痕迹;而Trizol法提取的RNA无条带出现。
2.2总RNA样品的纯度和提取量

表1 不同方法提取莲雾果实总RNA的吸光度比值和提取量Table1 Yields and absorbance ratios of total RNA extracted from wax apple fruit by different methods
对5 种方法提取的总RNA纯度进行分析,从表1可知,CTAB法、改良CTAB法和试剂盒法的A260nm∶A280nm值均在1.8~2.1之间,A260nm∶A230nm值均在2.0~2.4之间,说明这3 种方法能有效去除蛋白质、DNA、多糖多酚和次生代谢物等杂质,所得RNA纯度较高;SDS法虽然A260nm∶A280nm值均在1.8~2.0之间,但电泳检测有DNA污染;而Trizol法的A260nm∶A280nm值低于1.8,A260nm∶A230nm值均低于0.9,说明含有较多的多糖等杂质残留。然而,从提取量来看,试剂盒法提取量最高,达到62.16 μg/g,且提取周期最短;改良CTAB法提取量也较高,可达36.09 μg/g;而CTAB法提取量则相对较低。
2.3RT-PCR电泳结果分析
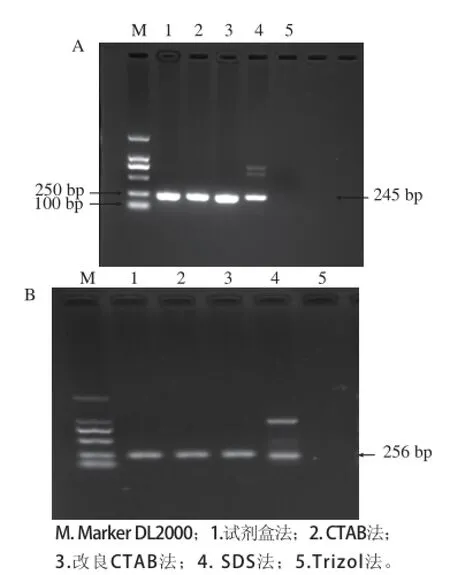
图2 总RNNAA的β-actin RT-PCR产物(A)和POD RT-PCR产物(BB)电泳图Fig.2 Electrophoretograms of RT-PCR products of total RNA extracted by five different methods
将5 种方法提取的莲雾果实RNA进行逆转录,以逆转录cDNA第一条链为模板做PCR扩增。由图2可知,CTAB法、改良CTAB法和试剂盒法提取的莲雾果实总RNA经RT-PCR均得到与目的片段β-actin(245 bp)和POD(256 bp)大小一致的条带,SDS法出现其他非目的条带,而Trizol法也均未得到目的条带,这说明CTAB法、改良CTAB法和试剂盒法获得的RNA质量均能满足后续分子实验的需要。
3 讨 论
RNA的提取是开展分子生物学研究中的一个最关键最基础的问题,获得完整的高纯度RNA是基因克隆和表达等研究的关键所在。然而,不同的RNA提取方法各有其优缺点,故需根据物种特性来选择适当的方法。莲雾果实富含多糖多酚、萜类物质、色素、蛋白质等次生代谢产物[19],严重干扰其RNA的提取。酚类化合物被氧化后会与RNA不可逆地结合,导致RNA活性丧失[20],或形成不溶性复合物[21];而多糖会形成难溶的胶状物,与RNA共沉淀下来[22];萜类化合物和RNase会分别造成RNA的化学降解和酶解[21]。
本研究中SDS法的A260nm∶A280nm的低比率说明提取的RNA中有酚类和多糖类等物质的残留污染;且其5S条带很亮,可能是萜类化合物和RNase的残留,从而造成RNA的化学降解和酶解,同时其又未将RNA与DNA完全分离开来,使产物有明显DNA杂带污染;Trizol是目前较常用的一种提取RNA的试剂,操作简便,省时省力。目前此法已成功的从一些植物果实[23-24]中分离出高质量的RNA,但本实验组发现此方法并不适于提取莲雾果实RNA,其产物中有较多多糖等杂质残留,RNA质量较差。Plant RNA Kit试剂盒,是一种适于提取富含多糖、多酚的植物材料总RNA的试剂盒,成功获得了高产量高质量莲雾果实总RNA,且实验周期短,效率高,但同时成本也较高。CTAB法通过在裂解细胞阶段加入蛋白酶K排除蛋白质杂质的干扰,而后又结合使用特异性沉淀RNA的LiCl,加上高浓度的Na+存在,有效清除了多糖和DNA的污染,获得高质量RNA且成本相对较低;而其缺点是周期较长,耗时耗力,且提取量较低。此法在香蕉[11]、枇杷[13-14]、越橘[15-16]、神秘果[25]等RNA提取的研究中也得到一致的结果。针对CTAB法浓度低提取量低的问题,改良CTAB法通过在第一步取样时就先将新鲜样品挤干,快速减少了样品中糖类、色素等物质含量,再结合75%乙醇溶液的预处理,获得了高质量总RNA的同时,其所得产量较未改良之前高出许多,而较试剂盒法其成本又低不少。
CTAB法、改良CTAB法和试剂盒法均能提取高质量的莲雾果实总RNA,满足RT-PCR等以RNA为基础的后续分子生物学研究,其中试剂盒法和改良CTAB法所得提取量较高。可以根据实验目的和对RNA质量要求来选择最佳提取方法。
[1] AINSWORTH C. Isolation of RNA from floral tissue of Rumex acetosa (sorrel)[J]. Plant Molecular Biology Reporter, 1994, 12(3):198-203.
[2] WANG C S, VODKIN L O. Extraction of RNA from tissues containing high levels of procyanidins that bind RNA[J]. Plant Molecular Biology Reporter, 1994, 12(2): 132-145.
[3] WILKINS T A, SMART L B. A laboratory guide to RNA: isolation,analysis and synthesis[J]. The International Journal of Biochemistry and Cell Biology, 1997, 29(3): 34-38.
[4] WAN C Y, WILKINS T A. A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L.)[J]. Analytical Biochemistry, 1994, 223(1): 7-12.
[5] HU C G, HONDA C, KITA M, et al. A simple protocol for RNA isolation from fruit trees containing high levels of polysaccharides and polyphenol compounds[J]. Plant Molecular Biology Reporter, 2002,20(1): 69.
[6] MOSTER C, GATTO P, MOSER M, et al. Isolation of functional RNA from small amounts of different grape and apple tissues[J]. Molecular Biotechnology, 2004, 26(2): 95-99.
[7] CHOMCZYSKI P, SACCHI N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J]. Analytical Biochemistry, 1987, 162(1): 156-159.
[8] 李红熙, 徐美隆, 杨智. 一种适合葡萄多种组织的总RNA提取方法[J].中国农学通报, 2012, 28(7): 155-159.
[9] 张彦苹, 王晨, 于华平, 等. 适于葡萄不同组织RNA提取方法的筛选[J].西北农业学报, 2010, 19(11): 135-140.
[10] 姚玉新, 赵玲玲, 翟衡, 等. 改良热硼酸法高效提取苹果果实RNA[J].果树学报, 2005, 22(6): 737-740.
[11] ASIF M H, DHAWAN P, NATH P. A simple procedure for the isolation of high quality RNA from ripening banana fruit[J]. Plant Molecular Biology Reporter, 2000, 18(2): 109-119.
[12] GEHRIG H H, WINTER K, CUSHMAN J, et al. An improved RNA isolation method for succulent plant species rich in polyphenols and polysaccharides[J]. Plant Molecular Biology Reporter, 2000, 18(4):369-376.
[13] 张玲, 林顺权, 杨向晖. 枇杷果实总RNA的提取及八氢番茄红素合成酶基因(PSY)片段的克隆[J]. 果树学报, 2012, 29(4): 577-582.
[14] JAIME M C, SUSANA S M, ASCENSION M M. RNA isolation from loquat and other recalcitrant woody plants with high quality and yield[J]. Analytical Biochemistry, 2014, 452: 46-53.
[15] 裴嘉博, 李晓艳, 张亚东. 越橘果实总RNA 提取方法的比较研究[J].东北农业大学学报, 2012, 43(10): 30-34.
[16] AAKOLA L, PIRTTILA A, HALONEN M, et al. Isolation of high quality RNA from Bilberry (Vaccinium myrtillus L.) Fruit[J]. Molecular Biotechology, 2001, 19(2): 201-203.
[17] 邵毅, 罗云波, 张京声, 等. 李果实高质量RNA提取方法的比较和优化[J]. 北京林业大学学报, 2014, 32(1): 57-62.
[18] 马敬, 纪鸿飞, 李培. 番茄果实RNA提取方法比较[J]. 现代农业科技,2011(3): 16-19.
[19] 王晓红. 莲雾的营养成分分析[J]. 中国食物与营养, 2006(4): 53.
[20] SCHNEITOBAUER A, SANDEMANN H J, ERMST D. Isolation of functional RNA from plant tissues rich in phenolic compounds[J]. Analytical Biochemistry, 1991, 197(1): 91-95.
[21] GRAHAM G C. A method for extraction of total RNA from Pinus radiata and other conifers[J]. Plant Molecular Biology Reporter, 1993,11(1): 32-37.
[22] LEWINSOHN E, STEELE C L, CROTEAU R. Simple isolation of functional RNA from woody stems of gymnosperms[J]. Plant Molecular Biology Reporter, 1994, 12(1): 20-25.
[23] LIN Ying, CHEN Xiaojing. Comparison of methods for RNA extraction from papaya fruit[J]. Subtropical Agriculture Research,2008, 4(3): 229-232.
[24] SABZEVARI A G, HOSSEINI R. A quick, efficient, and cost-effective method for isolating high-quality total RNA from tomato fruits,suitable for molecular biology studies[J]. Preparative Biochemistry and Biotechnology, 2014, 44(4): 418-431.
[25] 谭才邓, 李静, 邓毛程. 神秘果果实总RNA提取方法的比较研究[J]. 基因组学与应用生物学, 2013, 32(3): 409-412.
Comparison of Extraction Methods for High Quality RNA from Wax Apple (Syzygium samarangense Merr. et Perry)
YIN Zhenzhen1, WU Guangbin1, CHEN Fahe1,*, XIE Chaotian2
(1. Food and Bio-engineering College, Jimei University, Xiamen 361021, China;2. Fisheries College, Jimei University, Xiamen 361021, China)
The objective of the study was to extract high quality RNA from wax apple (Syzygium samarangense Merr. et Perry) fruits. The effectiveness of five RNA extraction methods, i.e., Plant RNA Kit, hexadecyltrimethylammonium bromide(CTAB), modified CTAB, sodium dodecyl sulfate (SDS) and Trizol, was evaluated. The results showed that the quality of total RNA extracted by SDS method was poor due to serious RNA degradation and genomic DNA contamination. The total RNA extracted with Trizol reagent contained various residues such as proteins and polysaccharides and exhibited no RNA bands. Plant Kit protocol, CTAB and modified CTAB methods were found to be suitable for total RNA extraction from wax apple fruit. RT-PCR analysis demonstrated that the RNA bands were consistent with the target fragment size, which showed that the extracted total RNA could be applied to subsequent molecular biology research.
wax apple fruit; RNA isolation; polysaccharide; polyphenol; method
S667.9
A
1002-6630(2015)14-0001-04
10.7506/spkx1002-6630-201514001
2014-11-19
国家自然科学基金面上项目(31171777);福建省自然科学基金项目(2010J01211)
尹珍珍(1989—),女,硕士研究生,研究方向为农产品贮藏保鲜。E-mail:837949196@qq.com
陈发河(1960—),男,教授,硕士,研究方向为农产品贮藏保鲜。E-mail:fhchen@jmu.edu.cn

