IMP3在不同宫颈组织中的表达及其与微血管密度的相关性
李明++陆晓媛
[摘要] 目的 探讨胰岛素样生长因子Ⅱ mRNA结合蛋白3(IMP3)的表达及微血管密度(MVD)与宫颈鳞癌发生发展及预后的相关性。 方法 选取2007年7月~2013年1月于连云港市妇幼保健院进行宫颈活检或手术切除的宫颈组织标本存档蜡块100例,其中宫颈浸润癌50例,宫颈上皮内瘤变35例,宫颈炎15例。采用免疫组化S-P法分别检测IMP3与MVD在各宫颈组织中的表达。 结果 IMP3的表达及MVD在宫颈鳞癌、宫颈上皮内瘤变、正常宫颈组织中两两比较,差异均有高度统计学意义(P < 0.01);宫颈鳞癌组织中IMP3及MVD呈高表达,并且与宫颈鳞癌临床分期、浸润深度、淋巴转移、分化程度相关,差异均有统计学意义(P < 0.05或P < 0.01)。IMP3在宫颈癌组织中的阳性表达率与MVD值呈正相关(r = 0.323,P < 0.05)。 结论 IMP3及MVD与宫颈癌的发生及侵袭转移有关,可以作为判断宫颈上皮内瘤变发展为浸润癌风险指标和判断宫颈鳞癌恶性程度和预后的良好指标。
[关键词] 宫颈上皮内瘤变;宫颈鳞癌;IMP3;MVD;免疫组化
[中图分类号] R767.33 [文献标识码] A [文章编号] 1673-7210(2015)09(b)-0025-04
宫颈癌是严重威胁妇女健康的常见恶性肿瘤,发病率逐年上升并呈低龄化趋势,早发现、早诊断、早治疗是防治宫颈癌的关键[1]。临床研究表明,从宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)、到宫颈原位癌、浸润癌是逐渐递进的病变恶化过程,约22%CIN Ⅲ进展为浸润癌[2],因此对于CIN进展进行预测十分重要。研究表明,胰岛素样生长因子Ⅱ mRNA结合蛋白3(insulin-like growth factor-ⅡmRNA-binding protein 3,IMP3)是一个癌胚蛋白,表达于胰腺癌,胃癌、子宫内膜癌等多种恶性肿瘤组织中,并和其生物学行为相关,且该基因表达量的改变还可以作为监测肿瘤恶性行为的发展趋势 ,证实IMP3在肿瘤的发生发展中起了非常重要的作用,尤其是在肿瘤细胞的增殖和转移中起着更重要的作用。对于肿瘤筛查、早期诊断、预后的判断有意义[3-6]。
微血管密度(microvessel density,MVD)测定技术为目前评价肿瘤血管生成的金标准,已经被作为一个有意义而且独立的预后指标应用于临床,与肿瘤的侵袭性远处转移及肿瘤的分级有关[7]。本课题通过研究不同宫颈组织中IMP3蛋白和MVD的变化,探索二者在宫颈癌的发生发展中的作用及其临床意义,为宫颈癌的早期诊断及预后判断提供新指标。
1 资料与方法
1.1 一般资料
选取2007年7月~2013年1月于连云港市妇幼保健院进行宫颈活检或手术切除标本存档蜡块100例,患者年龄19~73岁,术前均未行放疗或者化疗。其中宫颈鳞癌50例,CIN 35例,宫颈炎15例。宫颈鳞癌中,高分化16例,中分化17例,低分化17例;宫颈鳞癌分期(FIGO 2009)I期37例,Ⅱa期13例,CINⅠ11例、CIN Ⅱ12例、CIN Ⅲ12例。本研究经连云港市妇幼保健院医学伦理委员会讨论后批准,参与研究者均知情同意并签署知情同意书。
1.2 主要试剂
鼠抗人IMP3单克隆抗体(工作浓度1∶200)购自武汉博士德公司;CD34抗体(即用型)及其余试剂盒均购自福州迈新生物有限公司。
1.3 染色方法
采用免疫组织化学S-P法,操作步骤按试剂盒说明书进行,抗原修复采用高压锅高温修复,用已知乳腺阳性切片做阳性对照,用磷酸盐缓冲液(PBS)代替一抗作为阴性对照。具体步骤如下:切片,烤片,脱蜡,酒精梯度,自来水洗,纯净水洗1 min;高压锅加入柠檬酸缓冲液,烧沸(240℃),置入切片,压力阀顶起后加热3~5 min,熄火后自然冷却3~5 min,自来水冲洗冷却5 min(至锅底冷却);取出切片,自来水洗,纯净水洗1 min;擦干玻片,画圈,适当干燥后PBS冲洗(去垢剂)2 min×3次;擦干玻片,H2O2封闭(覆盖标本)10 min,PBS冲洗2 min×3次;加一抗,37℃温箱1 h后4℃冰箱过夜,PBS冲洗2 min×3次;即用型二抗10~15 min,PBS冲洗2 min×3次;DAB显液(现配),镜下观察(约2 min),水洗终止;苏木精染色1 min,分化、返蓝、梯度酒精、封片;苏木精复染1~2 min,自来水冲洗干净,分别依次采用80%、95%无水乙醇的梯度脱水干燥,二甲苯透明,中性树胶封片,镜检。
1.4 结果判定
IMP3基因结果判定:IMP3基因主要位于细胞浆,以细胞浆内出现棕黄色或棕褐色的染色定为阳性。在400倍视野下进行观察,统计染色阳性细胞在所观察整个高倍视野中宫颈细胞中百分比,分为4级:染色阳性细胞占宫颈细胞数<10%为0分,10%~30%为1分,>30%~60%为2分,>60%为3分;0分为阴性,1~3分为阳性。染色强度分为阴性(无着色0分)、弱阳性(淡黄色1分)、中等阳性(棕黄色2分)、强阳性(棕褐色3分),分别记为-、+、++、+++。将每张切片的染色强度得分与阳性细胞百分率得分相乘,最后得分,0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。
MVD结果判定:微血管密度的计数参照Weidner等[8]法,将CD34染色阳性的单个内皮或一簇内皮细胞作为一个微血管,先在100倍镜下选择5个新生血管最密集区(热区),再在400倍视野下进行计数,每个结果均有两位研究者计数,取其均数为该病例的微血管密度。
1.5 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验;计数资料用率表示,组间比较采用χ2检验;采用Spearman等级相关分析IMP3表达与MVD的相关性,以P < 0.05为差异有统计学意义。
2 结果
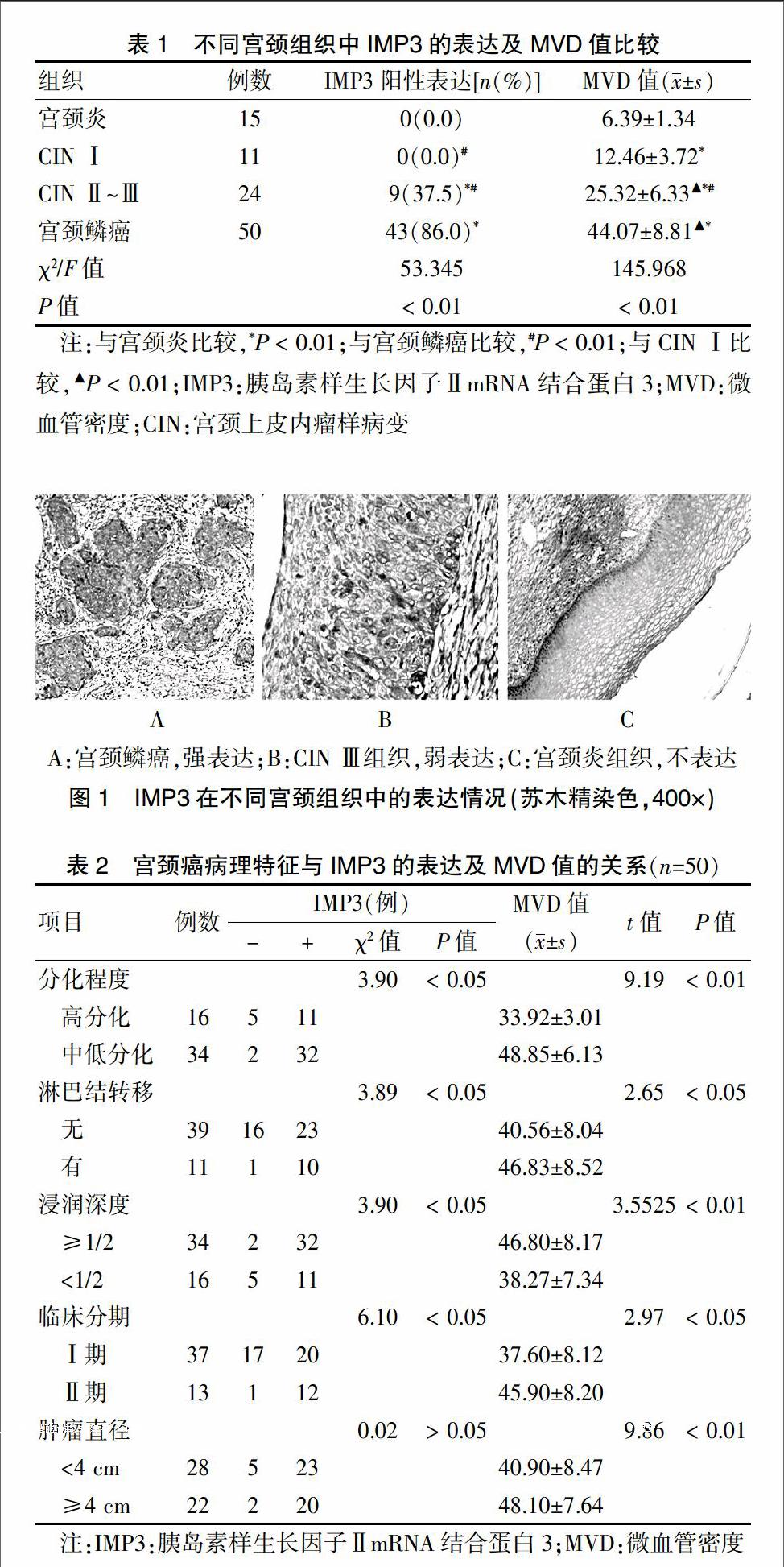
2.1 不同宫颈组织中IMP3的表达及MVD值比较
IMP3阳性表达位于肿瘤细胞胞浆内,呈棕黄色颗粒(图1A);CIN Ⅱ~Ⅲ有3例为(+),染色较浅,散在分布于鳞状细胞病变部(图1B),其余阳性表达均为(++~+++),染色较深集中分布(图1B);在宫颈炎性组织及CIN Ⅰ中IMP3不表达(图1C)。Spearman相关性分析发现,IMP3阳性表达与宫颈病变程度呈正相关(r = 0.537,P < 0.01);随着宫颈病变加重,不同宫颈组织中MVD值升高,差异有高度统计学意义(F=145.968,P < 0.01),组间两两比较,差异均有高度统计学意义(P < 0.01)。见表1。
2.2 IMP3表达及MVD值与宫颈癌临床病理特征的关系
IMP3阳性表达率和MVD值与宫颈鳞癌临床分期、肿瘤分化程度、淋巴结转移及肌层浸润深度有关,差异均有统计学意义(P < 0.05或P < 0.01),IMP3阳性表达率与肿瘤大小无关(P > 0.05)。见表2。
2.3 IMP3表达与MVD值在宫颈癌组织中的相关性分析
50例宫颈癌组织中IMP3阳性表达的患者为43例,阴性表达为7例。宫颈癌组织中,IMP3阳性表达与MVD 值呈正相关(r=0.323,P < 0.05)。
3 讨论
3.1 IMP3在不同宫颈组织中表达及临床意义
CIN为一组与宫颈浸润癌密切相关癌前病变,反映宫颈浸润癌发生发展中连续的过程,其变化具有渐进性 ,并处于动态变化中 。CIN具有三种自然转归,消退、持续不变或进展为更高级别的病变,更严重发展为浸润癌。级别越高 ,其消退的机会就越小[2],因此积极寻找及早发现癌前病变及预测其发展显得格外重要。IMP3基因是一种新识别的RNA结合蛋白,生长因子信使RNA结合蛋白之一,该基因定位于染色体7p11.5,包含580个氨基酸的残基,被4350个核苷酸mRNA转录所编码。研究发现,在早期胚胎形成时期,IMP3基因在上皮组织,肌肉组织和胎盘组织中均有表达,但在成人组织中却没有发现。在胚胎的形成时期,IMP3基因在结合,转录,稳定胚胎胰岛素样生长因子-Ⅱ(IGF-Ⅱ)过程中起着重要的作用。IMP3可间接调控IGF-Ⅱ基因表达,而IGF-Ⅱ通过激活和结合IGF-Ⅰ受体使酪氨酸激酶氧化磷酸化,氧化磷酸化的IGF-Ⅰ受体再将传导促有丝分裂的信号传到细胞内,参与肿瘤的形成过程,促进肿瘤的细胞增生[9-13]。
本研究结果显示,IMP3阳性表达率在宫颈正常组织、CINL组织、CINH、宫颈鳞癌组织,随着病变程度加重呈递增趋势,和宫颈鳞癌的连续发展是相符的,两者具有相关性,且各组两两比较差异有统计学意义。IMP3在CIN Ⅱ~Ⅲ中,而在宫颈炎性组织和低级别病变的宫颈组织中不表达,Lu等[14]的一项研究中发现在宫颈切除术后随访中,仅在IMP3阳性的CIN Ⅱ~Ⅲ患者中发现了浸润癌,而在IMP3阴性的CIN Ⅱ~Ⅲ患者中没有发现浸润癌,两者比较差异有高度统计学意义(P < 0.01)。IMP3在宫颈细胞从增生发展为侵袭性宫颈鳞癌过程中起重要作用。IMP3可以用于确定有发展为侵袭性宫颈鳞癌风险的初步判断。IMP3可以作为预测CIN患者进展为浸润癌的理想的分子检测标志,IMP3阳性表达患者应严密随访,无生育要求的患者可考虑切除子宫。
本实验探讨了IMP3表达与宫颈癌的几个重要预后因素的关系,显示其表达与宫颈鳞癌临床分期,淋巴结转移、肌层浸润深度、肿瘤分化程度有关,差异均有统计学意义(P < 0.05),IMP3表达阳性显示疾病预后不良,与林黎娟等[15]研究报道的IMP3在肝癌组织中的表达与肝癌的组织分化程度及淋巴结转移相关及生存率相关是一致的,提示其可能参与细胞生长分化侵袭转移的过程,可作为判断肿瘤恶性程度及预后的指标。目前研究显示IMP3可能通过调节控制CD44的表达,减低细胞的黏附,降解Ⅳ型胶原纤维,促进肿瘤细胞的侵袭,另外IMP3基因还可以调节细胞黏附分子(ALCAM、SynCAM、MCAM)、CD24和基质金属蛋白酶1等的表达,而这些分子均与细胞的黏附和肿瘤的侵袭性有关系[16]。
3.2 MVD在不同宫颈组织中表达意义
研究发现微血管与恶性肿瘤的生长和转移成密切相关,其数量被认为预测肿瘤复发转移的一项重要指标[17]。本研究采用特异性CD34抗体标记组织中血管内MVD值,发现随着宫颈病变程度的加重,MVD值升高,差异有高度统计学意义(P < 0.01),在宫颈鳞癌中,和肿瘤的分化程度、临床分期、肌层浸润深度、淋巴结转移、肿瘤大小均有关,差异有统计学意义(P < 0.05或P < 0.01),提示微血管的形成可能促进宫颈癌细胞生长及侵袭,进一步证实血管生成对于评估患者的预后疾病的发展有重要价值。宫颈鳞癌组织中MVD值升高提示宫颈癌具有高危因素及预后不良。
3.3 IMP3及MVD检测的意义
本研究显示IMP3表达和MVD的表达呈正相关,在宫颈鳞癌组织中,MVD计数随临床分期、淋巴转移、进展明显升高,随着MVD值升高,IMP3阳性表达率明显升高(r = 0.323,P < 0.05)。有研究表明,IGF-Ⅱ可通过促进表皮细胞生长因子(VEGF)的产生,加强VEGF促肿瘤血管形成[18]。VEGF是目前已知作用最强的促血管生成因子,能特异性地直接作用于血管内皮细胞,引起血管内皮细胞增殖,促进血管形成[18-20],提示IMP3可能通过增强IGF-Ⅱ表达而促进肿瘤细胞增殖,进而微血管形成,从而促进宫颈癌细胞生长及侵袭。
总之,本实验结果表明IMP3蛋白可能成为可以作为预测CIN进展为浸润癌的理想的分子检测标志。MVD是一个评估肿瘤血管生成及反映临床疾病进展的可靠参数。联合检测IMP3及MVD是判断宫颈癌患者预后的新的指标及肿瘤治疗的新的靶点,对于IMP3及MVD的深入研究有利于进一步了解肿瘤的生物学行为,为宫颈癌的早期发现及治疗提供新的思路。
[参考文献]
[1] 吴倩,易韦,张著学,等.IMP3及P16在宫颈癌筛查脱落细胞块中的表达和意义[J].中国妇幼保健,2014,20(29):4206-4210.
[2] 曹泽毅.中华妇产科学(临床版)[M].北京:人民卫生出版社,2010.
[3] Sitnikova L,Mendese G,Liu Q,et al. IMP3 predicts aggressive superficial urothelial carcinoma of the bladder [J]. Clin Cancer Res,2008,14(6):1701-1706.
[4] Wang Z. Prognostic biomarkers in renla cell carcinoma [J]. Expert Rev Mol Diagn,2007,7(3):293-307.
[5] Heng W,Yi X,Fadare O,et al. The oncofetal protein IMP3:a novel biomarker for endometrila serous carcinoma [J]. Am J Surg Pathol,2008,32(2):304-315.
[6] 纪昀,易韦,于燕妮.MP3及其研究进展[J].贵州医药,2013,37(3):277-280.
[7] 张蓓,魏冉,胡文娟,等.乳腺癌新辅助化疗MR灌注成像与微血管密度的相关性研究[J].中华肿瘤防治杂志,2011,18(17):1387-1391.
[8] Weidner N,Joseph P,William R,et al. Tumor angiogenesis and metatasiscorrelation in invasive breast carcinoma [J]. N Engl J Med,1991,324(1):1-8.
[9] Gress TM,Muller-Pillasch F,Geng M,et al. A pancreatic cancer-specific expression profile [J]. Oncogene,1996,13(8):1819-1830.
[10] Wang T,Hopkins D,Schmidt C,et al. Identification of genes differentially over-expressed in lung squamous cell carcinoma using combination of CDNA subtraction and microarray analysis [J]. Oncogene,2000,19(12):1519-1528.
[11] Prince SN,Foulstone EJ,Zaccheo OJ,et al. Functional evaluation of novel soluble insulin-like growth factor(IGF)-Ⅱ-specific ligand traps based on modified domain 11 of the human IGF2 receptor [J]. Mol Cancer Ther,2007,6(2):607-617.
[12] LeRoith D,Roberts CT Jr. The insulin-like growth factor system and cancer [J]. Cancer Lett,2003,195(2):127-137.
[13] 侯宏丽.米非司酮对子宫肌瘤患者血清中IGF-1表达的影响[J].中外医学研究,2013,12(21):3-5.
[14] Lu D,Yang X,Jiang NY,et al. IMP3,a new biomarker to predict progression of cervical intraepithelial neoplasia into invasive cancer [J]. Am J Surg Pathol,2011,35(11):1638-1645.
[15] 林黎娟,金政,林贞花,等.肝细胞癌组织中IMP3蛋白表达的意义[J].临床与实验病理学杂志,2012,28(1):801-803.
[16] Yu Q,Stamenkovic I. Localization of matrix metalloproteinase 9 to the cell surface provides a mechanismfor CD44-mediated tumor invasion [J]. Genes Dev,1999,13(1):35-48.
[17] 张君红,林瑶光.胃癌组织中Flt和PDGF及Bfgfr表达与MVD的相关性研究[J].中华肿瘤防治杂志,2013,20(3):217-220.
[18] Wang S,Lloyd RV,Hutzler MJ,et al. The role of cell cycle regulatory protein,cyclin D1,in the porgression of thyorid cnacer [J]. Mod Pathol,2000,13(8):882-887.
[19] 王天祥,邹高峰,李超,等.CGF中VEGF、TGF-β1含量测定及其对软组织创伤愈合影响的实验研究[J].中外医学研究,2013,10(10):140-141.
[20] 于冬梅,阎晓初,郭德玉,等.VEGF和nm23蛋白在膀胱移行细胞癌中表达及临床意义[J].第三军医大学学报,2006,28(21):2180-2182.
(收稿日期:2015-05-29 本文编辑:任 念)

