秦巴山区虎杖内生放线菌的分离及鉴定
程贤利等

摘要:采用平板划线法从秦巴山区虎杖根状茎中分离内生放线菌,依照形态学常规分类方法和16S rDNA序列分析法进行鉴定,并以大肠埃希杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)为靶标菌,采用滤纸片扩散法研究虎杖内生放线菌发酵产物的抗菌活性。结果表明,分离得到的16株放线菌中,菌株PEA005和PEA006分属于拟诺卡菌属(Nocardiopsis)和小单孢菌属(Micromonospora),对枯草芽孢杆菌的抑菌圈达到21~28 mm,对金黄色葡萄球菌的抑制圈达到13~20 mm,而对大肠杆菌和铜绿假单胞菌抑制作用不显著。
关键词:虎杖;内生放线菌;分离;鉴定;秦巴山区;拟诺卡菌属;小单孢菌属
中图分类号: S567.01文献标志码: A文章编号:1002-1302(2015)09-0392-03
通信作者:陈文强,教授,主要从事微生物资源研究开发与利用。E-mail:wenqiangc@126.com。虎杖(Polygonum cuspidatum)为蓼科植物,主要分布在我国湖北、四川、陕西等20多个省份,其根茎味微苦、微寒,归肝、胆、肺经,具活血散瘀定痛、清热解毒利湿、化痰止咳通喘之功效[1-2]。虎杖提取物中的有效成分是芪类和蒽醌类化合物,其中,芪类化合物包括白藜芦醇及白藜芦醇苷[3]。据报道,白藜芦醇具有抑制肿瘤、抗氧化、抗血栓及防治冠心病等作用[4-6],被列为抗心血管疾病、抗癌最有前途的药物之一。
植物内生菌是指存活于健康植物组织内部、不引发宿主植物表现出明显感染症状的微生物类群,主要包括真菌、细菌和放线菌[7-8],分布于植物根、茎、叶、花、果实和种子等器官组织的细胞或细胞间隙中[9]。植物与内生菌在长期协同进化中建立起独特的遗传与代谢关系,由于植物与内生菌相互间的基因交换,使得内生菌具有产生某些与植物相同或相似化合物的能力。目前发现并具有抗菌活性的代谢产物大多数来源于放线菌[10-11],其种类多样性和丰富的代谢产物可以产生重要的生理活性物质,因此,从传统药用植物内生放线菌的次生代谢产物中,筛选出具有药用价值的活性物质或新型化合物,对新型药物开发及濒危植物资源保护具有重要意义[12]。
目前,国内外对虎杖资源的研究主要集中在虎杖内生真菌方面[13-15],对内生放线菌的研究却鲜有报道。本试验以秦巴山区珍稀药用植物虎杖为材料,对其内生放线菌进行分离鉴定,并对内生放线菌次生代谢产物的抗菌活性进行初步研究,旨在为虎杖内生放线菌资源的开发和利用提供理论依据。
1材料与方法
1.1材料
1.1.1供试材料虎杖采自陕西留坝县火烧店乡和陕西汉台区黄花河景区。靶标菌株:大肠埃希杆菌(Escherichia coli,ATCC8739)、枯草芽孢杆菌(Bacillus subtilis,ATCC6633)、金黄色葡萄球菌(Staphylococcus aureus,ATCC6538)、铜绿假单胞菌(Pseudomonas aeruginosa,ATCC9027),均由陕西省食药用菌工程技术研究中心提供。
1.1.2培养基改良高氏Ⅰ号培养基:可溶性淀粉20.0 g、KNO3 1.0 g、NaCl 0.5 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g、琼脂15.0 g、H2O 1 000.0 mL,pH值为7.2~7.4;改良高氏Ⅱ号培养基:葡萄糖1.0 g、蛋白胨0.5 g、胰蛋白胨0.3 g、NaCl 0.5 g、复合维生素0.5 g、琼脂15.0 g、H2O 1 000.0 mL,pH值为7.2~7.4;1/10 ATCC172合成培养基:葡萄糖1.0 g、可溶性淀粉2.0 g、酵母浸汁0.5 g、CaCO3 1.5 g、N-Z-Amine A 0.5 g、琼脂15.0 g、H2O 1 000.0 mL,pH 值为7.2~7.4;酵母膏-麦芽汁琼脂培养基(YE):酵母粉4.0 g、麦芽汁提物6.0 g、葡萄糖4.0 g、复合维生素 3.75 mg、琼脂20.0 g,H2O 1 000 mL,pH 值为7.2;液体酵母膏―麦芽汁琼脂培养基,YE中不含琼脂。
1.1.3主要仪器设备LS-B50L高压蒸汽灭菌锅,上海申安医疗器械厂;ZHWY-2102C数显式恒温摇床,上海志成有限公司;Mycycler PCR扩增仪、Gel Doc凝胶成像系统,美国Bio-rad公司;Allegra6低温高速离心机,美国Beckman公司。
1.2方法
1.2.1样品预处理将新鲜虎杖根表面泥沙清除,裁成合适大小,置于500 mL烧杯内,流水冲洗2 h;2% Tween-80溶液清洗表面,无菌环境下依次用75%乙醇浸泡30 s,无菌水冲洗;加含有1% Tween-80的0.1% HgCl2溶液分别浸泡0、35、4.0、4.5、5.0、5.5、6.0 min;无菌水冲洗5次,用手术刀取其韧皮部,研钵中研磨至匀浆,按1 ∶50比例加入无菌水,制备成匀浆液。
1.2.2菌株分离分别在改良高氏Ⅰ号培养基、改良高氏Ⅱ号培养基、1/10 ATCC172合成培养基中加入表1中的抑菌剂制成平板,吸取100 μL匀浆液,涂布,重复5次;取最后1次冲洗用的无菌水100 μL,涂布于各分离纯化培养基平板作为空白对照,以检测表面消毒情况。将平板倒置,28 ℃培养,随时观察平板菌落状态;将放线菌菌落挑在酵母膏-麦芽汁琼脂培养基上,采用平板划线法纯化至单个菌落。
表1在分离培养基中加入的选择性抑制剂及作用
名称浓度(mg/L)作用重铬酸钾K2Cr2O775.0抑制真菌和细菌制霉菌素nystatin75.0抑制霉菌萘啶酮酸nalidixic acid20.0抑制细菌
1.2.3抑菌试验分别将16株内生放线菌于28 ℃、160 r/min 发酵7 d;将发酵液12 000 r/min离心15 min,取上清,0.22 μm微孔滤膜过滤;滤液4 ℃冰箱保存,备用。挑取少量活化24 h的供试菌,在装有10.0 mL无菌水的试管中反复摇匀,制成菌悬液;用微量取液器分别取大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌菌悬液各0.2 mL注入牛肉膏蛋白胨培养基平板表面,涂布均匀;将直径为 8.0 mm 的无菌滤纸片在发酵液中浸泡1 h,贴到培养基表面,每平板贴4片,其中每2片代表1种株菌,每处理做5个平板;将平板倒置,(36±1) ℃培养24 h,测量抑菌圈直径。
1.2.4菌株鉴定
1.2.4.1形态学鉴定观察记录分离菌株的菌落形态,菌丝体生长状态及可溶性色素的产生情况,依据阮继生等方法[16]进行初步鉴定。
1.2.4.2分子生物学鉴定采用CTAB法提取菌株DNA,利用PCR引物799F和1492R对菌株16S rRNA 基因进行扩增。PCR反应体系(25.0 μL):2×Taq PCR Mix 12.0 μL、10.0 μmol/mL 引物各1.0 μL、D260 nm/D280 nm约等于1.80 的DNA模板2.0 μL、灭菌双蒸水9.0 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min、56 ℃ 1 min、72 ℃ 2 min,30个循环;72 ℃延伸10 min。PCR扩增产物进行1.0%琼脂糖凝胶电泳,将纯化的PCR产物交上海生工生物科技有限公司进行双向测序;将所测序列提交GenBank数据库进行Blast检索;下载与分离菌株具有较高同源性的模式菌株数据,利用Clusta-X和Mega 5.1软件对所得序列进行人工校正及比对分析,按聚类分析法构建系统发育树。
2结果与分析
2.1虎杖不同消毒时间效果比较
使用含有1% Tween-80的0.1% HgCl2溶液,分别浸泡虎杖样品0、3.5、4.0、4.5、5.0、5.5、6.0 min进行表面消毒,观察培养基上杂菌菌落的生长情况以考察消毒效果。结果表明,不使用HgCl2对虎杖样品进行表面消毒的对照组,即消毒0 min,培养基上的杂菌菌落很多,无法进行统计;随着HgCl2消毒时间的延长,菌落数逐渐减少,消毒3.5 min,菌落数在10个以上;消毒4.0 min,菌落数为5~10个;消毒4.5 min,菌落数少于5个;消毒时间超过5 min时,无菌落生长,但是,消毒时间过长,可能会导致内生菌被杀死。因此,虎杖样品表面消毒最佳时间为5 min。
2.2分离出的虎杖内生放线菌菌株形态
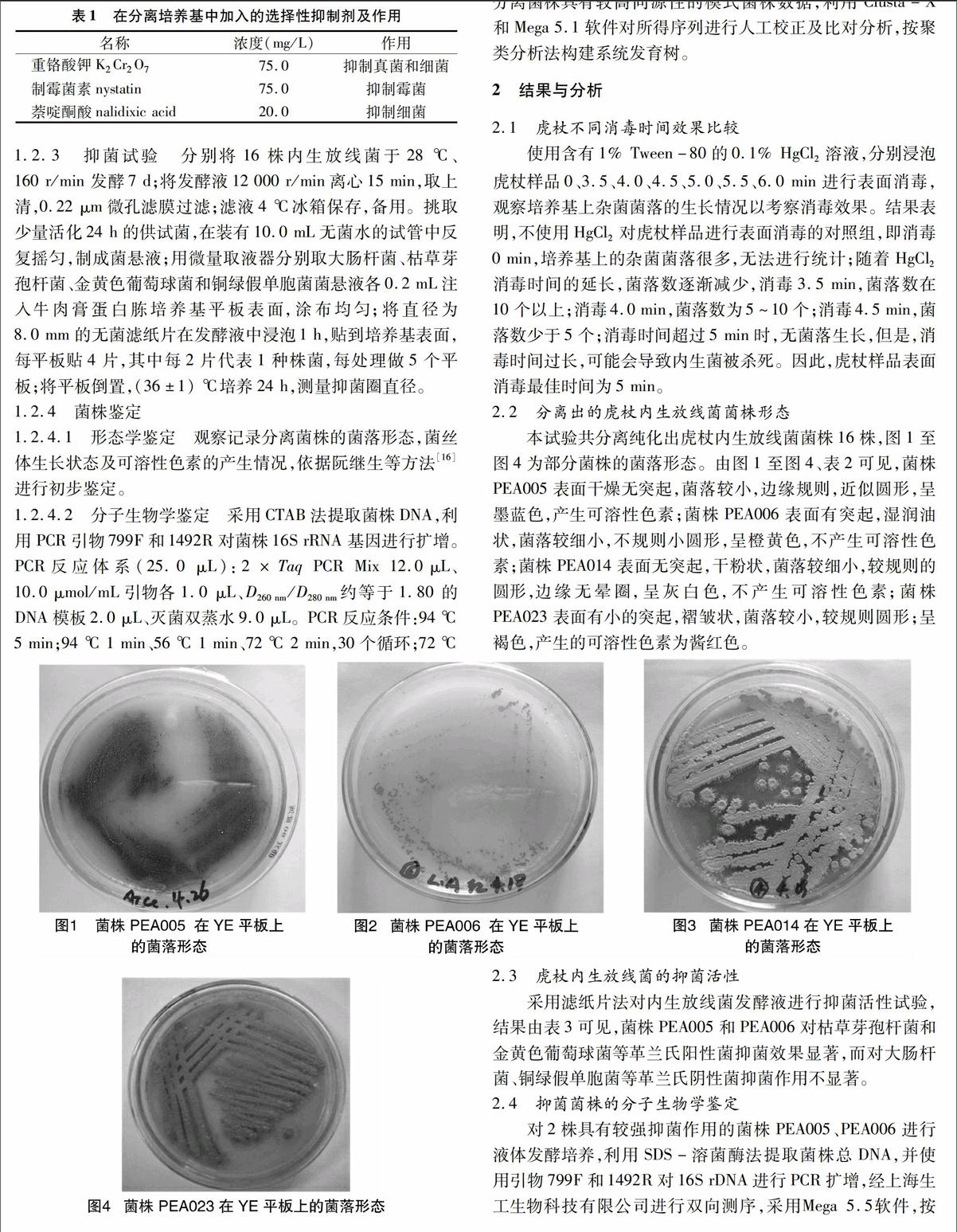
本试验共分离纯化出虎杖内生放线菌菌株16株,图1至图4为部分菌株的菌落形态。由图1至图4、表2可见,菌株PEA005表面干燥无突起,菌落较小,边缘规则,近似圆形,呈墨蓝色,产生可溶性色素;菌株PEA006表面有突起,湿润油状,菌落较细小,不规则小圆形,呈橙黄色,不产生可溶性色素;菌株PEA014表面无突起,干粉状,菌落较细小,较规则的圆形,边缘无晕圈,呈灰白色,不产生可溶性色素;菌株PEA023表面有小的突起,褶皱状,菌落较小,较规则圆形;呈褐色,产生的可溶性色素为酱红色。
2.3虎杖内生放线菌的抑菌活性
采用滤纸片法对内生放线菌发酵液进行抑菌活性试验,结果由表3可见,菌株PEA005和PEA006对枯草芽孢杆菌和金黄色葡萄球菌等革兰氏阳性菌抑菌效果显著,而对大肠杆菌、铜绿假单胞菌等革兰氏阴性菌抑菌作用不显著。
2.4抑菌菌株的分子生物学鉴定
对2株具有较强抑菌作用的菌株PEA005、PEA006进行液体发酵培养,利用SDS-溶菌酶法提取菌株总DNA,并使用引物799F和1492R对16S rDNA进行PCR扩增,经上海生工生物科技有限公司进行双向测序,采用Mega5.5软件,按表2虎杖内生放线菌菌株的形态学特征
3结论与讨论
相关研究表明,较容易分离得到的植物内生菌是细菌和真菌,由于放线菌生长十分缓慢,且易被外源菌污染,许多放线菌特别是稀有放线菌未被发现[17-18]。选择性分离是虎杖内生放线菌分离的难点。
近年来,人们开展了大量有关植物内生放线菌的研究,并从药用植物虎杖中分离出许多新的放线菌。孔亚男等采用涂布法从虎杖组织中分离出47株内生放线菌,其中17株菌株对大肠杆菌、沙门氏菌、金黄色葡萄球菌、枯草芽孢菌、铜绿假单胞菌、白色念珠菌具有不同程度的抗菌活性,占所有分离菌株的36.2%,其中6株具有较明显的抑菌活性[19]。陈文强等对分离获得的41株内生放线菌进行抑菌试验时发现,有13株菌株至少对 1种靶标菌表现出不同的抑菌活性,其中2株菌株发酵液对金黄色葡萄球菌、枯草芽孢菌、大肠杆菌、沙门氏菌等4种靶标菌表现出不同程度的抑菌活性,显示了广谱的抗菌活性,可能具有很好的生物防治潜力[20]。
本研究采用平板划线法从秦巴山区药用植物虎杖根茎中分离得到16株内生放线菌,对其进行抗菌试验结果表明,菌株PEA005和PEA006对枯草芽孢杆菌的抑菌圈达到21~28 mm,对金黄色葡萄球菌的抑制圈达到13~20 mm,而对大肠杆菌和铜绿假单胞菌的抑制作用不显著。经鉴定,菌株PEA005和PEA006分属于拟诺卡菌属(Nocardiopsis)和小单孢菌属(Micromonospora)。
参考文献:
[1]李菁雯,陈祥龙,孟祥智.虎杖及其提取物的研究进展[J]. 中医药学报,2011,39(3):103-106.
[2]薛岚.中药虎杖的药理研究进展[J]. 中国中药杂志,2000,25(11):11-13.
[3]孔晓华,周玲芝.中药虎杖的研究进展[J]. 中医药导报,2009,15(5):107-110.
[4]王宏强,杨峰,杨慧龄.白藜芦醇对鼻咽癌细胞ATP酶抑制作用研究[J]. 中国医药科学,2013,3(3):44-46.
[5]Jang M,Cai L,Udeani G O,et al. Cancer chemopreventive activity of resveratrol,a natural product derived from grapes[J]. Science,1997,275(5297):218-220.
[6]Klibanov A M. Improving enzymes by using them in organic solvents[J]. Nature,2001,409(6817):241-246.
[7]Herre E A,Mejía L C,Kyllo D A,et al. Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae[J]. Ecology,2007,88(3):550-558.
[8]赵旭,常思静,景春娥,等. 我国植物内生菌研究进展[J]. 中国沙漠,2010,30(1):87-91.
[9]Fisher P J,Petrini O,Scott H M L. The distribution of some fungal and bacterial endophytes in maize (Zea mays L.)[J]. New Phytologist,1992,122(2):299-305.
[10]Demain A L. Antibiotics:natural products essential to human health[J]. Medicinal Research Reviews,2009,29(6):821-842.
[11]Demain A L,Sanchez S. Microbial drug discovery:80 years of progress[J]. The Journal of Antibiotics,2009,62(1):5-16.
[12]杜慧竟,苏静,余利岩,等. 药用植物内生放线菌的分离和生物学特性[J]. 微生物学报,2013,53(1):15-23.
[13]刘芸,殷红,仇农学.一株产白藜芦醇虎杖内生真菌的分离和鉴定[J]. 菌物学报,2010,29(4):502-507.
[14]刘华金,易有金,杨建奎,等. 转化白藜芦醇苷虎杖内生真菌的分离和鉴定[J]. 食品科学,2012,33(11):172-176.
[15]彭浩,陈文强,邓百万,等. 1株产白藜芦醇及白藜芦醇苷虎杖内生真菌的分离鉴定[J]. 江苏农业科学,2012,40(8):342-345.
[16]阮继生,黄英.放线菌快速鉴定与系统分类[M]. 北京:科学出版社,2011.
[17]张曼,解修超,陈文强,等. 红豆杉内生放线菌的分离及活性菌株的筛选与鉴定[J]. 食品与生物技术学报,2012,31(5):549-554.
[18]彭浩,陈文强,邓百万,等. 药用植物虎杖内生菌的研究现状与应用展望[J]. 江苏农业科学,2014,42(8):1-4.
[19]孔亚男,陈文强,邓百万,等. 虎杖内生放线菌的分离鉴定及抗菌活性[J]. 福建农林大学学报:自然科学版,2012,41(6):616-621.
[20]陈文强,彭浩,邓百万,等. 药用植物虎杖内生放线菌的分离及抑菌活性的研究[J]. 陕西理工学院学报:自然科学版,2012,28(6):61-67.

