实时荧光聚合酶链式反应法检测食品中狗源性成分
高晓丽,杨昕霆,薛晨玉,王 丹,赵琳娜,侯彩云,*(.中国农业大学食品科学与营养工程学院,北京00083;.北京市食品安全监控中心,北京0004)
实时荧光聚合酶链式反应法检测食品中狗源性成分
高晓丽1,杨昕霆2,+,薛晨玉2,王丹2,赵琳娜2,侯彩云1,*
(1.中国农业大学食品科学与营养工程学院,北京100083;2.北京市食品安全监控中心,北京100041)
根据狗线粒体NADH氧化还原酶亚基2基因(ND2)中的序列设计了狗特异性引物和Taqman探针,建立了食品中狗源性成分的实时荧光聚合酶链式(Real-time PCR)检测方法。实验表明,该方法可以很好地区分狗与其他常见的14个物种,引物、Taqman探针特异性良好,检测灵敏度可达100fg,适用于食品中狗源性成分的快速鉴定。
Real-time PCR,线粒体ND2基因,狗源性成分
近年来,食品中肉制品的安全问题日益突出,如国内的“假牛、羊肉事件”、“假鸭血事件”,国外的“马肉风波”、“假鳕鱼事件”。食品中的掺杂作假现象,不仅严重侵害消费者的权益,引发对食品安全的信任危机,一些疫情的发生与传播也往往起因于不安全的动物食品[1-2]。我国针对饲料、明胶、化妆品中含有的猪、牛、羊、马、驴、兔、狗等动物源性成分制定了相关标准[3],但关于食品中动物源性成分的检测标准并不完善。因此,建立准确、快速的食品中动物源性成分筛查方法至关重要。
国内外学者主要基于PCR方法对动物源性成分的鉴定进行了研究,大量报道了猪、牛、羊、鸡、火鸡、鸭、鹅、马、驴等常见物种的普通PCR[4-10]和荧光PCR[11-18]研究,但针对狗源性成分鉴定的研究报道还不多。Tobe等[19]基于线粒体cytb基因建立了18个欧洲常见物种(狗、猫、牛、马、驴、狐狸、山羊等)的多重PCR检测方法,能够鉴别混合肉中各物种340fg的模板DNA。Martin等[20]建立了食品和饲料中狗、猫、鼠源性成分鉴定的普通PCR方法,检测限为0.1%。我国国标中只制定了动物源性饲料中狗源性成分的普通PCR定性检测方法,检出限为0.1%[21]。
在食品中动物源性成分的鉴定方面,与普通PCR和多重PCR法相比,实时荧光PCR法具有特异性强、灵敏度高、重现性好、有效降低污染、可实时监测等优点,是目前应用较普遍的方法之一[22]。本研究设计了狗线粒体ND2基因特异性引物和Taqman探针,建立了食品中狗源性成分的实时荧光PCR检测方法。该方法可为保障食品安全、制定相应标准等提供参考。
1 材料与方法
1.1材料与仪器
猪肉、牛肉、山羊肉、绵羊肉、鸡肉、鸭肉、鹅肉、鸽子肉、鹌鹑肉、兔肉等动物材料购自北京市农贸市场或超市;骆驼肉、马肉、驴肉、狗肉、猫肉等动物材料为实验室自存;20个牛羊肉串样品购自北京市农贸市场;Tris-平衡酚、氯仿、无水乙醇、异丙醇、乙酸钠均为国产分析纯;CTAB提取缓冲液(20g/L CTAB,1.4mol/L NaCl,0.02mol/L Na2EDTA,0.1mol/L Tris-HCl,pH=8.0)、TE缓冲溶液(10mmol/L Tris-HCl,pH=8.0,1mmol/L EDTA)由本实验室配制;Taqman实时荧光PCR预混合液(Premix Ex Taq)购自宝生物工程(大连)有限公司;狗ND2基因序列特异的上下游引物、Taqman探针由北京赛百盛基因技术有限公司合成。
核酸蛋白定量分析仪(分光光度计)德国Eppendorf公司;核酸自动提取仪QIA Cube美国QIA Gene公司;3K18冷冻离心机德国Sigma公司;MyiQ单色实时定量PCR仪美国伯乐公司;超低温冰箱(-40℃)Biomedical freezer日本SANYO公司;Mili-Q纯水器美国Milipore公司。
1.2动物组织基因组DNA的提取[23]
用灭菌手术剪分别剪取适量的猪肉、牛肉、山羊肉、绵羊肉、鸡肉、鸭肉、鹅肉、鸽子肉、鹌鹑肉、兔肉、骆驼肉、马肉、驴肉、狗肉、猫肉的肌肉组织,剪碎置于研钵中(注意防止交叉污染);加入石英砂,用液氮充分研磨至粉末状,迅速取2g左右于2.0mL离心管中,立即加入1mL CTAB,混匀;置于核酸自动提取仪中加热振荡,消化30min;离心取600μL上清液于新的2.0mL离心管中,加入等体积的氯仿和Tris-平衡酚各300μL(1∶1,V/V),用力振荡5min,使其充分反应,12000r/min室温离心10min;取上清,加入600μL氯仿,同上,12000r/min室温离心10min;取上清,加10%体积3mol/L乙酸钠和2倍体积无水乙醇,轻缓颠倒数次,可见白色絮状DNA,12000r/min室温离心10min,弃上清液;加入1mL 70%乙醇洗涤沉淀2次,12000r/min室温离心10min,弃乙醇;待DNA沉淀干燥后,将DNA溶于50~100μL无菌水中,用核酸蛋白定量分析仪测定DNA浓度,置于-20℃保存备用。
1.3引物与Taqman探针的设计
根据NCBI基因数据库已注释的、不同品系的狗(Canis lupus familiaris)线粒体序列(Accession Number:NC_002008,GI:17737322)和猪、牛、山羊、绵羊、鸡、鸭、鹅、鸽子、鹌鹑、兔、骆驼、马、驴、猫等物种的线粒体序列,分析生物进化树的规律,使用DNAMAN软件比对以上所有基因序列。选择种内保守、种间差异较大的基因片段,根据引物和Taqman探针的设计原则,应用Primer Express软件,设计引物和Taqman探针,将设计的引物和探针序列在NCBI的Blast中搜索、比对,最后选取既可以保证种内保守,又能保证种间特异的狗源性成分引物和Taqman探针。
1.4引物和Taqman探针特异性的验证
以狗肉基因组DNA为阳性对照,猪、牛、山羊、绵羊、鸭、鸡等14个物种基因组DNA为阴性对照,空白对照中以水代替DNA模板。所有DNA模板的质量浓度均稀释至100ng/μL。实时荧光PCR反应体系为20μL,具体包括:Premix buffer(2×)10μL、上游引物(10μmol/L)0.5μL、下游引物(10μmol/L)0.5μL、Taqman探针(10μmol/L)1μL、DNA模板1μL、无菌水将体系补充至总体积20μL。实时荧光PCR扩增条件为:95℃预变性30s;95℃变性5s;60℃延伸30s,记录荧光值,40个循环。
在实时荧光PCR中,Ct值是指每个反应管内的荧光信号达到设定的阈值时所经历的循环数。实时荧光PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺损设置是3~15个循环的荧光信号的标准偏差的10倍,即threshold=10XSD cycle 6~15。因此,以Ct值小于35为阳性,Ct值大于35为阴性。特异性验证实验重复三遍。
1.5灵敏度和扩增效率检测
在检测该方法的灵敏度实验中,将狗肉基因组DNA溶液分别稀释为102、101、100、10-1、10-2、10-3、10-4、10-5ng/μL,每个浓度进行3次重复实验,设置空白对照。根据各梯度的扩增曲线Ct值,建立Ct值-lg[DNA]的标准曲线。依据扩增效率计算公式Efficiency(%)=(-1+10[-1/slope])×100,得到PCR反应扩增效率。以Ct值为判断标准,确定检出的最低浓度,作为该反应体系的检测灵敏度。
1.6市售肉制品中狗源性成分的检测
在北京农贸市场中随机取样20个牛、羊肉串,检验是否有掺杂掺假狗肉的情况。提取样本基因组DNA,按照实时荧光反应体系,设置阳性对照、阴性对照和空白对照,进行实时荧光PCR反应。
2 结果与分析
2.1阳性物种样本的鉴定
以CO1基因的DNA条形码[24-25]扩增狗肉基因组DNA,并对扩增产物进行测序。将测序结果在NCBI中Blast搜索,结果如图1所示。序列相似性为99%,从而确定狗物种样本的真实性。
2.2引物和Taqman探针的特异性检测结果
在特异性实验中,用狗ND2基因特异性引物和Taqman探针体系分别扩增猪肉、牛肉、山羊肉、绵羊肉、鸭肉、鸡肉、鹅肉、鸽子肉、鸵鸟肉、鹌鹑肉、兔肉、马肉、驴肉、猫肉的基因组DNA模板。结果表明,非目标物种基因组DNA的扩增曲线的Ct值均大于35,说明狗引物和Taqman探针特异性良好,如图2所示。
2.3灵敏度、扩增效率检测结果
以10倍为稀释梯度,狗基因组DNA分别稀释为102、101、100、10-1、10-2、10-3、10-4、10-5ng/μL。在10-5ng/μL浓度下,未检测到目标物种。在102~10-4ng/μL浓度范围内,建立Ct值-lg[DNA]的标准曲线,如图3所示。标准曲线的R2为0.9957,线性相关度良好。PCR反应扩增效率为108%。DNA浓度为10-4ng/μL时,Ct值为34.6。该引物、Taqman探针的实时荧光反应体系可检出10-4ng的模板DNA量。因此,灵敏度为100fg。
2.4市售样本的检测结果
在对市售的20个牛、羊肉串检测实验中,设置阳性对照、阴性对照和空白对照。检测样本、阴性对照、空白对照中并未检出狗源性成分,阳性对照扩增曲线完好。说明,狗引物、Taqman探针具有很强的实际应用价值。
3 结论与讨论
线粒体DNA是高等动物唯一的核外遗传物质,是检测中比较理想的靶基因,而且细胞中均含有大量的线粒体。目前,国内外学者关于线粒体的测序及其他研究已经非常透彻,在NCBI基因数据库中有大量已发表并做注释的线粒体序列,便于针对不同的物种进行引物和探针的设计。目前,国内外学者主要以线粒体中cytb、D-loop、12S rRNA、16S rRNA、ND1、ND2等基因作为目标基因位点,本研究通过筛查狗线粒体中的不同基因,并将设计的引物和探针序列在NCBI的Blast中搜索、比对,最终在狗线粒体ND2基因位点上,发现既可以保证种内保守,又可保证种间特异的引物和探针序列。因此,选取了狗线粒体ND2基因序列片段设计了引物和Taqman探针。

图1 DNA条形码扩增产物在NCBI中Blast搜索比对结果Fig.1 Sequence alignment of sequence amplification product
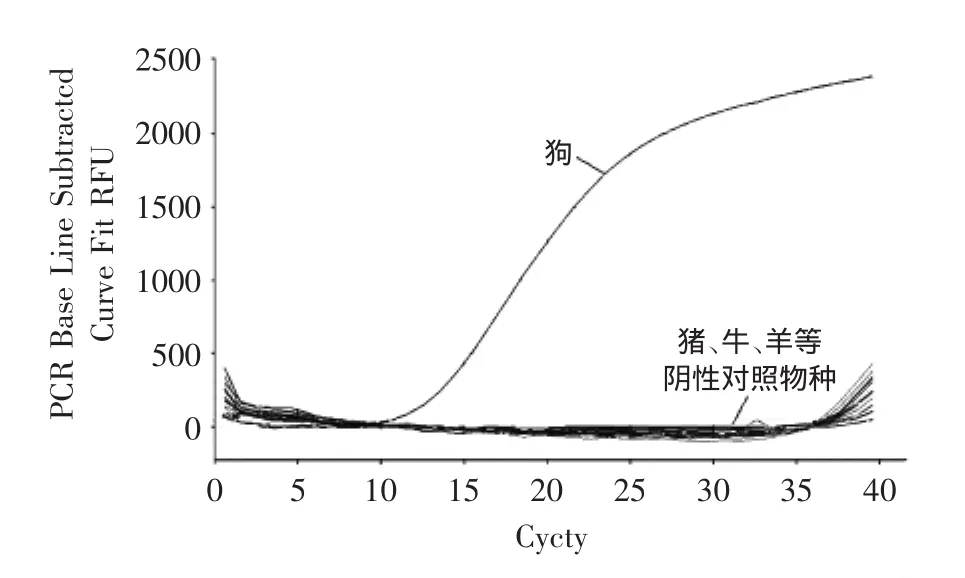
图2 狗源性引物探针实时荧光PCR的特异性检测结果图Fig.2 Specific detection of real-time PCR for dog
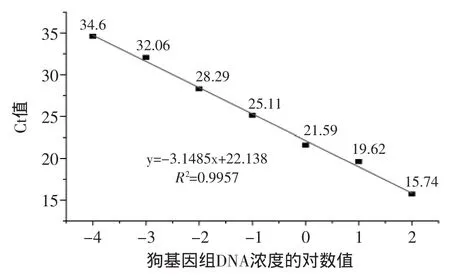
图3 Ct值-lg[DNA]的标准曲线Fig.3 Standard curve showing ct values in relation to the concentration of initial target gene copies
在实际样本的检测中,通过阳性对照、阴性对照和空白对照实验,检测样本中并未检出狗源性成分。需要注意点是,由于该方法的灵敏度较高,根据动物源性成分检出量,不能判断是意外污染还是蓄意添加。因此,需要结合其他方法进一步实验,以便更好的判断掺杂作假的程度。此外,该Taqman探针的荧光PCR反应体系是否适用于肉骨粉、明胶、化妆品中的狗源性成分的检测,还有待于进一步验证。
总之,狗ND2基因特异性引物、Taqman探针的荧光PCR反应体系特异性好,灵敏度高,稳定性强,实用性强,适用于食品中狗源性成分的检测,可为食品安全检测、打击掺假掺杂等违法行为提供技术参考。
[1]卜登攀,王加启,贺云霞,等.动物源性饲料检测技术研究进展[J].中国畜牧兽医,2008,35(2):54-59.
[2]陈文炳,邵碧英,廖宪彪,等.加工食品中若干动物成分的PCR检测技术应用研究[J].食品科学,2005,26(8):338-342.
[3]李家鹏,乔晓玲,田寒友,等.食品和饲料中动物源性成分检测技术研究进展[J].食品科学,2011,32(9):340-347.
[4]张慧霞,张利平,吴建平,等.鹌鹑源性成分PCR检测方法的建立[J].中国兽医科学,2008,38(4):346-349.
[5]陈颖,吴亚军,徐宝梁,等.食品及饲料中马属动物源性成分的PCR检测研究[J].中国生物工程杂志,2004,24(5):78-83.
[6]Colombo F,Viacava R,Giaretti M.Differentiation of the species ostrich(Struthio camelus)and emu(Dromaius novaehollandiae)by polymerase chain reaction using an ostrich-specific primer pair[J].Meat Science,2000,56(1):15-17.
[7]Wan Q H,Fang S G.Application of species-specific polymerase chain reaction in the forensic identification of tiger species[J].Forensic Science International,2003,131(1):75-78.
[8]Chen Y,Wu Y J,Xu B L,et al.Species-specific polymerase chain reaction amplification of camel(Camelus)DNA extracts[J]. Journal of Aoac International,2005,88(5):1394-1398.
[9]Haunshi S,Basumatary R,Girish P S,et al.Identification of chicken,duck,pigeon and pig meat by species-specific markers of mitochondrial origin[J].Meat Science,2009,83(3):454-459.
[10]Rodriguez M A,Garcia T,González I,et al.PCR identification of beef,sheep,goat,and pork in raw and heat-treated meat mixtures[J].Journal of Food Protection®,2004,67(1):172-177.
[11]Ahmad A I,Ghasemi J B.New FRET primers for quantitativereal-time PCR[J].Analytical and Bioanalytical Chemistry,2007,387(8):2737-2743.
[12]Jonker K M,Tilburg J,Hägele G H,et al.Species identification in meat products using real-time PCR[J].Food Additives and Contaminants,2008,25(5):527-533.
[13]Laube I,Zagon J,Broll H.Quantitative determination of commercially relevant species in foods by real-time PCR[J]. International Journal of Food Science&Technology,2007,42(3):336-341.
[14]Köppel R,Zimmerli F,Breitenmoser A.Heptaplex real-time PCR for the identification and quantification of DNA from beef,pork,chicken,turkey,horse meat,sheep(mutton)and goat[J]. European Food Research and Technology,2009,230(1):125-133.
[15]Hanna S E,Connor C J,Wang H H.Real-time Polymerase ChainReactionfortheFoodMicrobiologist:Technologies,Applications,and Limitations[J].Journal of Food Science,2005,70(3):R49-R53.
[16]Sawyer J,Wood C,Shanahan D,et al.Real-time PCR for quantitative meat species testing[J].Food Control,2003,14(8):579-583.
[17]Kesmen Z,Gulluce A,Sahin F,et al.Identification of meat species by TaqMan-based real-time PCR assay[J].Meat Science,2009,82(4):444-449.
[18]Chisholm J,Sánchez A,Brown J,et al.The development of species-specific real-time PCR assays for the detection of pheasant and quail in food[J].Food Analytical Methods,2008,1(3):190-194.
[19]Tobe S S,Linacre A M T.A multiplex assay to identify 18 European mammal species from mixtures using the mitochondrial cytochrome b gene[J].Electrophoresis,2008,29(2):340-347.
[20]Martín I,García T,Fajardo V,et al.Technical Note:Detection of cat,dog,and rat or mouse tissues in food and animal feed using species-specific polymerase chain reaction[J].Journal of Animal Science,2007,85(10):2734-2739.
[21]中国人民共和国山东出入境检验检疫局,中国检验检疫科学研究院,中华人民共和国辽宁出入境检验检疫局,等.GB/T 21105-2007动物源性饲料中狗源性成分定性检测方法PCR方法[S].2007.
[22]Fajardo V,González I,Rojas M,et al.A review of current PCR-based methodologies for the authentication of meats from game animal species[J].Trends in Food Science&Technology,2010,21(8):408-421.
[23]Sambrook J,萨姆布鲁克,Russell D W,et al.分子克隆实验指南[M].北京:科学出版社,2002.
[24]Hebert P D N,Cywinska A,Ball S L.Biological identifications through DNA barcodes[J].Proceedings of the Royal Society of London.Series B:Biological Sciences,2003,270(1512):313-321.
[25]Hebert P D N,Ratnasingham S,de Waard J R.Barcoding animal life:cytochrome c oxidase subunit 1 divergences among closely related species[J].Proceedings of the Royal Society of London.Series B:Biological Sciences,2003,270(S1):96-99.
Detection for dog-derived components in foods by real-time polymerase chain reaction
GAO Xiao-li1,YANG Xin-ting2,+,XUE Chen-yu2,WANG Dan2,ZHAO Lin-na2,HOU Cai-yun1,*
(1.School of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.Beijing Municipal Center for Food Safety Monitoring,Beijing 100041,China)
A rapid and highly species-specific real-time polymerase chain reaction(PCR)assay had been developed for the detection of dog-derived components in meat and meat mixtures.Primers and Taqman probe were designed on the mitochondrial ND2,and the performance of the method was tested.Results showed that no cross-reaction was observed between the dog and non-target species,and this method revealed a high sensitivity and could detect 100fg of dog template DNA.In conclusion,this real-time PCR assay could be a rapid and straightforward method for the accurate identification of dog-derived components in food.
Real-time PCR;mitochondrial ND2 gene;dog-origin ingredient
TS201.6
A
1002-0306(2015)02-0061-04
10.13386/j.issn1002-0306.2015.02.004
2014-04-09+为并列第一作者
高晓丽(1990-),女,硕士研究生,研究方向:农产品加工与贮藏。杨昕霆(1986-),男,硕士研究生,研究方向:动物源性成分检测。
侯彩云(1963-),女,博士研究生,教授,研究方向:食品科学与加工技术。
北京市科技计划课题(Z131100005613005)。

