丙肝病毒RNA提取方法优化研究
刘学敏 陈丽茹 马冬雪等
[摘 要] 目的:比较微柱离心法与微柱负压泵两种核酸提取方法提取丙型肝炎病毒核糖核酸(HCV RNA)优劣。方法:对160例HCV抗体阳性的患者血清,分别采用两种核酸提取方法提取HCV RNA,对所提RNA同时采用荧光定量技术检测RNA含量,比较两种方法提取纯度、对检测灵敏度、重复性影响;结果:离心法提取RNA浓度纯度明显高于负压泵法,两种方法灵敏度无统计学差异,离心法结果稳定,高于负压泵法近20 %,预计重复性达99 %,差异有统计学意义(P < 0.05);结论:离心法有效提高了RNA提取效率,提高了检测重复性。
[关键词] 丙肝病毒,HCV;核酸提取;荧光定量聚合酶链反应
中图分类号:R331 文献标识码: B 文章编号:2095-5200(2015)05-050-03
丙型肝炎病毒(简称丙肝病毒,Hepatitis C Virus, HCV)是慢性肝炎、肝硬化和肝细胞癌(hepatocellular carcinoma, HCC) 诱因之一[1-2]。HCV诊断需提取患者血清中HCV RNA 进行检测[3-4]。RNA提取质量直接决定了诊断准确性[5-6]。荧光定量法能准确反映HCV患者体内病毒载量,且检测灵敏度和特异度高,能有效缩短检测窗口期[7-8]。目前市场上多数试剂盒对HCV RNA提取采用酚-氯仿提取法,该提取法工作量大、操作复杂,提取纯度和分离效率一般,日常科研工作中难度较大。本文拟通过纯化柱方法提取HCV RNA,比较离心法与负压泵法抽取方法提取HCV RNA优劣,将提取RNA通过实时荧光定量PCR进行检测。
1 实验部分
1.1 材料
160例HCV阳性血清标本来自本院2014年5 ~ 12月门诊及住院丙肝患者,阴性血清来自无肝病史且HCV RNA阴性健康体检者。
1.2 仪器与试剂
Roche公司Light-cycle荧光定量PCR分析仪;两种微柱核酸提取法所用试剂及PCR扩增试剂均购自凯杰生物工程深圳有限公司,试剂盒最低检测限为5.0×102 U/mL。
1.3 标本采集
病人血清样本分别加入2 mL以乙二胺四乙酸二钠(EDTA-2Na)抗凝,并在3 h内分离血浆,-80 ℃ 冰箱保存。
1.4 微柱负压泵提取法
(1)将血清样本标记,分别取待测血浆和对照品及标准品各100 μL,向各管中加入100 μL裂解液(已加有助沉剂),用移液枪反复吹打5~8次,加入20 μL 去抑制剂,离心数秒,70 ℃反应10 min;(2)离心数秒,分别向各样品中加入110 μL无水乙醇,振荡混匀,离心数秒;(3) 核酸提取柱插入连接管后,固定在负压装置上,并做上标记,然后将上一步中所有液体小心转入相应核酸提取柱中,开启负压,抽干核酸提取柱中全部液体;(4)加入500 μL洗涤液A到提取柱内,开启负压,抽干柱中所有液体;(5)加入500 μL洗涤液B,开启负压,抽干柱内所有洗涤液;(6)取出核酸提取柱,放入无RNA酶2 mL离心管中,14000 r/min离心1 min,弃掉废液及离心管;(7)将提取柱放入另一新无RNA酶2 mL离心管中,小心将50 μL洗脱液加在柱内中央,静置1 min; 10000 r/min离心1 min;(8)离心管中收集液即为HCV RNA溶液,存于-80℃备用。
1.5 微柱离心法
(1)将待测血浆和对照品及标准品100 μL分别加入等体积已混有助沉剂裂解液充分裂解,再分别加入20 μL 去抑制剂,离心数秒,置70 ℃反应10 min;(2)然后将上清转移入加入吸附柱RA中(吸附柱套在收集管中);(3)在10000 r/min条件下离心45 s,去除收集管中废液,并将吸附柱重新放入收集管中;(4)加500 μL去蛋白液RE,12000 r/min离心45 s,弃掉废液;(5)加700 μL漂洗液RW,12000 r/min离心30 s,弃掉废液;(6)加500 μL漂洗液RW,120000 r/min离心30 s,弃掉废液。(7)将吸附柱放入收集管中,12000 r/min离心1 min,尽量去除漂洗液,减少残留乙醇对下游反应影响;(8)取出吸附柱,将其放入一个新无RNA 酶离心管中,加入50 μLDEPC水(事先在65℃-70℃水浴中加热效果更好),室温放置2 min。12000 r/min离心30 s,收集得到RNA存于-80℃备用。
1.6 HCV RNA定量检测
两种提取方法均采用相同试剂进行检测,操作严格按试剂说明书进行,逆转录和扩增均在仪器上一次完成。最低检测下限均为500 U/mL。
1.7 灵敏度比较
HCV强阳性血清及用阴性血清10倍倍比稀释系列稀释血清标本,将所有病例分成6组,分别用上述两种方法提取HCV RNA,将提取RNA进行荧光定量检测,定量结果计算对数值,比较两种方法提取灵敏度。
1.8 重复性比较
取上述中等含量HCV RNA标本1份,分别用上述两种方法各提取核酸10次进行荧光定量检测,定量结果计算对数值,比较两种方法提取重复性。
1.9 统计分析
应用SPSS17.0 分析软件进行统计学分析组间比较采用t检验,以P < 0.05为具有显著差异,即有统计学意义。
2 结果
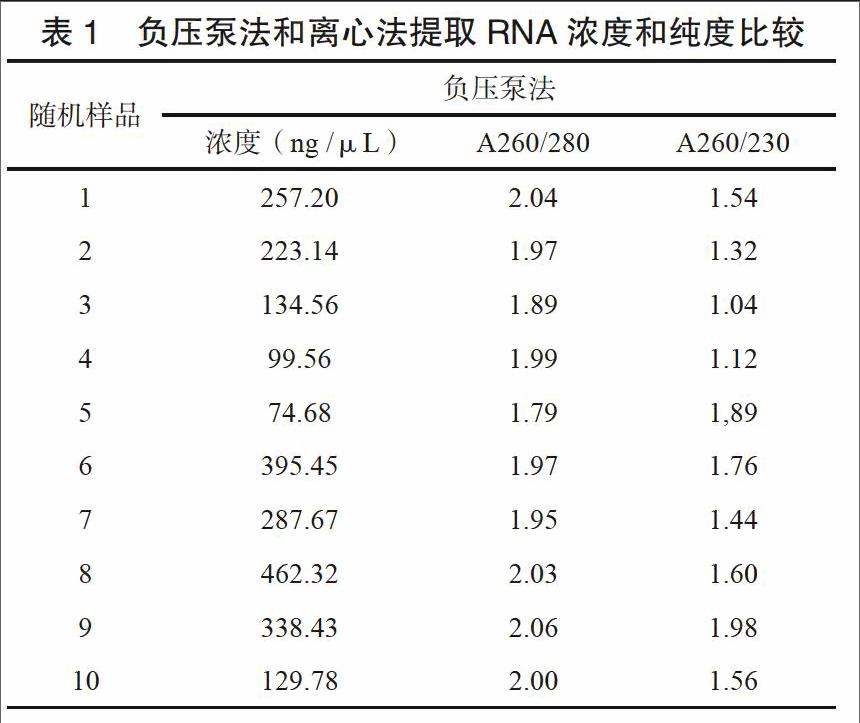
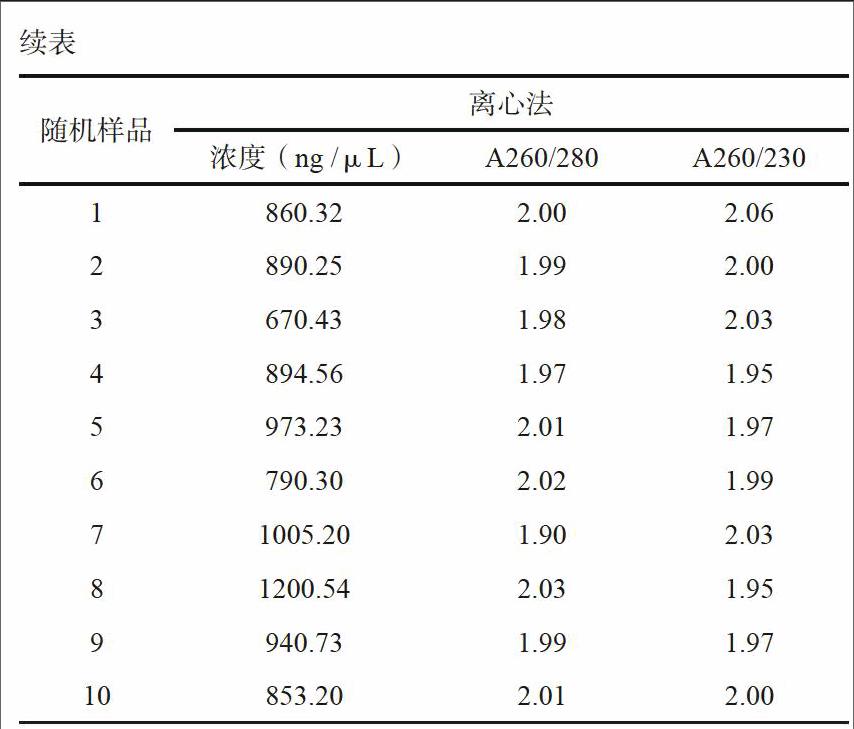
2.1 HCV RNA浓度和纯度比较
将负压泵法和离心法提取RNA随机取出少量,用Nano drop 2000 分别检测两种方法提取RNA浓度和纯度,进行比较。结果如下表,用离心法提取RNA浓度明显高于负压泵法,而且从A260/280和A260/230比值来看,离心法提取RNA纯度也明显好于负压泵法。
2.2 HCV阳性率分析
以负压泵法及微柱离心法提取HCV RNA,进行定量检测,阳性率分别为60.6 %(97/160)、79.4 %(127/160)。微柱离心法所提RNA阳性率高于负压泵提取法。
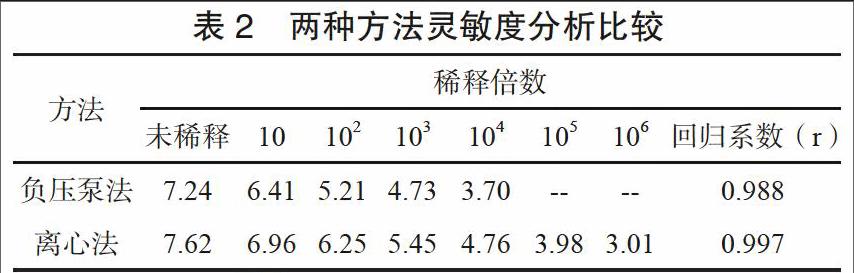
2.3 灵敏度分析
两种核酸提取方法灵敏度无显著性差别,基本都可以满足临床应用。但微柱离心法检测限相较于负压泵发更低,对临界值附近低浓度样本提取效果更好。以微柱负压泵提取法提取RNA,其浓度水平检测下限为9.34×106 U/mL,中位数为4.16×104 copy/ mL;以微柱离心法提取RNA检测其浓度水平,检测下限为9.83×107 U/mL,中位数为8.82×104 copy/mL。将两法结果换算成对数值经t检验,两者差异无统计学意义(P> 0.05)。见表2。
2.4 重复性比较
取中等含量标本1份,分别两种方法各提取核酸10次,然后对所提RNA进行定量PCR检测,定量结果对数值分别为:负压泵法为4.26,变异系数(CV)为13.12%,微柱离心法为4.68,变异系数(CV)为0.86 %。即通过微柱离心法提取HCV RNA重复性好,可达99%以上。
3 讨论
临床上目前较多应用荧光定量PCR对HCV RNA进行定量检测[9-10]。这种方法采用闭管操作不易造成产物污染,具有敏感、特异、快速优点[11-12]。荧光定量PCR实验要求较高,其中提取核酸作为扩增反应模板是整个检测中最重要前期步骤,提取核酸处理方法不同可直接影响PCR效果与实验检测结果[13-14]。
本研究采用了负压泵法和微柱离心法两种方法分别提取HCV RNA,对两种方法灵敏度、重复性以及所提RNA质量进行检测分析。实验结果表明,这两种核酸提取方法灵敏度无显著性差别,但微柱离心法重复性明显优于负压泵法,可达99 %以上。从提取RNA浓度和纯度来看,微柱离心法提去浓度均在800~1000 ng /μL左右,而负压泵法提取RNA浓度则在200~400 ng/μL左右,明显低于微柱离心法提取RNA浓度。另一方面从提取纯度(A260/280和A260/230比值)来看,微柱离心法提取RNA纯度明显比负压泵法高。本研究结果显示离心法提取,有效提高了RNA提取效率,提高了检测重复性。
参 考 文 献
[1] 谭跃, 黄淑媛, 刘勇. 丙型肝炎病人在治疗过程中 HCV-RNA 含量, 血清抗 HCV 抗体及其生化指标变化[J]. 国际医药卫生导报, 2009, 15(17): 8-11.
[2] 乔斌, 汪明, 袁乐永, 等. 丙型肝炎病毒基因型与慢性丙型肝炎患者病情严重程度之间关系研究[J]. 医学检验, 2012,15(1): 4.
[3] 赵辉, 谢尧, 李明慧, 等. 慢性丙型肝炎患者血清 HCV 基因型和 RNA 含量与 ALT 和 AST 水平不相关[J]. 中华检验医学杂志, 2007, 30(6): 631-634.
[4] 王露楠, 吴健民, 李金明, 等. 丙型肝炎病毒核酸检测国家标准物质研制[J]. 中华检验医学杂志, 2006, 29(4): 354-357.
[5] Keys J R, Leone P A, Eron J J, et al. Large scale screening of human sera for HCV RNA and GBV‐C RNA[J]. Journal of medical virology, 2014, 86(3): 473-477.
[6] Maasoumy B, Cobb B, Bremer B, et al. Detection of low HCV viraemia by repeated HCV RNA testing predicts treatment failure to triple therapy with telaprevir[J]. Alimentary pharmacology & therapeutics, 2014, 39(1): 85-92.
[7] Greco M, Sáez C A, Brown M T, et al. A simple and effective method for high quality co-extraction of genomic DNA and total RNA from low biomass Ectocarpus siliculosus, the Model Brown Alga[J]. PloS one, 2014, 9(5): 96470.
[8] 张言超,陈明,李强. 荧光定量PCR检测HCV RNA两种核酸提取法比较[J]. 放射免疫学杂志,2010, 23(5), 582-583.
[9] Sarrazin C, Wedemeyer H, Cloherty G, et al. Importance of very early HCV RNA kinetics for prediction of treatment outcome of highly effective all oral direct acting antiviral combination therapy[J]. Journal of virological methods, 2015, 214: 29-32.
[10] Santos C, Reis A, dos Santos C V, et al. The use of real-time PCR to detect hepatitis C virus RNA in dried blood spots from Brazilian patients infected chronically[J]. Journal of virological methods, 2012, 179(1): 17-20.
[11] Das A, Spackman E, Pantin-Jackwood M J, et al. Removal of real-time reverse transcription polymerase chain reaction (RT-PCR) inhibitors associated with cloacal swab samples and tissues for improved diagnosis of avian influenza virus by RT-PCR[J]. Journal of Veterinary Diagnostic Investigation, 2009, 21(6): 771-778.
[12] 李晓丰, 刘显智, 杨丽艳, 等. 实时荧光定量 PCR 筛查献血者 HCV RNA 初步研究[J]. 中国输血杂志, 2006, 19(1): 39-40.
[13] Mikel P, Vasickova P, Kralik P. Methods for Preparation of MS2 Phage-Like Particles and Their Utilization as Process Control Viruses in RT-PCR and qRT-PCR Detection of RNA Viruses From Food Matrices and Clinical Specimens[J]. Food and environmental virology, 2015: 1-16.
[14] Liu S, Hou G, Zhuang Q, et al. A SYBR Green I real-time RT-PCR assay for detection and differentiation of influenza A (H1N1) virus in swine populations[J]. Journal of virological methods, 2009, 162(1): 184-187.

