糖尿病脑病大鼠皮层中蛋白激酶Cγ的表达及作用
王玥 杨秋实 韩松 罗艳琳 李俊发 赵丽.首都医科大学附属北京朝阳医院神经内科,北京0000;.首都医科大学基础医学院神经生物学系,北京00069
糖尿病脑病大鼠皮层中蛋白激酶Cγ的表达及作用
王玥1杨秋实2韩松2罗艳琳2李俊发2赵丽21.首都医科大学附属北京朝阳医院神经内科,北京1000201;2.首都医科大学基础医学院神经生物学系,北京100069
目的探讨糖尿病脑病大鼠皮层中蛋白激酶Cγ(PKCγ)表达及作用。方法36只成年雄性SD大鼠随机分为正常对照组(N组)、2型糖尿病模型组(DM组)、2型糖尿病模型+侧脑室DMSO注射组(DM+DMSO组)和2型糖尿病模型+侧脑室注射Go6983组(DM+Go6983组),每组各9只。N组采用正常饲料喂养,DM组、DM+DMSO组、DM+Go6983组通过高脂饮食和腹腔注射链尿佐菌素(STZ)建立2型糖尿病模型,之后DM+DMSO组、DM+Go6983组分别予以侧脑室注射DMSO、Go6983 5 μL。通过Morris水迷宫检测大鼠空间记忆能力。放免法检测血清胰岛素水平。取大鼠前额叶皮层组织,通过Wertern blot法检测PKCγ蛋白表达和亚细胞分布。结果与N组比较,DM组大鼠水迷宫逃避潜伏期时间延长,搜索策略能力降低,空腹血糖显著升高,血清胰岛素水平和体重明显减少,差异均有统计学意义(P<0.05)。与DM组、DM+DMSO组比较,DM+Go6983组大鼠水迷宫逃避潜伏期进一步延长,搜索策略得分显著降低,差异均有统计学意义(P<0.05)。与N组比较,DM组大鼠皮层PKCγ蛋白全细胞表达量未有明显变化(P>0.05),膜转位水平明显高于正常脑组织,差异有统计学意义(P<0.05)。结论PKCγ膜转位(激活)可能在2型糖尿病脑病的发展过程中起到神经保护作用。
糖尿病脑病;PKCγ;皮层;膜转位;Morris水迷宫
糖尿病脑病是由于长期高血糖及其引起的代谢紊乱造成大脑结构、生理功能等多方面发生一列病理改变,其主要临床表现为学习能力下降、记忆力衰退、注意力不集中和认知功能障碍等[1-2],严重者可以发展为阿尔茨海默病[3]。糖尿病脑病病因相对复杂,具体的发生机制尚不清楚。已有研究表明,高血糖引起DAG合成增加,从而激活蛋白激酶C(protein kinase C,PKC),PKC又通过激活多条信号通路参与了糖尿病并发症的损伤过程[4]。根据激活方式的不同,可将PKC分为以下亚型:α、βⅠ、βⅡ、γ、δ、ε、ζ、η、θ、μ、ν、ι/λ。然而尚无研究探讨PKC各个亚型在糖尿病脑病中的作用。PKCγ特异地表达于神经元,本研究拟利用大鼠2型糖尿病模型,应用Western blot方法观察2型糖尿病大鼠大脑皮层PKCγ蛋白表达量和膜转位情况,并通过Morris水迷宫初步探讨PKCγ在糖尿病脑病发生发展过程中的作用。
1 材料与方法
1.1实验动物及试剂
清洁级雄性SD大鼠,体重200~250 g,由首都医科大学实验动物中心提供[动物合格证号:SCSK(京)2012-0001]。兔源性多克隆抗体Anti-PKCγ(一抗,Santa Cruz公司),鼠源性单克隆抗体Anti-actin(一抗,Sigma Aldrich公司),辣根过氧化物酶标记的山羊抗兔抗体和山羊抗鼠抗体(二抗,Proteintech公司),链脲佐菌素(STZ,Sigma Aldrich公司),细胞膜蛋白与细胞浆蛋白抽提试剂盒(碧云天公司)。
1.2糖尿病大鼠模型的建立
健康成年SD雄性大鼠36只,随机分为4组:正常对照组(N组)、2型糖尿病模型组(DM组)、2型糖尿病模型+侧脑室DMSO注射组(DM+DMSO组)和2型糖尿病模型+侧脑室注射Go6983组(DM+Go6983组),每组各9只。正常对照组喂以正常饲料(蛋白质19%,碳水化合物67%,脂肪4%),其余三组喂以高脂饲料(蛋白质26%,碳水化合物26%,脂肪35%)。高脂饮食喂养4周,大鼠禁食12 h后一次性腹腔注射STZ 35 mg/kg,并继续高脂喂养;正常对照组腹腔注射柠檬酸缓冲液,继续正常饲料喂养。1周后剪尾采血测空腹血糖,以空腹血糖值≥7.8 mmol/L为成模标准。Morris水迷宫测试前24 h,选择大鼠右侧侧脑室(前囟后1 mm、中线旁开1.8 mm、颅骨表面下4.2 mm),用10 μL微量注射器缓慢注入5 μL所需药品,分别为DMSO和Go6983(溶于DMSO,10 μmol/L)[5],给药后缓慢退针,缝合伤口。
1.3 Morris水迷宫测试
2型糖尿病大鼠模型建立后8周,四组大鼠均测试Morris水迷宫。学习时将大鼠从任一象限入水点头面向池壁轻放于水中,记录动物的入水时间和潜伏期。每只大鼠每天在每个象限学习1次,设定最长游动时间为120 s。前4 d为训练时间,第5天测试。实验结束后记录各实验动物探索到达平台所需的时间(逃避潜伏期)和搜索平台的策略(圆圈式,记分1分;随机式,记分2分;曲线式,记分3分;直线式,记分4分)。
1.4血清生化指标检测
Morris水迷宫测试结束后,N组和DM组大鼠禁食12 h,取尾静脉血测空腹血糖。10%水合氯醛(350 mg/kg)腹腔注射麻醉,颈动脉插管放血,血样于3500 r/min离心10 min,分离血清,分装于EP管内,-80℃冻存待测。放免法检测血清胰岛素水平。
1.5 Western blot
行为学测试后,N组和DM组大鼠断头取脑,冰上快速分离前额叶皮层,加入全细胞裂解液匀浆,或利用碧云天细胞膜蛋白与细胞浆蛋白抽提试剂盒分离、提取胞浆蛋白和胞膜蛋白。匀浆后的样品加上样缓冲液经煮沸、离心后,取上清即为蛋白提取液,经过蛋白测定后进行免疫印迹实验。取各组等蛋白含量样品于聚丙烯酰胺凝胶泳道进行蛋白电泳,经过恒流、恒压蛋白彻底分离后将蛋白转移至PVDF膜上,再进行相应一抗、二抗孵育及ECL显色。收集所得条带灰度值进行统计学分析。应用Quantity One分析软件进行蛋白印迹结果的半定量分析,得出PKCγ总蛋白以及β-actin的吸光度值,用β-actin校准后算出比值,并以N组作为100%,其余各组以相对百分数表示。
1.6统计学方法
采用统计软件SPSS 11.5对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,两独立样本的计量资料采用t检验;多组间比较采用方差分析,两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1实验动物的空间学习记忆能力测试及评价
Morris水迷宫实验的第1~5天,DM组、DM+DMSO组和DM+Go6983组逃避潜伏期较N组均明显增加,差异有统计学意义(P<0.05)。与DM组和DM+DMSO组比较,DM+Go6983组逃避潜伏期进一步延长,差异有统计学意义(P<0.05)。见表1。
第5天各组大鼠搜索平台策略的评分情况显示,与N组[(3.22±0.28)分]比较,DM组[(2.22±0.32)分]、DM+DMSO组[(2.11±0.31)分]和DM+Go6983组[(1.33± 0.17)分]分数显著降低,差异有统计学意义(P<0.05)。与DM组和DM+DMSO组比较,DM+Go6983组评分进一步降低,差异有统计学意义(P<0.05)。见图1。
表1 各组大鼠水迷宫实验逃避潜伏期的比较(分,
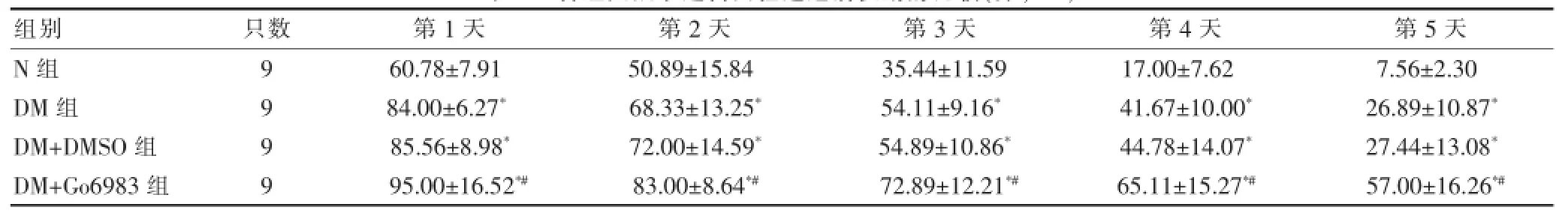
表1 各组大鼠水迷宫实验逃避潜伏期的比较(分,
注:与N组比较,*P<0.05;与DM组和DM+DMSO组比较,#P<0.05
组别只数第1天第2天第3天第4天第5天N组DM组DM+DMSO组DM+Go6983组9999 60.78±7.91 84.00±6.27*85.56±8.98*95.00±16.52*#50.89±15.84 68.33±13.25*72.00±14.59*83.00±8.64*#35.44±11.59 54.11±9.16*54.89±10.86*72.89±12.21*#17.00±7.62 41.67±10.00*44.78±14.07*65.11±15.27*#7.56±2.30 26.89±10.87*27.44±13.08*57.00±16.26*#
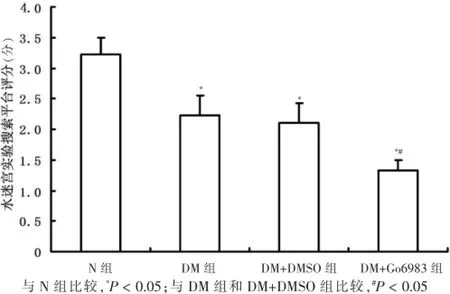
图1 各组实验大鼠Morris水迷宫实验的搜索平台策略评分
2.2 N组、DM组大鼠特征、体重、空腹血糖、血胰岛素的变化
N组大鼠精神状态良好,体重稳定、持续上升。给予STZ后,DM组大鼠精神萎靡,活动减少,消瘦,进食量、饮水量增加,尿量增加。与N组比较,DM组大鼠空腹血糖水平明显升高,差异有统计学意义(P<0.05);而DM组大鼠体重和血清胰岛素水平显著低于N组,差异有统计学意义(P<0.05)。见表2。
表2 N组、DM组大鼠体重、血糖和血胰岛素水平的比较

表2 N组、DM组大鼠体重、血糖和血胰岛素水平的比较
注:与N组比较,*P<0.05
组别只数体重(g)血糖(mmol/L)血胰岛素(mU/L)N组DM组99 713±14 635±28*5.2±0.8 13.2±2.7*16.51±4.19 9.87±1.31*
2.3 N组、DM组大鼠大脑皮层PKCγ蛋白全细胞表达量与亚细胞分布的变化
Western blot结果显示,与N组比较,DM组大鼠皮层组织PKCγ蛋白全细胞表达量无明显变化,差异无统计学意义(P>0.05)。见图2。
与N组比较,DM组大鼠皮层组织胞膜成分内PKCγ含量明显升高,而胞浆成分内PKCγ含量显著降低,即发生了膜转位,差异有统计学意义(P<0.05)。见图3。

图2 N组、DM组大鼠皮层组织中PKCγ蛋白表达情况
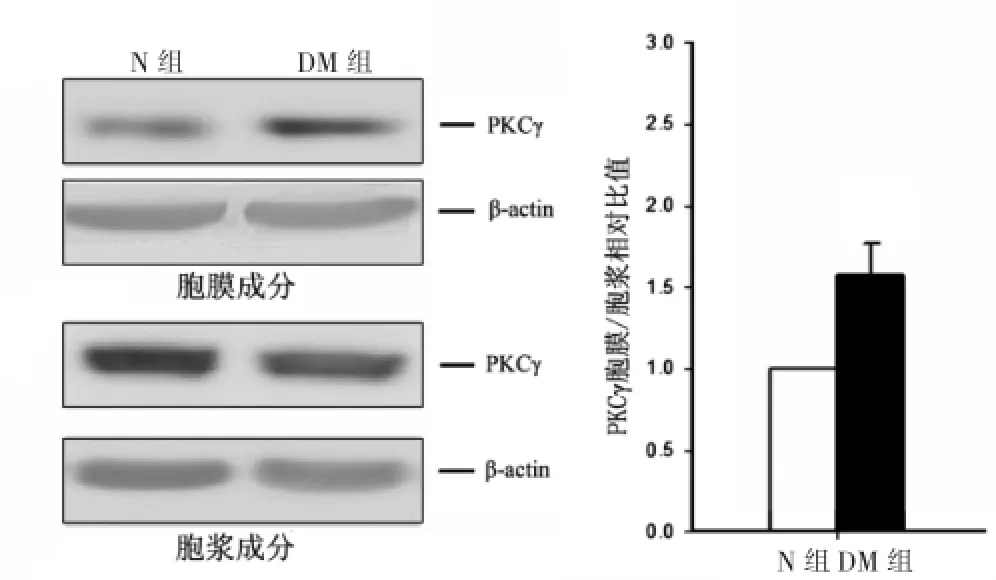
图3 N组、DM组大鼠皮层组织中PKCγ在细胞膜和细胞浆的表达情况
3 讨论
PKC是一类使蛋白质分子内丝氨酸/苏氨酸残基磷酸化的蛋白激酶,广泛分布于各种组织,其中以神经组织中含量最为丰富[6-10]。当细胞受到刺激后,PKC从细胞浆中转移到胞膜上,称为膜转位,可作为PKC激活的标志[11-14]。目前多项研究表明PKCα、β2、ε、δ、ζ、ι分别在糖尿病引起的炎症反应、心室功能障碍、视网膜病变和糖尿病肾病中均发挥重要的作用[15-18]。
PKCγ最大的特征是它特异地分布于神经元,并主要集中在中枢神经系统。糖尿病大鼠胚胎神经管发育过程中PKCγ磷酸化水平增加,PKCγ特异性抑制剂可以有效地降低糖尿病畸胎率的发生[19]。糖尿病小鼠三叉神经脊髓核PKCγ表达增加,与头面部热痛觉过敏相关[20]。Bames空间迷宫实验发现,与未经训练大鼠相比,经过训练或熟悉迷宫的大鼠海马CA1区PKC-γ免疫活性明显增强,提示PKC-γ参与突触发育和可塑性,可直接影响认知功能[21]。然而尚无研究系统地探索PKC-γ在糖尿病脑病中的作用。本研究通过高脂饲料结合STZ腹腔注射建立2型糖尿病大鼠模型,12周后通过Morris水迷宫实验发现糖尿病大鼠学习、记忆、空间定向等认知能力明显下降。通过Western blot实验发现,2型糖尿病大鼠皮层组织PKCγ蛋白全细胞表达量未有明显变化,结果提示,2型糖尿病并非通过改变PKCγ蛋白表达量参与糖尿病脑病的发生发展过程。然而PKCγ亚细胞分布发生改变:胞膜成分内PKCγ含量明显升高,而胞浆成分内PKCγ含量显著降低,提示PKCγ可能通过膜转位激活细胞内信号通路,参与糖尿病脑病的发病过程。进一步应用侧脑室注射PKCγ抑制剂Go6983,发现Morris水迷宫潜伏期进一步延长,搜索策略能力显著降低,认知功能障碍更加严重。
综上所述,本实验中糖尿病脑病大鼠出现明显认知功能障碍,在此过程中PKCγ激活,给予PKCγ抑制剂可以进一步加重认知功能障碍,提示PKCγ激活可能在2型糖尿病脑病的发展过程中起到神经保护作用,但其具体机制有待于进一步研究证实。
[1]Liu YW,Zhu X,Zhang L,et al.Cerebroprotective effects of ibuprofen on diabetic encephalopathy in rats[J].Pharmacol Biochem Behav,2014,117:128-136.
[2]Liu JP,Feng L,Zhang MH,et al.Neuroprotective effect of Liuwei Dihuang decoction on cognition deficits of diabetic encephalopathy in streptozotocin-induced diabetic rat[J]. J Ethnopharmacol,2013,150(1):371-381.
[3]Zhou Y,Luo Y,Dai J.Axonal and dendritic changes are associated with diabetic encephalopathy in rats:an important risk factor for Alzheimer's disease[J].J Alzheimers Dis,2013,34(4):937-947.
[4]Brownlee M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[5]Zhang N,Yin Y,Han S,et al.Hypoxic preconditioning induced neuroprotection against cerebral ischemic injuries and its cPKCγ-mediated molecular mechanism[J].Neurochem Int,2011,58(6):684-692.
[6]Verma SK,Deshmukh V,Liu P,et al.Reactivation of fetal splicing programs in diabetic hearts is mediated by protein kinase C signaling[J].J Biol Chem,2013,288(49):35372-35386.
[7]Hua KF,Wang SH,Dong WC,et al.High glucose increases nitric oxide generation in lipopolysaccharide-activated macrophages by enhancing activity of protein kinase C-α/ δ and NF-κB[J].Inflamm Res,2012,61(10):1107-1116.
[8]Huang D,Wang FB,Guo M,et al.Effect of combined treatment with rosuvastatin and protein kinase Cβ2 inhibitor on angiogenesis following myocardial infarction in diabetic rats[J].Int J Mol Med,2015,35(3):829-838.
[9]Jiang Y,Zhang Q,Steinle JJ.Beta-adrenergic receptor agonist decreases VEGF levels through altered eNOS and PKC signaling in diabetic retina[J].Growth Factors,2015,33(3):192-199.
[10]Ahmed MS,Pelletier J,Leumann H,et al.Expression of protein kinase C isoforms in pancreatic islets and liver of male goto-kakizaki rats,a model of Type 2 diabetes[J]. PLoS One,2015,10(9):e0135781.
[11]Koya D.Dual protein kinase C alpha and beta inhibitors and diabetic kidney disease:a revisited therapeutic target for future clinical trials[J].J Diabetes Investig,2014,5(2):147-148.
[12]Park J,Kim H,Park SY,et al.Tonicity-responsive enhancer binding protein regulates the expression of aldose reductase and protein kinase C δ in a mouse model of diabetic retinopathy[J].Exp Eye Res,2014,122:13-19.
[13]Xu M,Tang YQ,Dai DZ,et al.Comparison of sildenafil with strontium fructose diphosphate in improving erectile dysfunction against upregulated cavernosal NADPH oxidase,protein kinase Cε,and endothelin system in diabetic rats[J].J Pharm Pharmacol,2012,64(2):244-251.
[14]Soetikno V,Sari FR,Sukumaran V,et al.Curcumin prevents diabetic cardiomyopathy in streptozotocin-induced diabetic rats:possible involvement of PKC-MAPK signaling pathway[J].Eur J Pharm Sci,2012,47(3):604-614.
[15]Mima A,Hiraoka-Yamomoto J,Li Q,et al.Protective effects of GLP-1 on glomerular endothelium and its inhibition by PKCβ activation in diabetes[J].Diabetes,2012,61(11):2967-2979.
[16]Soliman H,Gador A,Lu YH,et al.Diabetes-induced increased oxidative stress in cardiomyocytes is sustained by a positive feedback loop involving Rho kinase and PKCβ2[J].Am J Physiol Heart Circ Physiol,2012,303(8):H989-H1000.
[17]Xi G,Shen X,Maile LA,et al.Hyperglycemia enhances IGF-I-stimulated Src activation via increasing Nox4-derived reactive oxygen species in a PKCζ-dependent manner in vascular smooth muscle cells[J].Diabetes,2012,61(1):104-113.
[18]Sajan MP,Farese RV.Insulin signalling in hepatocytes of humans with type 2 diabetes:excessive production and activity of protein kinase C-ι(PKC-ι)and dependent processes and reversal by PKC-ι inhibitors[J].Diabetologia,2012,55(5):1446-1457.
[19]Zhao ZY,Wu YK,Reece EA.Demonstration of the essential role of protein kinase C isoforms in hyperglycemia-induced embryonic malformations[J].Reprod Sci,2008,15(4):349-356.
[20]Xie HY,Xu F,Li Y,et al.Increases in PKC gamma expression in trigeminal spinal nucleus is associated with orofacial thermal hyperalgesia in streptozotocin-induced diabetic mice[J].J Chem Neuroanat,2015,63:13-19.
[21]Nithianantharajah J,Murphy M.Experience on the Barnes spatial maze influences PKCgamma levels in the hippocampus[J].Int J Neurosci,2009,119(7):1014-1030.
Expression and role of protein kinase Cγ in cortex of diabetic encephalopathy rat
WANG Yue1YANG Qiushi2HAN Song2LUO Yanlin2LI Junfa2ZHAO Li2
1.Department of Neurology,Beijing Chaoyang Hospital,Capital Medical University,Beijing100020,China;2.Department of Neurobiology,School of Basic Medical Sciences,Capital Medical University,Beijing100069,China
Objective To explore the expression and role of PKCγ in the cortex of diabetic encephalopathy of rats. Methods 36 adult male SD rats were randomly divided into four groups(9 rats in each group):normal control group(N group),type 2 diabetes model group(DM group),type 2 diabetes model+DMSO intracerebroventricular injection group(DM+DMSO group)and type 2 diabetes model+Go6983 intracerebroventricular injection group(DM+Go6983 group). The rats in N group were fed with normal feedstuff,the models of DM,DM+DMSO and DM+Go6983 groups were established by application of high-fat diet and intraperitoneal injection of streptozocin(STZ).5 μL DMSO or Go6983 was intracerebroventricular injected in DM+DMSO group or DM+Go6983 group respectively.The spatial memories were determined by Morris water maze test in rats.The serum insulin levels were detected by radio-immunity method.PKCγ protein expression and subcellular distribution in the prefrontal cortex of rats were explored by Western blot method. Results Compared with N group,the escape latencies of water maze in DM group were longer,the scores of search platform strategy in Morris water maze test of DM group were lower,the fasting plasma glucose of DM group increased significantly,while serum insulin levels and body weight decreased remarkably,the differences were statistically significant(P<0.05).Compared with DM group and DM+DMSO group,the water maze latency of rats in DM+Go6983 group extended and the scores of search platform strategy reduced,the differences were statistically significant(P<0.05). Compared with N group,the expression of PKCγ protein in cortex of DM group had no change(P>0.05).The membrane translocation of PKCγ was significantly higher than that of normal brain tissues,the difference was statistically significant(P<0.05).Conclusion The PKCγ membrane translocation(activated)may play a neuroprotective role in the development of type 2 diabetic encephalopathy.
Diabetic encephalopathy;Protein kinase Cγ;Cortex;Membrane translocation;Morris water maze
R587.2
A
1673-7210(2015)12(b)-0004-04
2015-09-05本文编辑:苏畅)
国家自然科学基金项目(81400948);北京市自然科学基金项目(7144188);北京市教育委员会科技发展计划面上项目(KM201410025004);首都医科大学省部级重点实验室开放研究课题(GJZDSS004)。
王玥(1978-),男,博士;研究方向:脑血管及神经系统变性病发病机制。
赵丽(1978.5-),女,博士,研究方向:神经生物学。

