CYP2C19基因多态性与氯吡格雷相关不良反应的Meta分析
张玲莉等
[摘要] 目的 系统性评价细胞色素P450同工酶中超家族CYP2C19酶基因多态性与氯吡格雷不良反应发生的相关性。 方法 计算机检索PubMed、Science direct、Wiley online library、Web of Science、中国知网、万方数据库和维普中文科技期刊数据库,纳入CYP2C19基因多态性与氯吡格雷不良反应相关的研究,同时查阅检索结果中所附相似文献及参考文献,检索文献均为建库至2015年1月18日。由两名评价员单独进行文献筛选及资料提取,采用RevMan 5.0软件进行Meta分析及计算合并OR值和95%CI。 结果 共纳入CYP2C19基因多态性与氯吡格雷不良反应相关文献18篇,突变基因型患者6165例,野生型患者13 055例。Meta分析结果显示,突变基因型患者氯吡格雷相关不良反应发生率显著高于野生型患者(OR = 1.53,95%CI:1.19~1.97,P = 0.0010);亚组分析结果表明,亚洲人种中突变基因型患者氯吡格雷相关不良反应发生率显著高于野生型患者(OR = 2.49,95%CI:1.96~3.16,P < 0.000 01),而欧洲人群不存在这一现象(OR = 1.26,95%CI:0.96~1.65,P = 0.10);心肌梗死Meta分析中,突变型患者明显高于野生型患者(OR = 1.69,95%CI:1.37~2.08,P < 0.000 01);突变型患者出现支架血栓的风险也显著高于野生型患者(OR = 2.13,95%CI:1.68~2.70,P < 0.000 01)。 结论 CYP2C19基因多态性与氯吡格雷治疗相关不良反应之间存在显著的相关性,CYP2C19基因多态性能增加氯吡格雷引发的副作用。
[关键词] CYP2C19;基因多态性;氯吡格雷;不良反应;Meta分析
[中图分类号] R969 [文献标识码] A [文章编号] 1673-7210(2015)10(a)-0037-06
Association between CYP2C19 polymorphism and Clopidogrel-induced adverse events: a Meta-analysis
ZHANG Lingli PENG Rui PENG Yan
Department of Pharmacy, Renmin Hospital of Wuhan University, Hubei Province, Wuhan 430060, China
[Abstract] Objective To investigate the association between CYP2C19 gene polymorphism and Clopidogrel-related adverse events in patients by Meta-analysis. Methods The computer was used to retrieve articles from the PubMed, Science direct, Wiley online library, Web of Science, CNKI, Wanfang database and VIP. The studies were searched and sorted out which studied the association between CYP2C19 gene polymorphism with Clopidogrel-induced adverse events, also combined with manually retrieving the references and similar results in the attached documents. The range of searching time was all from inception to January 18, 2015. Literature screening and data extracting were handled by two reviews independently. RevMan 5.0 software was used to conduct the Meta-analysis and assessed the pooled OR and 95%CI. Results 18 articles about CYP2C19 gene polymorphism and Clopidogrel-related adverse events were enrolled. It showed that the total number of patients with variant gene was 6165, and the total number of patient with wild-type gene was 13 055. While the results showed that the risk of Clopidogrel-induced adverse events was strongly higher in patients with variant gene compared to wild-type patients (OR = 1.53, 95%CI: 1.19-1.97, P = 0.0010). The further regional subgroup analysis showed that the occurrence of Clopidogrel-induced toxicity in Asian patients carrying mutation gene was significantly increased when compared to wild-type patients (OR = 2.49, 95%CI: 1.96-3.16, P < 0.000 01), but not in European (OR = 1.26, 95%CI: 0.96-1.65, P = 0.10). What's more, the risk of Clopidogrel-induced toxicity in variant patients was apparently increased when compared to wild-type patients in myocardial infarction (OR = 1.69, 95%CI: 1.37-2.08, P < 0.000 01) and stent thrombosis (OR = 2.13, 95%CI: 1.68-2.70, P < 0.000 01) Meta analysis. Conclusion The association between CYP2C19 polymorphism and Clopidogrel-induced adverse events is significant in our study. CYP2C19 polymorphism can increase the Clopidogrel-induced adverse reactions.
[Key words] CYP2C19; Gene polymorphism; Clopidogrel; Adverse events; Meta-analysis
氯吡格雷是一种新型人工合成的噻吩吡啶类衍生物,其本身是无活性的药物前体,在肠道吸收过程中受P-糖蛋白介导,然后15%经肝脏细胞色素P450酶(CYP450酶)系统代谢为2-氧基-氯吡格雷,最后再进一步水解成硫醇衍生物样的活性代谢产物,选择性不可逆地抑制二磷酸腺苷(ADP)受体(P2Y12),间接抑制GP Ⅱb/Ⅲa受体与纤维蛋白结合,引起血小板不能进一步聚集,从而阻止病理性血栓的形成[1]。氯吡格雷主要用于治疗急性冠状动脉综合征(acute coronary syndrome,ACS)和经皮冠状动脉支架植入术(percutaneous coronary stent implantation,PCI)后患者,而且能明显降低ACS非血运重建患者的病死率及其他心血管事件的发生率[2]。研究发现,氯吡格雷使用后会出现多种不良反应,如心肌梗死(myocardial infarction)、支架血栓(stent thrombosis)、缺血性中风(ischaemic srtoke)和再造血管重建(repeat revascularization)等,然而这些不良反应发生的风险存在较大的个体性差异,这可能主要是由遗传因素引起的[3-4]。
越来越多的研究发现,氯吡格雷出现的不良反应主要受CYP2C19基因多态性的影响[5-6]。研究表明CYP2C19基因多态性主要有两类突变:一类是降低酶活性的突变,如CYP2C19*2、*3、*4、*5、*7、*8等;另一类是增加酶活性的突变,目前发现的只有CYP2C19*17[7]。相关研究表明CYP2C19*2、*3基因携带患者不能有效地将氯吡格雷转化为活性代谢产物,故氯吡格雷在这些突变患者中的抗血小板作用没有CYP2C19*1野生型基因患者那么明显。因此,临床上对服用氯吡格雷患者首先进行CYP2C19基因型检测是尤为重要的[8]。探究CYP2C19基因多态性与氯吡格雷引起的不良反应之间的关系是必要的。本研究采用Meta分析的系统评价方法,对CYP2C19基因多态性与氯吡格雷不良反应发生的风险进行分析,以期为氯吡格雷在临床上的安全使用提供参考依据。
1 资料与方法
1.1 文献纳入与排除标准
纳入标准:①国内外公开发表的关于研究CYP2C19基因多态性与氯吡格雷不良反应关系的文献;②研究氯吡格雷不良反应涉及心肌梗死或支架血栓;③纳入文献中提供了不良反应涉及心肌梗死或支架血栓的患者人数。排除标准:①文献中只报道某一副作用的患者病例数,而没有确切副作用的患者总病例数;②文献中数据不全的相关研究;③研究人群一致的重叠研究时,选择最新的研究报道结果。
1.2 检索策略
计算机检索PubMed、Science direct、Wiley online library、Web of Science、中国知网、万方数据库和维普中文科技期刊数据库建库至2015年1月18日公开发表的文献,同时查阅检索结果中所附相似文献及参考文献。英文检索策略为CYP2C19、myocardial infarction、stent thrombosis、clopidogrel、polymorphisms、adverse events,中文检索策略为CYP2C19、心肌梗死、支架血栓、氯吡格雷、基因多态性、不良反应。
1.3 文献筛选
由两名作者按照上述纳入与排除标准采用Note Express软件独立进行筛选,并交叉核对,如有分歧则交于第三作者提供指导意见并商定。
1.4 资料提取
由2名研究人员分别按照前述检索策略收集有关CYP2C19基因多态性与氯吡格雷不良反应关系的相关文献,然后按照纳入标准筛选文献。如果研究人员在这一过程中出现分歧,则通过协商或由另一研究人员决定是否纳入。应从每篇纳入文献中提取以下数据:第一作者、年份、国家、病例数、患者平均年龄、基因分型方法、突变位点、突变型/野生型病例数、不良反应的类型等。
1.5 统计学方法
采用Meta分析软件Review Manager 5.0(http://ims. cochrane.org/RevMan)进行系统评价分析。首先对纳入分析的文献数据采用χ2检验进行异质性检验,P值与I2作为异质性分析的判定标准:I2 < 50%时,则异质性小;反之则异质性大。显著性检验水平当P ≥ 0.05时,认为各文献数据间无异质性,采用固定效应模型(FEM)进行分析;当P < 0.05时,认为各文献数据间存在异质性,采用校正后的随机效应模型(REM)进行分析。CYP2C19和氯吡格雷不良反应关系的评价指标为OR值及95%可信区间(95%CI),并绘制漏斗图来判断是否存在发表偏倚。
2 结果
2.1 文献检索及筛选结果
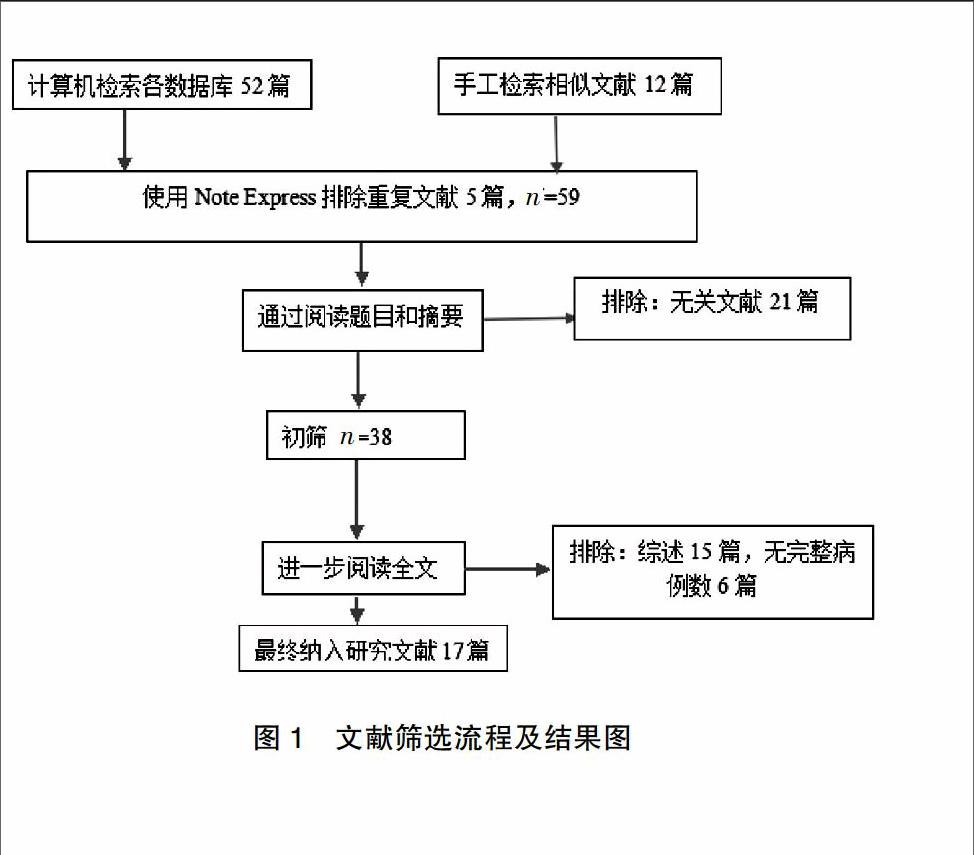
根据检索策略,最初检索出英文文献64篇,通过阅读标题、摘要及全文,最终筛选出17篇[9-25]研究纳入Meta分析,检索及筛选流程详见图1。
图1 文献筛选流程及结果图
2.2 资料提取结果
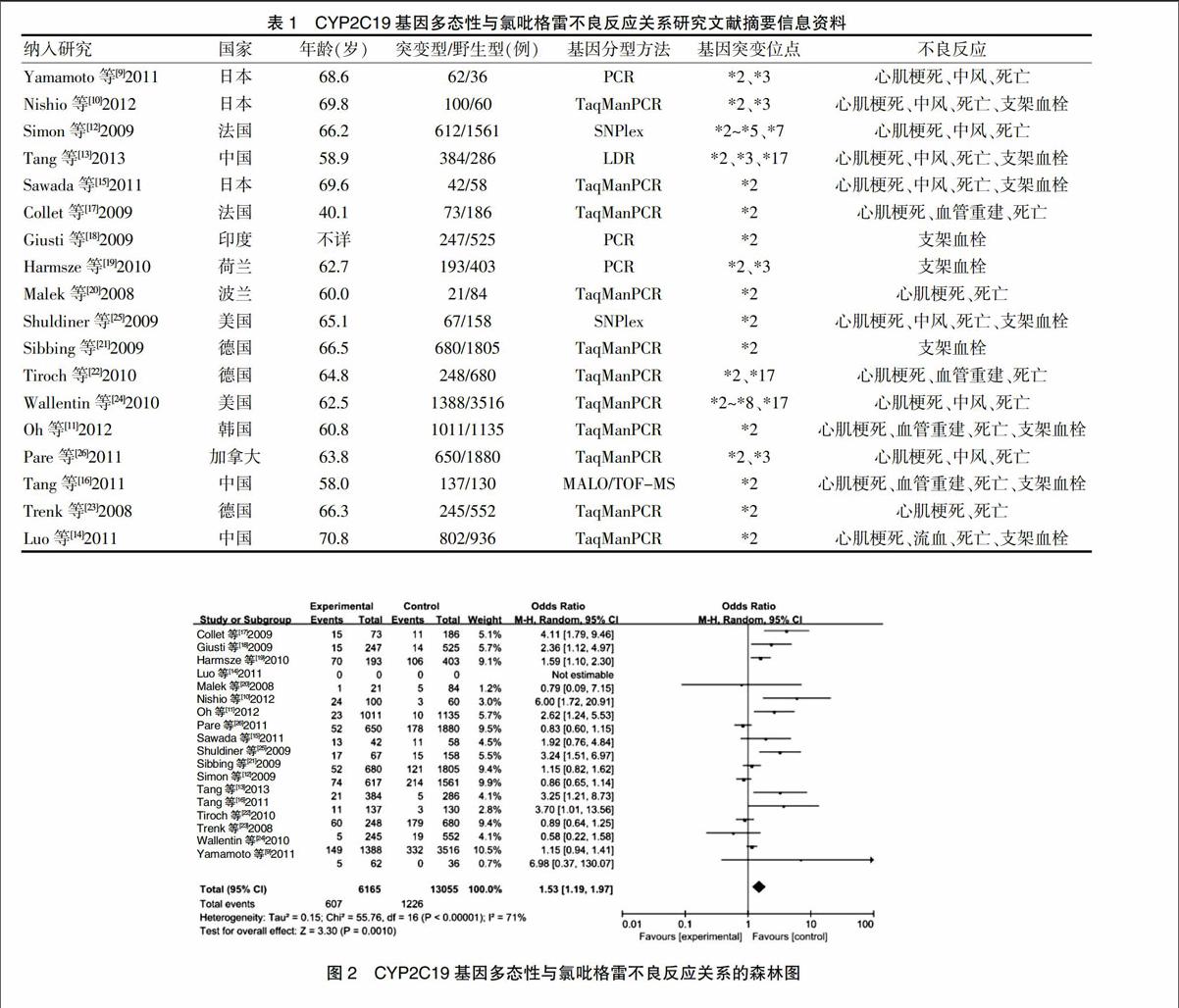
根据纳入的文献资料提取相关的资料信息,提取结果见表1。
2.3 CYP2C19基因多态性与氯吡格雷不良反应相关性的Meta分析
对CYP2C19基因多态性与氯吡格雷不良反应关系的Meta分析中,17篇文献被纳入分析了氯吡格雷不良反应多个突变位点多态性与氯吡格雷不良反应发生的关系,结果显示CYP2C19基因多态性患者氯吡格雷不良反应的发生率为19.8%,而CYP2C19基因野生型患者氯吡格雷不良反应发生率为9.4%。然后对17项研究进行异质性检验发现各个研究之间存在异质性(P < 0.000 01,I2 = 71%),故采用REM进行计算分析,且合并效应量的统计结果为Z = 3.30,P = 0.0010,说明CYP2C19突变型患者、CYP2C19野生型患者与氯吡格雷不良反应发生率之间的差异有统计学意义,因此结果得到OR = 1.53,95%CI:1.19~1.97,结果见图2。最终说明CYP2C19基因突变型患者发生氯吡格雷不良反应的风险显著高于CYP2C19基因野生型患者。
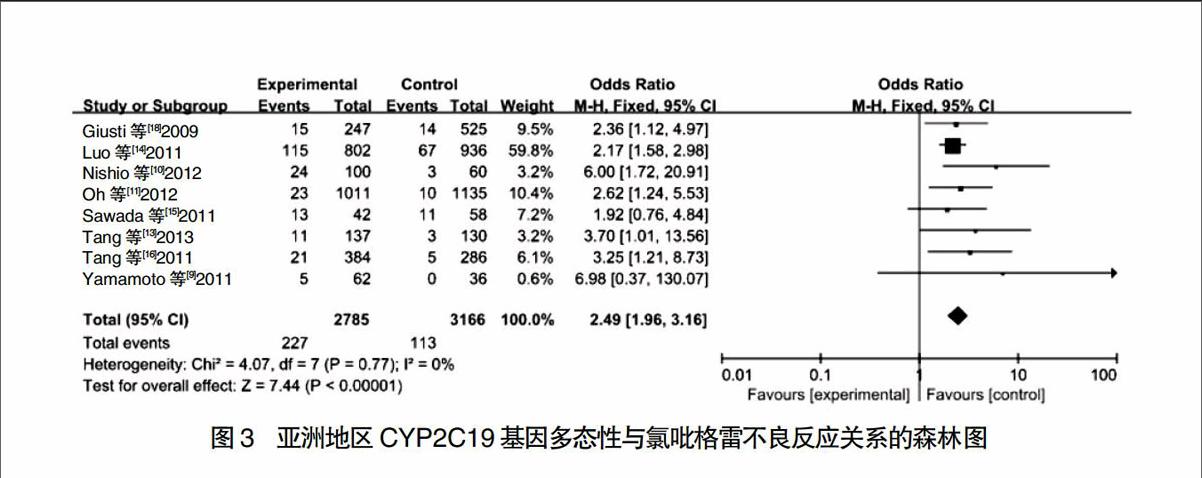
进一步地区亚组分析表明,对亚洲地区8项研究进行异质性检验发现各个研究之间不存在异质性(P = 0.77,I2 = 0%),故采用FEM进行计算分析,且合并效应量的统计结果为Z = 7.44,P < 0.000 01,说明CYP2C19突变型患者、CYP2C19野生型患者与氯吡格雷不良反应发生率之间的差异有统计学意义,因此结果得到OR = 2.49,95%CI:1.96~3.16,结果见图3。最终说明亚洲地区CYP2C19基因突变型患者发生氯吡格雷不良反应的风险显著高于CYP2C19基因野生型患者。然而对欧洲地区9项研究进行异质性检查发现各个研究之间存在异质性(P = 0.0006,I2 = 71%),故采用REM进行计算分析,且合并效应量的统计结果为Z = 1.65,P = 0.10,说明CYP2C19突变型患者、CYP2C19野生型患者与氯吡格雷不良反应发生率之间的差异无统计学意义,见图4。
2.4 CYP2C19基因多态性与氯吡格雷引起的心肌梗死相关性的Meta分析
对CYP2C19基因多态性与氯吡格雷引起的心肌梗死相关性的Meta分析中,10篇文献被纳入分析了CYP2C19突变型患者、野生型患者与氯吡格雷引起的心肌梗死的关系,然后对10项研究进行异质性检验发现各个研究之间无显著异质性(P = 0.11,I2 = 37%),故采用FEM进行计算分析,且合并效应量的统计结果为Z = 4.95,P < 0.000 01,说明CYP2C19突变型患者、野生型患者与氯吡格雷引起的心肌梗死之间的差异有统计学意义,因此结果得到OR = 1.69,95%CI:1.37~2.08,结果见图5。最终说明CYP2C19突变型患者发生心肌梗死是风险显著高于野生型患者。
2.5 CYP2C19基因多态性与氯吡格雷引起的支架血栓相关性的Meta分析
对CYP2C19基因多态性与氯吡格雷引起的支架血栓相关性的Meta分析中,11篇文献被纳入分析了CYP2C19突变型患者、野生型患者与氯吡格雷引起的支架血栓的关系,然后对11项研究进行异质性检查发现各个研究之间无显著异质性(P = 0.14,I2 = 32%),故采用FEM进行计算分析,且合并效应量的统计结果为Z = 6.21,P < 0.000 01,说明CYP2C19突变型患者、野生型患者与氯吡格雷引起的支架血栓之间的差异有统计学意义,因此结果得到OR = 2.13,95%CI:1.68~2.70,结果见图6。最终说明CYP2C19突变型患者发生支架血栓是风险显著高于野生型患者。
2.6 发表偏倚评估
以各研究OR值和样本含量绘制漏斗图,CYP2C19基因多态性与氯吡格雷不良反应相关性的Meta分析的漏斗图均左右基本对称(图7)。用Begg检验定量评价发表偏倚的结果,P > 0.05,提示没有明显的发表偏倚,结论可信度较高。
图7 发表偏倚的漏斗图
3 讨论
在临床研究中,氯吡格雷抗血小板的作用存在较大的个体性差异。越来越多的研究结果显示,药物代谢酶的基因多态性可能是导致这种差异的主要原因[26-27]。有相关研究报道,急性心肌梗死患者在服用氯吡格雷后,携带CYP2C19突变基因患者发生心血管不良反应的风险显著高于野生型基因患者,并且这种差异在PCI术后患者中表现得更加突出[28-29]。但是,目前临床研究的数据并不充分,特别是心血管事件和PCI术后时间长短之间的关系尚缺乏相应的研究。本研究对CYP2C19对氯吡格雷引起的不良反应的影响进行了系统分析,研究结果表明,携带CYP2C19突变基因的患者出现氯吡格雷不良反应的风险显著高于野生型患者,但在地区亚组分析中欧洲地区患者并没有出现上述一致的研究结果,这可能与纳入文献的数量有关,因此,对欧洲地区相关研究应进行更多的临床试验。
当然,本研究也存在一些不足,主要有以下几方面:首先,由于氯吡格雷引起的不良反应事件较为复杂,又没有充分的亚组数据可供分析,可能导致结果产生一定偏倚;其次,尽管我们的检索策略相对比较全面,但仍不能囊括所有相关研究,这些均可能导致某些有意义的文章被排除;还有本研究纳入的文献均为质量较高的文献,可能有些负面文献未能纳入,因此也可能造成偏倚,上述偏倚均有可能会影响到本次系统分析的结果。更值得关注的是,应对CYP2C19基因多态性的变化所引起的功能改变进行相关研究,进一步明确氯吡格雷导致的不良反应危险性增高的内在因素,从而加以预防。
[参考文献]
[1] Nguyen TA,Diodati JG,Pharand C. Resistance to clopid-ogrel:a review of the evidence [J]. J Am Coll Cardiol,2005, 45(8):1157-1164.
[2] Plosker GL,Lyseng-Williamson KA. Clopidogrel:a review of its use in the prevention of thrombosis [J]. Drugs,2007,67(4):613-646.
[3] Singh M,Thapa B,Arora R. Clopidogrel pharmacogenetics and its clinical implications [J]. American Journal of Thera-peutics,2010,17(3):e66-e73.
[4] Ford NF. Clopidogrel resistance:pharmacokinetic or phar-macogenetic? [J]. Journal of Clinical Pharmacology,2009, 49(5):506-512.
[5] Pettersen AA,Arnesen H,Opstad TB,et al. The influence of CYP 2C19*2 polymorphism on platelet function testing during single antiplatelet treatment with clopidogrel [J]. Thromb J,2011,9:4.
[6] Tantry US,Bliden KP,Wei C,et al. First analysis of the relation between CYP2C19 genotype and pharmacody-namics in patients treated with ticagrelor versus clopidogrel:The ONSET/OFFSET and RESPOND genotype studies [J]. Circulation:Cardiovascular Genetics,2010,3(6):556-566.
[7] Frere C,Cuisset T,Gaborit B,et al. The CYP2C19*17 allele is associated with better platelet response to clopidogrel in patients admitted for non-ST acute coronary syndrome [J]. J Thromb Haemost,2009,7(8):1409-1411.
[8] U.S. Food and Drug Administration. FDA Drug Safety Communication:reduced effectiveness of Plavix (clopidogrel) in patients who are poor metabolizers of the drug [S]. 2010. Available from:http://www.fda.gov/Drugs/DrugSafety/.
[9] Yamamoto K,Hokimoto S,Chitose T,et al. Impact of CYP2C19 polymorphism on residual platelet reactivity in patients with coronary heart disease during anti-platelet therapy [J]. J Cardiol,2011,57(2):194-201.
[10] Nishio R,Shinke T,Otake H,et al. Effect of cytochrome P4502C19 polymorphism on target lesion outcome after drug-eluting stent implantation in Japanese patients receiving clopidogrel [J]. Circ J,2012,76(10):2348-2355.
[11] Oh IY,Park KW,Kang SH,et al. Association of cytochrome P4502C19*2 polymorphism with clopidogrel response variability and cardiovascular events in Koreans treated with drug-eluting stents [J]. Heart,2012,98(2):139-144.
[12] Simon T,Verstuyft C,Mary-Krause M,et al. Genetic det-erminants of response to clopidogrel and cardiovascular events [J]. N Engl J Med,2009,360(4):363-375.
[13] Tang XF,Wang J,Zhang JH,et al. Effect of the CYP2C19 2 and 3 genotypes ABCB1 C3435 T and PON1 Q192R alleles on the pharmacodynamics and adverse clinical events of clopidogrel in Chinese people after percutaneous coronary intervention [J]. Eur J Clin Pharmacol,2013,69(5):1103-1112.
[14] Luo Y,Zhao YT,Verdo A,et al. Relationship between cytochrome P450 2C19*2 polymorphism and stent thrombosis following percutaneous coronary intervention in Chinese patients receiving clopidogrel [J]. J Int Med Res,2011,39(5):2012-2019.
[15] Sawada T,Shinke T,Shite J,et al. Impact of cytochrome P450 2C19*2 polymorphism on intra-stent thrombus after drug-eluting stent implantation in Japanese patients receiving clopidogrel [J]. Circ J,2011,75(1):99-105.
[16] Tang XF,He C,Yuan JQ,et al. Impact of cytochrome P4502C19 polymorphisms on outcome of cardiovascular events in clopidogrel-treated Chinese patients after percutaneous coronary intervention [J]. Zhonghua Xin Xue Guan Bing Za Zhi,2011,39(7):617-620.
[17] Collet JP,Hulot JS,Pena A,et al. Cytochrome P4502C19 polymorphism in young patients treated with clopidogrel after myocardial infarction:a cohort study [J]. Lancet,2009, 373(9660):309-317.
[18] Giusti B,Gori AM,Marcucci R,et al. Relation of cytochrome P450 2C19 loss-of-function polymorphism to occurrence of drug-eluting coronary stent thrombosis [J]. Am J Cardiol,2009,103(6):806-811.
[19] Harmsze AM,van Werkum JW,Ten Berg JM,et al. CYP 2C19*2 and CYP2C9*3 alleles are associated with stent thrombosis:a case-control study [J]. Eur Heart J,2010,31(24):3046-3053.
[20] Malek LA,Kisiel B,Spiewak M,et al. Coexisting polym-orphisms of P2Y12 and CYP2C19 genes as a risk factor for persistent platelet activation with clopidogrel [J]. Circ J,2008,72(7):1165-1169.
[21] Sibbing D,Stegherr J,Latz W,et al. Cytochrome P4502C19 loss-of-function polymorphism and stent thrombosis following percutaneous coronary intervention [J]. Eur Heart J,2009,30(8):916-922.
[22] Tiroch KA,Sibbing D,Koch W,et al. Protective effect of the CYP2C19 *17 polymorphism with increased activation of clopidogrel on cardiovascular events [J]. Am Heart J,2010,160(3):506-512.
[23] Trenk D,Hochholzer W,Fromm MF,et al. Cytochrome P450 2C19 681G>A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents [J]. J Am Coll Cardiol,2008,51(20):1925-1934.
[24] Wallentin L,James S,Storey RF,et al. Effect of CYP2C19 and ABCB1 single nucleotide polymorphisms on outcomes of treatment with ticagrelor versus clopidogrel for acute coronary syndromes:a genetic substudy of the PLATO trial [J]. Lancet,2010,376(9749):1320-1328.
[25] Shuldiner AR,O'Connell JR,Bliden KP,et al. Association of cytochrome P450 2C19 genotype with the anti-platelet effect and clinical efficacy of clopidogrel therapy [J]. JAMA,2009,302(8):849-857.
[26] Pare A,Judge H,Morton A,et al. Cytochrome P450 2C19 loss-of-function genetic variants but not paraoxonase-1 activity modulate P2Y12 blockade in response to clopidogrel therapy [J]. Journal of the American College of Cardiology,2011,58(20):B45.
[27] Kazui M,Nishiya Y,Ishizuka T,et al. Identifi cation of the human cytochrome P450 enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite [J]. Drug Metab Dis-pos,2010,38(1):92-99.
[28] Beitelshees AL,Horenstein RB,Vesely MR,et al. Phar-macogenetics and clopidogrel response in patients unde-rgoing percutaneous coronary interventions [J]. Clin Phar-macol Ther,2011,89(3):455-459.
[29] Luo Y,Zhao YT,Verdo A,et al. Relationship between cytochrome P450 2C19*2 polymorphism and stent throm-bosis following percutaneous coronary intervention in Chinese patients receiving clopidogrel [J]. J Int Med Res,2011,39(5):2012-2019.
(收稿日期:2015-03-02 本文编辑:张瑜杰)

