鲜猪肉中沙门和金葡菌荧光定量PCR检测
马凯,白羽,陈尔凝,刘杰,刘悦,武会娟,高丽娟
(北京市理化分析测试中心,北京100089)
鲜猪肉中沙门和金葡菌荧光定量PCR检测
马凯,白羽,陈尔凝,刘杰,刘悦,武会娟,高丽娟*
(北京市理化分析测试中心,北京100089)
通过结合两种技术-免疫磁分离技术与双重荧光定量PCR技术,建立同时、快速对鲜猪肉进行沙门氏菌和金黄色葡萄球菌的检测方法。利用偶联有特异性抗体免疫磁球,在37℃的条件下能够有效地从250 mL循环体系中边富集边捕获目标菌。利用特异性的引物与探针,对两种食源性致病菌进行双重荧光定量PCR同时检测。本研究方法针对沙门氏菌和金黄色葡萄球菌的检测限分别达到3.6 CFU/g和9.2 CFU/g。方法总体灵敏度、特异性和准确度达到98.8%、100%以及98.9%。本研究建立的免疫磁分离-双重荧光定量PCR方法比国标方法更快速和高效,适用于鲜猪肉中沙门氏菌和金黄色葡萄球菌的快速检测。
沙门氏菌;金黄色葡萄球菌;免疫磁分离;双重荧光定量PCR
食品安全是当今全球关注的热点问题。据统计,在美国食源性疾病每年影响超过6百万到8千万人的生活,导致多达9千人死亡,造成多达50亿美元的损失[1]。这些事件中沙门氏菌和金黄色葡萄球菌是主要的两种致病菌。由感染沙门氏菌而引起的腹泻等疾病几乎在所有国家都有发生,而其主要的感染源包括猪肉、家禽和鸡蛋等[2]。沙门氏菌和金黄色葡萄球菌在我国近10年来由微生物引起的食源性疾病事件中的比例分别为10.3%和1.5%[3]。鲜猪肉中存在的沙门氏菌和金黄色葡萄球菌导致的食源性疾病呈逐年上升趋势,给人们的健康带来很大的潜在威胁。因此,同时、快速地对鲜猪肉中的这些食源性致病菌进行检测,才能够快速应对此类食品安全突发事件。
目前针对上述两种致病菌的检测手段包括依赖传统细菌学培养的致病菌检测方法,因其存在培养时间长、分型实验复杂、灵敏度低等缺点,在很多突发事件中不能够很好地及时反映准确的数据;多重PCR技术能够在一个PCR反应中同时对多种目的序列进行扩增,显著地节约了成本,缩短了时间,在多个检测领域得到广泛的应用[4-6]。但因为普通PCR需要经过琼脂糖电泳对结果进行确认,容易导致交叉污染[7],此外,现今使用的染色液多为有毒性的染料物质,也限制了其在检测当中的使用。荧光定量PCR技术采用封闭式反应体系,不需要后续的电泳检测[8],加之其采用了特异性的探针或荧光染料,其较常规PCR技术显著提高了检测的灵敏度与准确性。目前,针对食源性致病菌的快速检测的报道多为针对一种致病菌的荧光定量PCR快速检测技术的建立[9-13],也有针对4种致病菌做同时检测的报道,但因为4重荧光定量PCR反应体系中4套引物及模板相互影响等原因导致检测限较高[5,14]。双重荧光定量PCR反应体系即能保证较高的对多种致病菌同时检测,又能有效降低相互干扰,降低成本和检测限,在检测致病菌方面具有一定的优势[15]。免疫磁分离技术是利用包被有特异性抗体的磁球捕获目标物,并利用磁场的分离效果使磁球-目标物复合物从环境中分离出来。免疫磁分离技术已经被证实为一种有效地分离多种致病菌的方法[14,16-17]。
免疫磁球-多重实时荧光定量PCR具有快速、准确、特异性强、灵敏度高的特点,它是近几年在免疫磁球高效磁分离技术、多重实时荧光定量PCR基础上发展起来的致病菌快速检测技术,在利用特异性抗体对目标菌捕获之后,利用特异性引物和探针,可对食源性致病菌的DNA片段进行同时扩增[18-19]。本研究使用两种特异性免疫磁球捕获同时沙门氏菌和金黄色葡萄球菌,并设计两种特异性引物及探针,从而实现对沙门氏菌和金黄色葡萄球菌的同时检测。
1材料与方法
1.1培养基与菌株
沙门氏菌、金黄色葡萄球菌培养基配制参考国标GB 4789.4-2010《食品安全国家标准食品微生物学检验沙门氏菌检验》[20]和GB/T 4789.10-2010《食品安全国家标准食品微生物学检验金黄色葡萄球检验》[21],营养肉汤培养基(NB)北京陆桥技术有限责任公司。
沙门氏菌ATCC 14028、金黄色葡萄球菌ATCC 25923均购自中国医学细菌保藏管理中心。
1.2试剂与仪器
超顺磁性纳米微球:上海AllMag公司;沙门氏菌多克隆抗体、金黄色葡萄球菌多克隆抗体:美国Meridian公司;1-乙基-(3-二甲氨基丙基)、碳酰二亚胺(EDC)、N-羟基琥珀酰亚胺:美国Sigma公司;细菌基因组DNA提取试剂盒:北京天根生化科技有限公司;TaqMan Fast Universal PCR Master Mix(2×):美国Applied Biosystems公司。
BHC-1300II A2生物安全柜:苏州安泰空气技术有限公司;ZSD-1270生化培养箱:上海智城分析仪器有限公司;GENIE2涡旋震荡器:美国SCIENTIFIC INDUSTRIES公司;Biospec-nano核酸分析仪:日本岛津公司;Pathatrix免疫磁分离系统:英国Matrix公司;5804R离心机:德国Eppendorf公司;7500 Fast荧光定量PCR仪:美国Applied Biosystem公司。
1.3引物及探针的选择与合成
本研究中沙门氏菌[22]、金黄色葡萄球菌[23]的引物及探针参考相关文献(见表1),由上海英骏生物技术有限公司合成。

表1 双重荧光定量PCR扩增用特异引物及探针序列Table 1Primers and probes for multiplex RT-PCR detection of Salmonella,and Staphylococcus aureus
1.4免疫磁球制备及免疫磁分离
1.4.1免疫磁球的制备
取200 μg磁球用600 μL PBST洗涤3次;加入新配制的15 μL 5 mg/mL EDC和15 μL 5 mg/mL NHS溶液到离心管中,震荡混匀,37℃活化60 min,600 μL PBST洗涤3次。800 μL PBS(pH=7.4)重悬磁球。加入50 μg细菌多克隆抗体,37℃结合3 h。磁分离后弃上清,600 μL PBST洗涤3次,300 μL 1%BSA重悬磁球,37℃封闭30 min。磁分离后弃上清,600 μL PBS洗涤3次~5次。向制备好的致病菌磁球中加入100 μL PBST。4℃保存待用。
1.4.2免疫磁分离捕获
25 g鲜猪肉样品,加入225 mL NB,均质后接种10倍稀释的不同浓度菌液,制备成250 mL体系。将体系放置到免疫磁分离系统上进行循环富集30min。最后得到终体积为1.5 mL菌体-磁球复合物悬液,取200 μL涂布计数检测,剩余全部用于DNA提取。
1.5DNA提取
1.5.1纯菌DNA提取
菌种按1∶50(体积比)比例接种至5 mL NB,于37℃培养24 h后,再次按1∶50接种,于37℃培养24 h,取1 mL菌悬液做10倍梯度稀释,各取1 mL使用用细菌基因组DNA提取试剂盒分别提取基因组DNA,测定OD260/OD280、DNA浓度,剩余置于-20℃保存备用。
另1 mL菌悬液做10倍梯度稀释,取100 μL适当的几个稀释倍数的培养物涂布于NB平板,37℃过夜培养后,计数初始培养物中每毫升培养物中的菌落形成单位(CFU)。
1.5.2菌体-磁球复合物悬液的DNA提取
使用高速低温离心机12 000 r/min将菌体-磁球复合物离心弃上清后,使用上述试剂盒提取DNA。
1.6双重荧光定量PCR及标准曲线的制作
双重荧光定量PCR反应体系为20 μL:10 mL TaqMan Fast Universal PCR Master Mix(2×),探针(2.5 μmol/L)各1 μL,引物(10 μmol/L)各1 μL,DNA模板1 μL(标曲实验中两种菌DNA溶液各1 μL;免疫磁分离实验中得到DNA溶液上样量为1 μL),补水至20 μL;反应条件:95℃、20 s,95℃、3 s,60℃、30 s,40个循环。
以纯菌DNA作10倍梯度稀释后的DNA为模板进行荧光定量PCR扩增,以浓度的对数为横坐标,Ct值为纵坐标制作标准曲线。
1.7特异性检测
1.7.1引物特异性检测
从沙门氏菌和金黄色葡萄球菌中提取DNA进行PCR扩增检测引物特异性。
1.7.2免疫磁球特异性检测
取已知浓度的沙门氏菌和金黄色葡萄球菌菌悬液,稀释至102CFU/mL,使用一种免疫磁球分别去捕获两种菌株。条件如下:将一种菌液1 mL加入到装有一种免疫磁球的离心管中,室温结合30 min,磁分离30 min,弃悬浮液,1mLPBS洗涤磁球-细菌复合体3次,加入1 mL 1×PBS使离心管中的磁球充分分散,分别取洗涤后的上清和最终磁球悬液400 μL,涂布,37℃培养24 h后观察。
1.8检测限的测定
取经国标标准检验证实为沙门氏菌和金黄色葡萄球菌均为阴性的50份猪肉样品被平均分成5组,将经过菌落计数的一定数量的沙门氏菌和金黄色葡萄球菌做10倍梯度稀释后,每份加入1 mL菌悬液,按照1.4.2节的方法进行免疫磁分离捕获目标菌后,按照1.5.2的方法提取DNA,用双重荧光定量PCR进行检测。每一组添加1份样品作为空白对照,使用相同方法检测。
1.9方法的相对灵敏度、特异性和准确度的评价
用以测定检测限的样品以及用以实际样品检测的样品一起被用以计算本研究方法的灵敏度、特异性和准确度。方法如下:接种目标菌的样品,该目标菌的RT-PCR检测结果为阳性,记为检测阳性;没有接种目标菌的样品,该目标菌的RT-PCR检测结果为阴性,记为检测阴性;没有接种目标菌的样品,但该目标菌的RT-PCR检测结果为阳性,记为阳性偏差;接种目标菌的样品,但该目标菌的RT-PCR检测结果为阴性,记为阴性偏差。灵敏度/%=[检测阳性总数/(检测阳性总数+阴性偏差总数)]×100,特异性/%=[检测阴性总数/(检测阴性总数+阳性偏差总数)]×100,准确度/%=[(检测阳性总数+检测阴性总数)/样品总数]×100。
1.10实际样品检测
从本地各大超市购买的70份鲜猪肉样品,分别使用国标方法和IMS-RT-PCR方法进行检测,比较两种方法的。
2结果与分析
2.1特异性检测
2.1.1引物特异性检测
提取沙门氏菌、金黄色葡萄球菌的DNA后,分别以沙门氏菌DNA、金黄色葡萄球菌DNA、沙门氏菌和金黄色葡萄球菌的混合DNA为模板进行扩增。图1可知扩增条带与预期片段大小一致。

图1 引物特异性PCR电泳图Fig.1Electrophoresis test for the specificity of primers
2.1.2免疫磁球特异性检测
免疫磁球特异性实验结果见表3。
实验结果显示沙门氏菌和金黄色葡萄球菌的特异性免疫磁球均具有较高的特异性,没有明显的非特异性吸附。
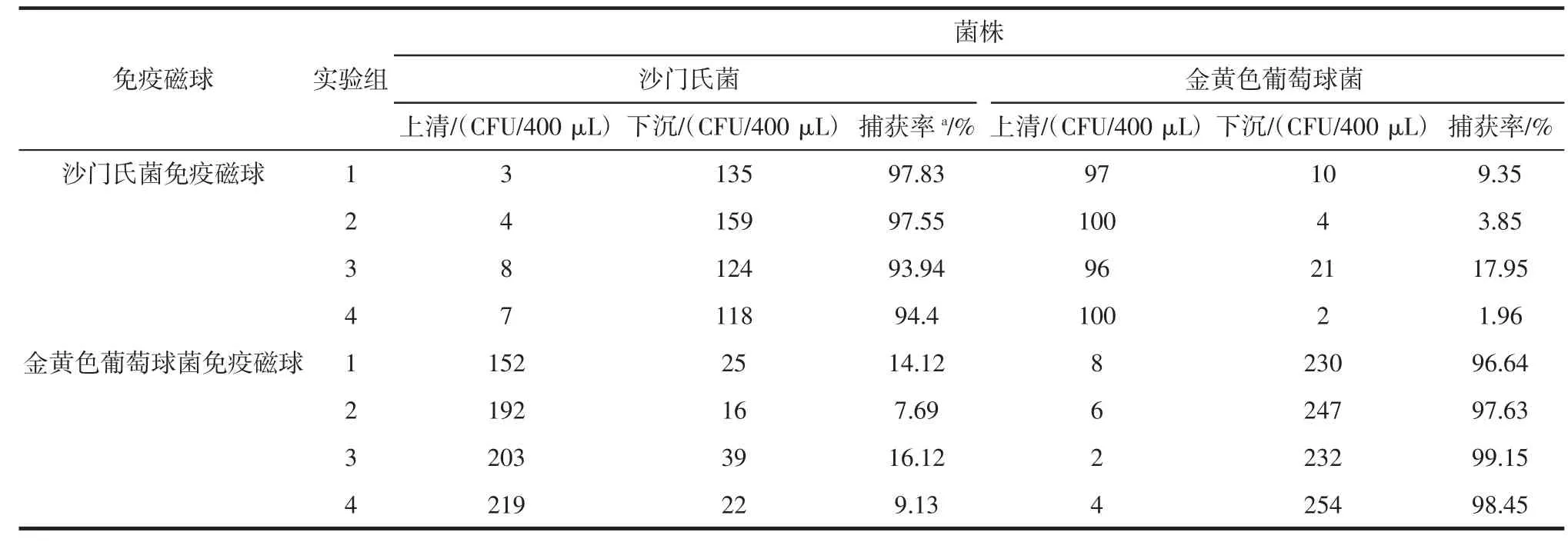
表3 免疫磁球特异性实验Table 3Specificity detectionof IMBs
2.2双重荧光定量PCR标准曲线
沙门氏菌、金黄色葡萄球菌原菌液做10倍稀释,沙门氏菌取浓度依次为90、900、9 000、90 000、900 000 CFU/mL,金黄色葡萄球菌取浓度依次为230、2 300、23 000、23 000、2 300 000 CFU/mL,各取1 mL提取DNA,并以此DNA为模板进行荧光定量PCR扩增,以浓度的对数为横坐标,Ct值为纵坐标制作标准曲线。根据双重荧光定量PCR的标准曲线(图2),可知两种菌的标曲的相关系数均大于为0.99,表明在在此DNA浓度的稀释范围内,浓度与Ct值有很好的线性关系。标准偏差均低于0.6,表明每个点具有很好的重复性。
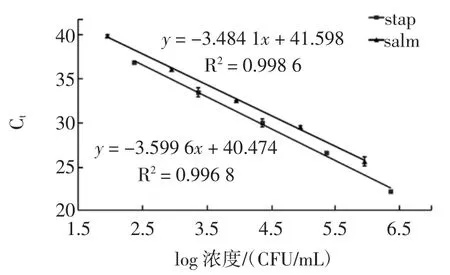
图2 双重荧光定量PCR标准曲线Fig.2Standard curve of duplex real-time PCR
2.3检测限的测定
5组猪肉样品按照1.4.2方法接种沙门氏菌和金黄色葡萄球菌,250 mL体系中沙门氏菌的终浓度分别为0.36、3.6、36、360、3 600 CFU/g,金黄色葡萄球菌的终浓度分别为0.92、9.2、92、920、9 200 CFU/g。其中,一组接种0.36 CFU/g沙门氏菌、0.92 CFU/g金黄色葡萄球菌的10个样品中,只有2个样品的沙门氏菌RT-PCR检测为阳性,金黄色葡萄球菌RT-PCR检测均为阴性,故此组不作为双重荧光定量PCR检测限测定的有效数据。所以,免疫磁分离-双重荧光定量PCR检测猪肉样品中沙门氏菌和金黄色葡萄球菌的检测限分别达到3.6 CFU/g和9.2 CFU/g。
2.4方法的检测灵敏度、特异性和准确度的评价
用以测定检测限的4组共45份样品(包括40个接种样品和5个空白对照样品)被用以计算本研究方法的灵敏度、特异性和准确度,见表4。

表4 方法的相对灵敏度、特异性和准确度Table 4Relative sensitivity,specificity and accuracy of the IMS-multiplex RT-PCR method
实验中发现一例金黄色葡萄球菌检测阴性偏差。本方法的总体灵敏度为98.8%,特异性为100%,准确度为98.9%。
2.5实际样品检测
使用国标方法以及本研究的方法对70份鲜猪肉进行的检测结果显示,国标方法检出沙门氏菌阳性2例,RT-PCR对此2份样品的检测结果也为阳性,两种方法对其余样品的沙门氏菌检测结果均为阴性。国标方法检出金黄色葡萄球菌阳性3例,RT-PCR对此3份样品的检测结果也为阳性,两种方法对其余样品的金黄色葡萄球菌检测结果均为阴性。
3讨论
随着食品卫生要求的不断提高,快速检测食品微生物在食品安全中的重要性愈加明显。本研究开发了一种同时检测沙门氏菌和金黄色葡萄球菌的方法,能够在3 h以内完成对鲜猪肉样品的沙门氏菌和金黄色葡萄球菌的检测。
获得高纯度的目标菌株的DNA是得到好的检测结果的前提。猪肉样品中油脂成分、培养基成分以及DNA提取过程中的提取液的残留成分,都可能会对PCR反应产生抑制作用,影响检测结果的准确性[24]。包被有特异性免疫多克隆抗体的磁球能够与目标菌株特异性结合,既能够保证对目标菌的高效富集,又能够通过磁分离技术有效地将目标菌株与猪肉中的杂质分离,实现对目标菌株的捕获。
本研究中使用180 nm之间的Fe3O4磁性复合微球制备纳米免疫磁球,由于具有较大的比表面积,因而在捕获微生物等目标物时表现出更高捕获效率;同时由于其较小的粒径而表现出很好的溶液稳定性,使得小粒径的纳米免疫磁球表现出高磁分离效率。本研究中采用的沙门氏菌特异性多克隆抗体和金黄色葡萄球菌的特异性多克隆抗体的特异性都高达95%以上,分别达到95.93%、97.97%,同时对非目标菌株的非特异性吸附控制在18%以下(表3)。
目前荧光定量PCR探针的淬灭基团的选择大多为TAMRA,但考虑到TAMRA自身也是荧光染料,在淬灭报告基团的同时,会在更高波长处发射荧光;而BHQ系列为非荧光染料,淬灭报告基团时,自身不发射荧光,探针荧光本底比TAMRA低,检测灵敏度更高[25],故本研究选用BHQ为探针的淬灭基团。
对检测线的测定结果显示,两种菌检测限能够达到10 CFU/g及以下。沙门氏菌的检测限达到3.6 CFU/g,金黄色葡萄球菌的检测限达到9.2 CFU/g。针对两种菌的检测结果显示,本方法的检测灵敏度、特异性和准确度均比较理想。目前很多研究食源性致病菌检测的研究中,通常仅使用检出率对不同方法进行比对,不够全面也不够科学。使用灵敏度、特异性和准确度三个参数来衡量本方法,更能体现本方法的可靠性,更具科学性。
对从不同地区购买的70个鲜猪肉样品的检测结果显示,相比国标方法,本方法针对沙门氏菌和金黄色葡萄球菌的检测灵敏度、特异性和准确度均达到100%。这些实验结果显示本研究方法在针对鲜猪肉中沙门氏菌和金黄色葡萄球菌的同时检测当中可以作为一种可靠地快速检测手段。
[1]BALABAN N,RASOOLY A.Staphylococcal enterotoxins[J].InternationalJournalofFoodMicrobiology,2000,61(1):1-10
[2]KOTZEKIDOU P.Survey of Listeria monocytogenes,Salmonella spp. and Escherichia coli O157:H7 in raw ingredients and ready-to-eat products by commercial real-time PCR kits[J].Food Microbiology,2013,35(2):86-91
[3]毛雪丹,胡俊峰,刘秀梅.2003-2007年中国1060起细菌性食源性疾病流行病学特征分析[J].中国食品卫生杂志,2010,22(3): 224-228
[4]YANG K,JENKINS D M,SU W W.Rapid concentration of bacteria using submicron magnetic anion exchangers for improving PCR-based multiplex pathogen detection[J].Journal of Microbiological Methods,2011,86(1):69-77
[5]刘红玉,李岩,崔洪斌.肉中4种致病菌的PCR快速检测方法的建立[J].食品科学,2011,32(6):213-216
[6]KIM J,DEMEKE T,CLEAR R M,et al.Simultaneous detection by PCR of Escherichia coli,Listeria monocytogenes and Salmonella typhimurium in artificially inoculated wheat grain[J].International JournalofFoodMicrobiology,2006,111(1):21-25
[7]但现龙,刘斌,李小玲,等.添加有扩增内标的沙门氏菌荧光定量PCR检测体系的建立与评价[J].微生物学报,2011,51(8):1119-1127
[8]ELIZAQUIVEL P,GABALDON J A,AZNAR R.Quantification of Salmonella spp.,Listeria monocytogenes and Escherichia coli O157: H7 in non-spikedfoodproductsand evaluation of real-timePCR as a diagnostic tool in routine food analysis[J].Food Control,2011,22(2): 158-164
[9]FUSCO V,QUERO G M,MOREA M,et al.Rapid and reliable identification of Staphylococcus aureus harbouring the enterotoxin gene cluster(egc)andquantitativedetection in raw milk by real timePCR[J].International Journal of Food Microbiology,2011,144(3):528-537
[10]胡慧,陈雅君,段志刚,等.大肠杆菌O157_H7特异基因的实时荧光定量PCR检测[J].食品科学,2011,32(12):278-282
[11]PENNACCHIA C,ERCOLINI D,VILLANI F.Development of a Real-Time PCR assay for the specific detection of Brochothrix thermosphactain fresh andspoiledrawmeat[J].InternationalJournalofFood Microbiology,2009,134(3):230-236
[12]BIRCE M,GRIFFITHS M W.Combination of immunomagnetic separation with real-time PCR for rapid detection of Salmonella in milk,ground beef,and alfalfa sprouts[J].Journal of Food Protection,2005,68(3):557-561
[13]邵彪,陈刚,许蓓蓓,等.TaqMan探针法荧光定量PCR检测食品中金黄色葡萄球菌[J].中国卫生检验杂志,2012,22(2):273-275
[14]ZHAOY,YEM,CHAO Q,et al.Simultaneous detection of multifoodborne pathogenic bacteria based on functionalized quantum dots coupled with immunomagnetic separation in food samples[J].Journal ofAgriculturalandFoodChemistry,2008,57(2):517-524
[15]陈诺,唐善虎,陈进会,等.双重PCR方法检测沙门氏菌和空肠弯曲菌[J].食品科学,2010,31(22):403-406
[16]TAHA E G,MOHAMED A,SRIVASTAVA K,et al.Rapid detection of Salmonella in chicken meat using immunomagnetic separation,CHROMagar,ELISA and real-time polymerase chain reaction(RTPCR)[J].International Journal of Poultry Science,2010,9(9):831-835
[17]XIAO X,YANG X,LIU T,et al.Preparing a highly specific inert immunomolecular-magnetic beads for rapid detection and separation of S.aureus and group G Streptococcus[J].Applied microbiology and biotechnology,2007,75(5):1209-1216
[18]HAGREN V,PIIA V L,SYRJALA A,et al.An 8-hour system for Salmonella detection with immunomagnetic separation and homogeneous time-resolved fluorescence PCR[J].International Journal of FoodMicrobiology,2008,125(2):158-161
[19]BIRCE M T,AYTAC S A.Application of magnetic immuno-polymerase chain reaction assay for detection of Salmonella spp.in chicken meats[J].European Food Research and Technology,2009,229(4):623-628
[20]中华人民共和国卫生部.GB 4789.4-2010食品安全国家标准食品微生物学检验沙门氏菌检验[S].北京:中国标准出版社,2010: 1-20
[21]中华人民共和国卫生部.GB 4789.10-2010食品安全国家标准食品微生物学检验金黄色葡萄球检验[S].北京:中国标准出版社,2010:1-16
[22]WANG L X,LI YONG,MUSTAPHA A.Rapid and Simultaneous QuantitationofEscherichiacoliO157H7,Salmonella,and Shigella in Ground Beef by Multiplex Real-Time PCR and Immunomagnetic Separation[J].JournalofFoodProtection,2007,70(6):1366-1372
[23]徐义刚,李苏龙,李丹丹,等.食品中金黄色葡萄球菌DNA环介导恒温扩增快速检测方法的建立与应用[J].中国农业科学,2010,43(8):1655-1663
[24]FAN W,HAMILTON T,Webster-Sesay S,et al.Multiplex real-time SYBR Green I PCR assay for detection of tetracycline efflux genes of Gram-negative bacteria[J].Molecular and cellular probes,2007,21(4):245-256
[25]BUSTION S A.Quantification of mRNA using real-time reverse transcription PCR(RT-PCR):trends and problems[J].Journal of MolecularEndocrinology,2002,29(1):23-29
Real-Time PCR Assay for Salmonella and Staphylococcus Aureus in Pork
MA Kai,BAI Yu,CHEN Er-ning,LIU Jie,LIU Yue,WU Hui-juan,GAO Li-juan*
(Beijing Centre for Physical and Chemical Analysis,Beijing 100089,China)
In this study,a rapid and simultaneous detection for Salmonella sp.and Staphylococcus(S.)aureus from fresh pork samples was developed by combining immunomagnetic separation(IMS)with duplex real-time PCR(RT-PCR).Magnetic beads coated with specific antibodies were used to capture the pathogens from 250 mL at 37℃.Then,duplex RT-PCR was applied with two sets of specific primers and probes.The limit of detections were 3.6 CFU/g for Salmonella,and 9.2 CFU/g for S.aureus.The sensitivity,specificity,and accuracy of IMS-multiplex RT-PCR method were 98.8%,100%,and 98.8%,respectively.IMS-duplex RT-PCR method is more rapid and effective than GB method,and which was suitable for the rapid detection of Salmonella and Staphylococcus aureus in fresh pork.
Salmonella;Staphylococcus aureus;immunomagnetic separation;duplex real-time PCR
10.3969/j.issn.1005-6521.2015.17.030
2014-02-09
北京市科技新星(2008B31)
马凯(1986—),男(汉),助理研究员,硕士研究生,研究方向:食品微生物学。

